- •П.2. Гибридизация атомов углерода в органических соединениях.
- •Электрон имеет заряд минус один!!! Во всех стабильных соединениях углерод практически всегда четырехвалентен!!!
- •Запомнить:
- •П. 3.2. Формальный и частичный заряды атомов в молекулах и ионах.
- •П. 3.3. Определение формального заряда атома в соединении или ионе.
- •П.4. Понятие об индуктивном эффекте заместителей.
- •П.5. Влияние индуктивного эффекта заместителей на стабильность карбокатионов и карбанионов.
- •П.6. Мезомерный эффект заместителей. Теория резонанса.
- •П.7. Реакции электрофильного присоединения в ряду алкенов.
- •П.8. Реакции нуклеофильного замещения.
П.1. ОБРАЗОВАНИЕ И РАЗРЫВ ХИМИЧЕСКИХ СВЯЗЕЙ.
В процессе изучения органической химии Вы регулярно встречаетесь с разнообразными химическими реакциями. При их протекании одни вещества (исходные вещества или реагенты) превращаются в другие (продукты реакции). Химические реакции протекают за счет разрыва одних химических связей и образования других связей. Именно поэтому так важно знать способы образования и разрыва химической связи.
Ковалентная связь всегда образуется за счет двух электронов. При изображении структурных формул органических соединений ковалентную связь изображают в виде черточки (‑) или же в виде пары электронов (:).

Существует лишь два механизма образования ковалентной связи: обменный и донорно-акцепторный. При обменном механизме ковалентная связь между двумя атомами образуется за счет двух электронов – по одному неспаренному электрону от каждого из атомов, образующих связь. Примером может служить образование молекулы водорода Н2 из двух атомов водорода. Атомы водорода являются свободными радикалами, поскольку по определению радикал – это частица с одним или несколькими неспаренными электронами.
ЗАПОМНИТЬ!!!
Процесс, обратный образованию ковалентной связи по обменному механизму, в результате которого образуются два свободных радикала, называется гомолитическим разрывом связи.
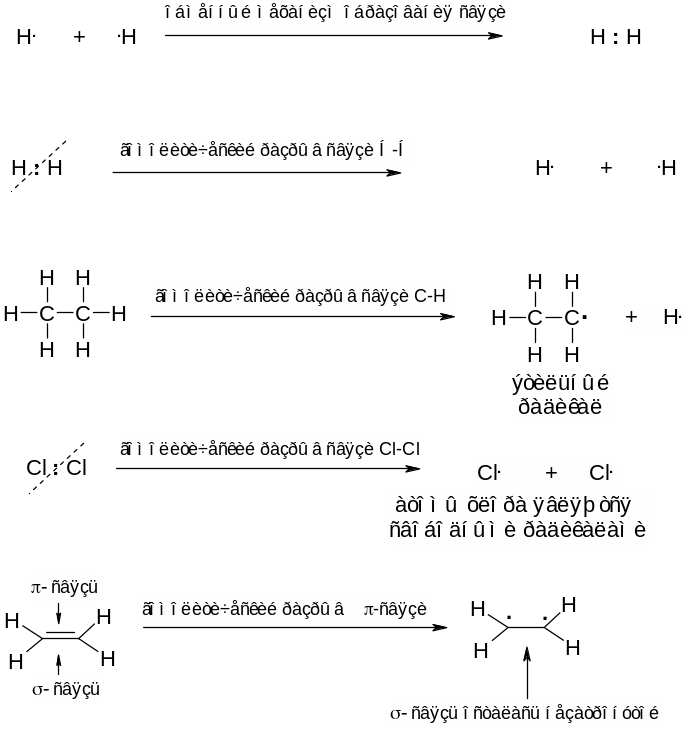
При донорно-акцепторном механизме ковалентная связь между двумя атомами образуется также за счет двух электронов – неподеленной электронной пары атома-донора и пустой орбитали атома-акцептора. В органической химии частицу с неподеленной электронной парой называют нуклеофилом, а частицу с пустой орбиталью – электрофилом. Таким образом, нуклеофил может взаимодействовать с электрофилом с образованием связи по донорно‑акцепторному механизму. Две нуклеофильные частицы, равно как и две электрофильные частицы не взаимодействуют друг с другом.
ЗАПОМНИТЬ!!!
Процесс обратный образованию связи по донорно-акцепторному механизму называется гетеролитическим разрывом сввязи. При этом часто (но не всегда!!!) образуются заряженные частицы ‑ ионы.
ЗАПОМНИТЬ!!!!
Частица с неподеленной электронной парой называется нуклеофил, а частица с пустой орбиталью – электрофил.

П.2. Гибридизация атомов углерода в органических соединениях.
Напомним, что атом углерода является шестым элементом таблицы Менделеева, поэтому заряд его ядра равен +6, а вокруг ядра находится 6 электронов, общий заряд которых ‑6 (заряд электрона «минус один»!!!). Атом в целом электронейтрален.
Электронная конфигурация атома углерода в основном состоянии 1s22s22p2, а в возбужденнм - 1s22s12p3.
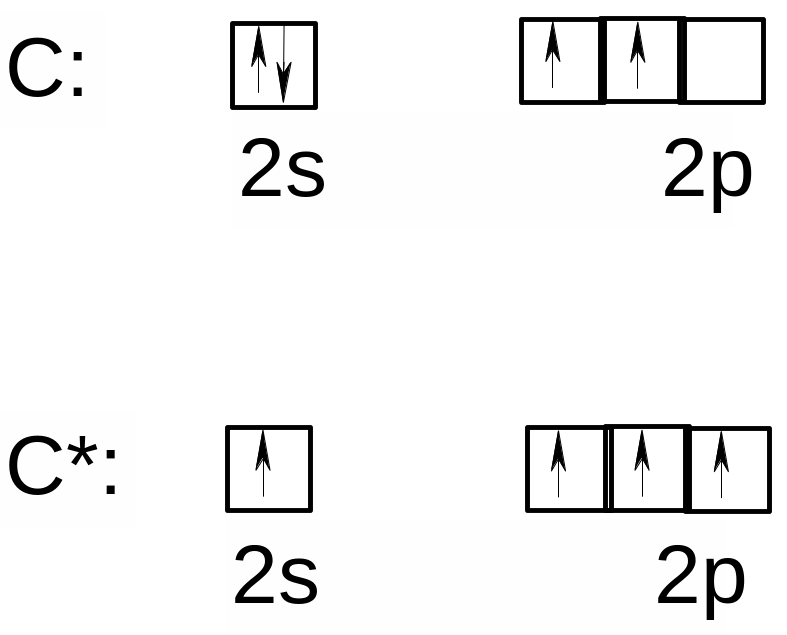
В возбужденном состоянии атом углерода имеет четыре неспаренных электрона. Поскольку ковалентная связь обычно образуется за счет двух неспаренных электронов (по одному неспаренному электрону от каждого из двух атомов, образующих химическую связь), то количество неспаренных электронов равняется валентности атома. Именно возбужденное состояние (обозначается С*), обладающее четырьмя неспаренными электронами, ответственно за образование химических соединений углерода, поскольку УГЛЕРОД ПРАКТИЧЕСКИ ВСЕГДА ЧЕТЫРЕХВАЛЕНТЕН.
Запомнить:
Электрон имеет заряд минус один!!! Во всех стабильных соединениях углерод практически всегда четырехвалентен!!!
Несмотря на постоянную валентность углерода, он может по‑разному использовать свои валентности в зависимости от количества и валентности связанных с ним атомов. Можно придумать следующие возможные случаи:

Количество соседей, с которыми связан атом углерода, определяет геометрию молекулы. К примеру, молекула синильной кислоты HCN линейна: центральный атом углерода связан одной связью с атомом водорода Н и тройной связью с атомом азота N. Одинарная связь образована двумя электронами, а тройная – шестью. Поскольку электроны отталкиваются друг от друга, то связи С‑Н и С≡N пытаются МАКСИМАЛЬНО оттолкнуться друг от друга в пространстве, образуя между собой угол 180о (больше уже некуда) и обеспечивая линейность молекулы.
Аналогичным образом, три соседа центрального атома углерода в молекуле формальдегида СН2О, максимально отталкиваясь друг от друга, обеспечивают геометрию этой молекулы: молекула формальдегида – плоская, то есть все атомы лежат в одной плоскости, углы Н‑С‑Н и Н‑С‑О составляют около 120о.
По аналогичным причинам молекула метана имеет тетраэдрической строение, валентный угол Н‑С‑Н составляет 109.47о. Именно такое строение обеспечивает максимальную взаимоудаленность четырех связей С‑Н.
Приведенные выше предсказания структуры органических молекул сделаны в рамках метода Отталкивания Валентных Электронных Пар (метод ОВЭП). Однако чаще всего геометрию органических (и неорганических) частиц объясняют с привлечением представлений о гибридизации центрального атома, в нашем случае речь идет о гибридизации атома углерода.
Упомянем основные положения, необходимые для понимания концепции гибридизации, не вдаваясь в строгие обоснования и чрезмерные пояснения, которые бы заняли слишком много места:
В возбужденном состоянии атом углерода характеризуется электронной конфигурацией …2s12p3, в котором на четырех орбиталях (одной s‑типа и трех p‑типа) находятся четыре неспаренных электрона, что обеспечивает четырехвалентность атома углерода.
![]()
Атом углерода может образовывать химические связи со своим соседями не только за счет чистых s‑ и p‑орбиталей, но и за счет некоторых смешанных, гибридных орбиталей, образованных путем смешения, гибридизации исходных s‑ и р‑орбиталей. К примеру, атом углерода из одной s‑ и одной p‑орбитали может в случае необходимости образовать две новые орбитали, называемые sp‑гибридными (то есть s1p1‑гибридными, символы «1» принято опускать), и использовать их, наряду с оставшимися двумя р‑орбиталями, для образования четырех химических связей. Аналогично, в случае необходимости атом углерода углерода из одной s‑ и двух p‑орбиталей может образовать три новые орбитали, называемые sp2‑гибридными, и использовать их, наряду с оставшейся р‑орбиталью, для образования четырех химических связей. Атом углерода может задействовать одну s‑ и три p‑орбитали, то есть все свои валентные орбитали, для образования четырех sp3‑гибридных орбиталей.
Одинарная связь между двумя любыми атомами представляет собой связь σ‑типа, иначе говоря σ‑связь. Двойная связь между двумя любыми атомами представляет собой одну σ‑связь и одну π‑связь. Тройная связь представляет собой одну σ‑связь и две π‑связи. Таким образом, между двумя связанными атомами всегда имеется одна и только одна σ‑связь, все остальные связи (в случае их наличия) относятся к π‑типу.
σ‑Связи всегда образуются за счет гибридных орбиталей. Чаще всего верно и обратное: гибридные (то есть sp, sp2 или sp3 типов) орбитали используются лишь для образования σ‑связей и таким образом число σ‑связей, образуемых атомом углерода равняется количеству гибридных орбиталей, которое у него имеется. На гибридных орбиталях могут располагаются также неподеленные электронные пары рассматриваемого атома, однако у атома четырехвалентного углерода таковых не имеется, поэтому для стабильных соединений углерода, где углерод четырехвалентен и не имеет неподеленных пар электронов, гибридные орбитали используются лишь для образования σ‑связей, а число σ‑связей, образуемых атомом углерода равняется количеству гибридных орбиталей, которое у него имеется.
Из предыдущих двух пунктов следует, что количество соседей, с которыми связан центральный атом, равен количеству σ‑связей, образованных им (смотри пункт 3). К примеру, атом углерода в молекуле метана связан с четырьмя соседями, и поэтому образует четыре σ‑связи. Аналогично, атом углерода в формальдегиде образует три σ‑связи, а в синильной кислоте – всего две σ‑связи. Нетрудно понять (смотри пункт 4), что атом углерода в метане находится в sp3‑гибридном состоянии, поскольку именно это гибридное состояние позволяет атому углерода иметь четыре гибридные орбитали, за счет которых он и образует четыре σ‑связи (смотри предыдущий пункт).
ЗАПОМНИТЬ!!!
Для того, чтобы определить гибридизацию атома четырехвалентного углерода в органическом соединении необходимо посчитать количество атомов, с которым этот атом углерода связан (т.е. количество соседей). Двум соседям (как в молекуле HCN) соответствует sp‑гибридизация (т.к. sp = s1p1, а 1+1=2 соседа). Трем соседям (как в молекуле формальдегида СН2О) соответствует sp2‑гибридизация (т.к. sp2 = s1p2, а 1+2=3 соседа). Четырем соседям (как в молекуле метана СН4) соответствует sp3‑гибридизация (т.к. sp3 = s1p3, а 1+3=4 соседа).
В случае если у атома углерода после осуществления процесса гибридизации еще остаются чистые р‑орбитали (как в случае sp и sp2, но не sp3 гибридизации), он использует их для образования π‑связей.
Гибридные (то есть sp, sp2 или sp3 типов) орбитали стараются максимально оттолкнуться друг от друга в пространстве, вне зависимости от наличия негибридизованных р‑орбиталей.
Геометрия молекулы определяется расположением в пространстве атомов, связанных с центральным атомом углерода. Поскольку к каждому из соседей, связанных с центральным атомом углерода, направлена лишь одна σ‑связь, то геометрия молекулы определяется КОЛИЧЕСТВОМ И ВЗАИМНЫМ РАСПОЛОЖЕНИЕМ σ‑связей. Последнее же полностью определяется типом гибридизации атома углерода.
К примеру, sp‑гибридный атом углерода может образовать (и образует!) только две σ‑связи, еще две связи он образует по π‑типу (углерод всегда четырехвалентен). Две σ‑связи sp‑гибридного атома углерода стараются максимально оттолкнуться в пространстве (см. предыдущий пункт), образуя между собой угол 180о – этот случай как раз и реализуется в линейной молекуле синильной кислоты HCN). По сути дела π‑связи не определяют геометрию молеклы.
Рассмотрим молекулу формальдегида СН2О. Центральный атом углерода связан с тремя соседями, то есть образует три σ‑связи. Чтобы образовать три σ‑связи атому углерода необходимо иметь три гибридные орбитали. Чтобы их иметь, надо использовать три исходные орбитали для гибридизации, то есть одну s и одну р‑орбиталь. Значит, атом углерода в молекуле формальдегида находится в состоянии sp2‑гибридизации. Это состояние обеспечивает ему наличие трех гибридных орбиталей, которые стремятся максимально растолкнуться в пространстве, то есть лежат в одной плоскости под углом 120 оС. За счет этих орбиталей он образует две связи С‑Н и одну связь С‑О. У атома углерода есть еще р‑орбиталь, которую он использует для образования π‑связи.
Рассмотрим несколько примеров определения типа гибридизации других атомов. К примеру, рассмотрим атом кислорода в молекуле воды. Атом кислорода имеет два соседа (атомы водорода), то есть образует две σ‑связи, на образование которых атому кислорода требуется две гибридные орбитали. В отличие от атома четырехвалентного углерода атом кислорода в молекуле воды имеет вдобавок две неподеленные электронные пары. Они тоже располагаются на гибридных орбиталях (смотри ранее пункт 4). Таким образом кислород имеет четыре гибридные орбитали и ему соответствует sp3‑гибридизация. Все гибридные орбитали максимально отталкиваются в пространстве, образуя угол 109.47о. Таким образом, валентный угол Н‑О‑Н в воде, предсказанный на основании представлений о гибридизации, должен составлять 109.47о. Реальная величина, найденная опытным путем, равна 105о. Уменьшение угла Н‑О‑Н обычно связывают с тем, что неподеленным электронным парам необходимо несколько больше места в пространстве, чем связывающим электронным парам, образующим связь О:Н. Это приводит к большему отталкиванию между неподеленными парами электронов, чуть меньшему отталкиванию между электронами связей О‑Н, что и ведет к некоторому уменьшению валентного угла Н‑О‑Н по сравнению с тетраэдрическим (109.47о). Две неподеленные электронные пары атома кислорода направлены к вершинам тетраэдра. Важно, однако, понимать, что молекула воды имеет угловое строение, а не тетраэдрическое, поскольку строение молекулы определяется относительным расположением атомов, в данном случае кислорода и водорода, а не неподеленных электронных пар
![]()
Еще один пример: определение гибридизации атома кислорода в формальдегиде. Атом кислорода связан лишь с атомом углерода (т.е. образует одну σ‑связь), к тому же имеет две неподеленные электронные пары. Итого: кислород находится в sp2‑гибридном состоянии.
П.3. ПОНЯТИЕ О ФОРМАЛЬНОМ И ЧАСТИЧНОМ ЗАРЯДЕ.
П.3.1. Заряд электрона. Электронная конфигурация и валентность углерода.
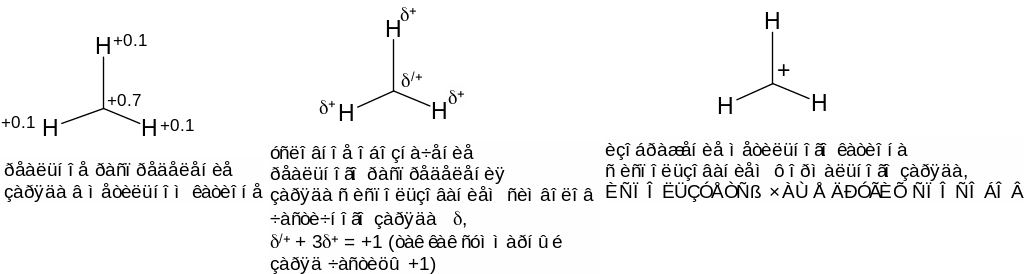
Вспомним, как получаются катионы и анионы. Если нейтральный атом, к примеру, атом водорода Н, приобретает дополнительный электрон, то он превращается в отрицательно заряженный ион – анион (Н-). Некоторые не могут этого запомнить: они считают, что если электрон «пришел», то заряд получившейся частицы «плюс», ведь «пришел – это плюс, а ушел – это минус». Если Вы относитесь к этой категории людей, то Вам надо просто регулярно это повторять, лучше на примерах типа: атом натрия стоит в первой группе таблицы Менделеева (и чаще смотрите на таблицу!!!), поэтому он одновалентен. Как и любой металл, натрий склонен отдавать свой один валентный электрон, при этом атом натрия превращается….превращается…. в положительно заряженный ион Na+. ЭЛЕКТРОН ИМЕЕТ ЗАРЯД МИНУС ОДИН!!! ПРИ ПОТЕРЕ ЭЛЕКТРОНА ЗАРЯД ЧАСТИЦЫ УВЕЛИЧИВАЕТСЯ НА ЕДИНИЦУ.
Запомните: Вы не в магазине, где если Вы отдали деньги, то это «минус», а если что-нибудь нашли, то это «плюс».
Повторяю: если атом водорода присоединил электрон, то заряд получившейся частицы «минус», и наоборот если от атома водорода оторвать электрон, то получится Н+. Анион Н- можно также обозначить Н:-, конкретизируя тот факт, что в гидрид-анионе имеется два электрона.
ЗАДАНИЕ №1:
1. Изобразите графически распределение электронов по 2s и 2p орбиталям в частицах, полученных
а) присоединением б) удалением одного электрона от атома углерода.
2. Какой из этих ионов следует обозначить С‑, а какой С+?
3. Могут ли эти ионы и каким образом проявлять валентность три?
4. Изобразите, какие частицы могут получиться при взаимодействии каждого из этих ионов с тремя атомами водорода. Какую из полученных частиц следует обозначить СН3‑, а какую СН3+?
5. Изобразите электронную формулу молекулы метана и решите, какую связь и каким образом (у какого атома окажутся электроны разрываемой связи?) необходимо разорвать, чтобы получить СН3‑. Проделайте ту же процедуру с целью получить СН3+? Какую частицу в каждом из этих случаев необходимо оторвать от молекулы метана- протон H+, гидрид-ион Н- или атом водорода Н?
КРАТКИЙ ОТВЕТ:

Знак «+» около атома углерода в метильном катионе является формальным зарядом. Он формален в том смысле, что нельзя сказать, что весь положительный заряд метильного катиона сосредоточен лишь на атоме углерода. В действительности, он распределен по все атомам этой частицы. Знак «+» около атома углерода в метильном катионе отражает его валентное состояние. То же касается знака «-» в метильном анионе.