
- •Тема 11 Теплові ефекти хімічних реакцій в розчинах. Направленність процесів
- •Фізична величина, що не є параметром термодинамічної системи:
- •Тема 12 Кінетика біохімічних реакцій
- •Тема № 13. Хімічна рівновага. Добуток розчинності. Константи стійкості та нестійкості комплексів
- •Г) додавання будь яких речовин не впливає на рівновагу.
- •Тема 14 Визначення окисно-відновного потенціалу
- •Підготовка огляду наукової літератури та створення електронних варіантів схем до тем:
- •Змістовий модуль 3. Термодинамічні та кінетичні закономірностьі перебігу процесів та електрохімічні явища в біологічних системах
Тема № 13. Хімічна рівновага. Добуток розчинності. Константи стійкості та нестійкості комплексів
1. У системі 2 SO2(г) + O2(г) 2 SO3(г), ∆H˚ < 0 встановилася рівновага. Зміною яких параметрів можна досягти зміщення рівноваги у бік утворення SO2:
а) збільшенням концентрації O2; б) підвищенням тиску;
в) підвищенням температури; г) зменшенням концентрації SO3;
д) зниження температури?
2.
У системі CaCO3
(тв)
![]() CaO
(тв)
+ CO2
(г)
;
∆H˚
> 0 встановилася
рівновага. Зміною яких параметрів можна
досягти зміщення рівноваги у бік
утворення CaO:
CaO
(тв)
+ CO2
(г)
;
∆H˚
> 0 встановилася
рівновага. Зміною яких параметрів можна
досягти зміщення рівноваги у бік
утворення CaO:
а) збільшенням концентрації СO2; б) підвищенням тиску;
в) підвищенням температури; г) зменшенням маси CaCO3;
д) зниженням температури?
3. У системі FeO (тв) + CO (г) Fe (тв) + CO2 (г); ∆H˚ < 0 встановилася рівновага. Зміною яких параметрів можна досягти зміщення рівноваги у бік утворення Fe:
а) підвищенням температури; г) збільшенням концентрації CO2;
б) підвищенням тиску; д) зменшення концентрації СО?
в) збільшенням концентрації CO;
4. У системі 2 HI (г) H2 (г) + I2(г); ∆H˚ 0 встановилася рівновага. Зміною яких умов можна досягти зміщення рівноваги у бік утворення HI:
а) зниженням температури; г) підвищенням тиску;
б) зменшенням концентрації H2 та I2; д) підвищенням температури;
в) зниженням тиску?
5. У системі СО2 (г) + С (тв) 2 СO (г); ∆H˚ 0 встановилася рівновага. Зміною яких умов можна досягти зміщення рівноваги у бік утворення СO:
а) зниженням температури; г) зменшенням концентрації СO2;
б) збільшенням тиску; д) присутністю каталізатора;
в) підвищенням температури?
6. У системі NH4Cl (тв) NH3 (г) + HCl (г); ∆H˚ 0 встановилася рівновага. Зміною яких умов можна досягти зміщення рівноваги у бік утворення NH4Cl ?
а) підвищенням температури; г) зниженням температури;
б) зменшенням концентрації HCl; д) зменшенням концентрації NH3;
в) зниженням тиску?
7.
У системі А(г)
+ В(г)
![]() С(г)
+D(тв);
∆H˚
< 0 встановилася рівновага. Зміною яких
умов
можна досягти зміщення рівноваги у бік
утворення продукту
С:
С(г)
+D(тв);
∆H˚
< 0 встановилася рівновага. Зміною яких
умов
можна досягти зміщення рівноваги у бік
утворення продукту
С:
а) підвищенням температури; б) зниженням тиску;
в) збільшенням концентрації А та В; г) зменшенням концентрації А та В;
д) присутністю каталізатора?
8. У системі С (тв) + Н2О (г) СO (г) + H2 (г); ∆H˚ 0 встановилася рівновага. Зміною яких параметрів можна досягти зміщення рівноваги у бік утворення СО:
а) зниженням температури; б) підвищенням тиску;
в) збільшенням концентрації H2; г) підвищенням температури;
д) зменшенням маси С?
9. У системі 2 SO2(г) + O2(г) 2 SO3(г); ∆H˚ < 0 встановилася рівновага. Зміною яких параметрів можна досягти зміщення рівноваги у бік утворення SO3:
а) зменшенням концентрації O2; б) зниженням тиску;
в) підвищенням температури; г) зменшенням концентрації SO2;
д) зниженням температури?
10. У системі CaCO3 (тв) CaO (тв) + CO2 (г); ∆H˚ > 0 встановилась рівновага. Зміною яких умов можна досягти зміщення рівноваги в бік утворення CaCO3:
а) зменшенням концентрації CO2; б) зниженням тиску;
в) зниженням температури; г) підвищенням температури;
д) присутністю каталізатора?
11. У системі 4 А(г) + В (тв) 2 С (г) + 2 D (г); ∆H˚ < 0 встановилась рівновага. Зміною яких умов можна досягти зміщення рівноваги в бік утворення D:
а) підвищенням температури; б) зниженням тиску;
в) збільшенням концентрації А; г) зменшенням маси В;
д) присутністю каталізатора?
12. У системі Н2 (г) + I2 (г) 2 HI (г); ∆H˚ 0 встановилась рівновага. Зміною яких умов можна досягти зміщення рівноваги в бік утворення HI:
а) пониження температури; б) підвищення тиску;
в) збільшенням концентрації Н2 і I2; г) зменшення концентрації Н2 і I2;
д) присутністю каталізатора?
13. У системі А(г) + В(г) С(г) + D(т); ∆H˚ 0 встановилася рівновага. Зміною яких параметрів можна досягти зміщення рівноваги у бік утворення продукту D:
а) зниження температури; б) зниженням тиску;
в) збільшенням концентрації С; г) підвищення температури;
д) зменшенням концентрації A та B?
14. У системі Fe3O4 (тв) + 4 H2 (г) 3 Fe (тв) + 4 H2O (г); ∆H˚ 0 встановилася рівновага. Зміною яких параметрів можна досягти зміщення рівноваги у бік утворення продукту Fe:
а) зниження температури; б) підвищенням тиску;
в) збільшенням концентрації H2O; г) зменшенням маси Fe3O4 та концентрації H2.
д) підвищенням температури?
15. Який із записів константи хімічної рівноваги для реакції
4
HCl
(г)
+ O2
(г)
![]() 2 Cl2(г)
+ 2 H2O(г)
є вірним:
2 Cl2(г)
+ 2 H2O(г)
є вірним:
а)
Kc
=
![]() ;
в)
Kc
=
;
в)
Kc
=
 ;
;
б)
Kc
=
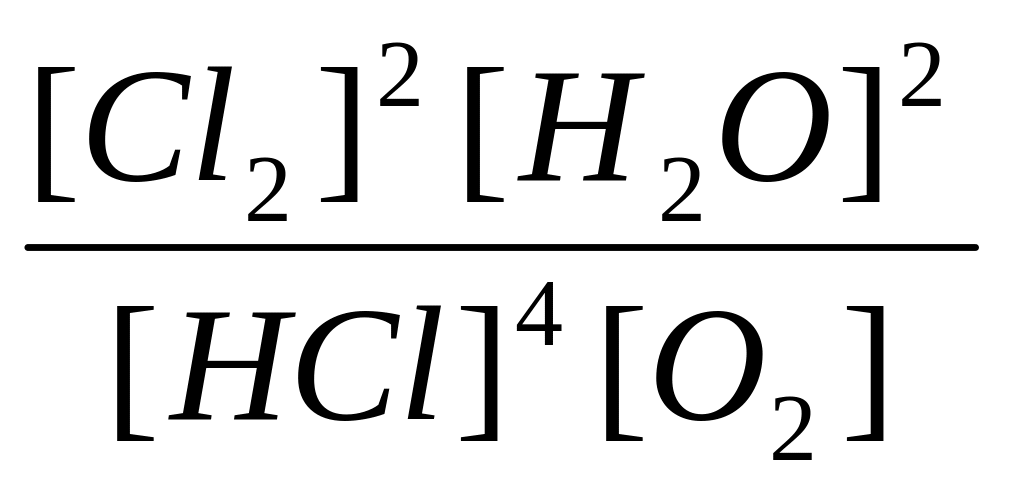 ;
г)
Kc
=
;
г)
Kc
=
![]() ?
?
16. Який із записів константи хімічної рівноваги для реакції
FeO
(тв)
+ CO
(г)
![]() Fe
(тв)
+ CO2
(г)є
вірним:
Fe
(тв)
+ CO2
(г)є
вірним:
а)
Kc
=
![]() ;
в)
Kc
=
;
в)
Kc
=
![]() ;
;
б)
Kc
=
![]() ;
г).
Kc
=
;
г).
Kc
=
![]() ?
?
17. Який із записів константи хімічної рівноваги для реакції
2 SO2(г) + O2(г) 2 SO3(г) є вірним:
а)
Kc
=
![]() ;
в)
Kc
=
;
в)
Kc
=
![]() ;
;
б)
Kc
=
 ;
г)
Kc
=
;
г)
Kc
=
![]() ?
?
18. Який із записів константи хімічної рівноваги для реакції
CaCO3
(тв)
![]() CaO
(тв)
+ CO2
(г)
є
вірним:
CaO
(тв)
+ CO2
(г)
є
вірним:
а)
Kc
=
![]() ;
в)
Kc
=
;
в)
Kc
=
![]() ;
;
б)
Kc
=
[СО2];
г).
Kc
=
![]() ?
?
19. Який із записів константи хімічної рівноваги для реакції
ZnSO4
(тв)
![]() ZnO
(тв)
+ SO3(г),
є вірним:
ZnO
(тв)
+ SO3(г),
є вірним:
а)
Kc
=
![]() ;
в)
Kc
= [SO3];
;
в)
Kc
= [SO3];
б)
Kc
=
![]() ;
г).
Kc
=
;
г).
Kc
=
![]() ?
?
20. Який із записів константи хімічної рівноваги для реакції
2
ZnS
(тв)
+ 3 O2
(г)
![]() 2 ZnO
(тв)
+ 2 SO2
(г),
є вірним:
2 ZnO
(тв)
+ 2 SO2
(г),
є вірним:
а)
Kc
=
![]() ;
в)
Kc
=
;
в)
Kc
=
 ;
;
б)
Kc
=
 ;
г).
Kc
=
;
г).
Kc
=
 ?
?
21. Який із записів константи хімічної рівноваги для реакції
5
CO
(г)
+ Fe
(тв)
![]() Fe(CO)5
(г)є
вірним:
Fe(CO)5
(г)є
вірним:
а)
Kc
=
![]() ;
б) Kc
=
;
б) Kc
=
![]() ;
в) Kc
=
;
в) Kc
=
![]() ;
г). Kc
=
;
г). Kc
=
![]() ?
?
22. Який із записів константи хімічної рівноваги для реакції
MgO
(тв)
+ H2
(г)
![]() Mg
(тв)
+ H2O
(г)є
вірним:
Mg
(тв)
+ H2O
(г)є
вірним:
а)
Kc
=
![]() ;
б) Kc
=
;
б) Kc
=
![]() ;
в) Kc
=
;
в) Kc
=
![]() ;
г). Kc
=
;
г). Kc
=
![]() ?
?
23. Який із записів константи хімічної рівноваги для реакції
СO
(г)
+ Cl2
(г)
![]() COCl2
(г)є
вірним:
COCl2
(г)є
вірним:
а)
Kc
=
![]() ;
б) Kc
=
;
б) Kc
=
![]() ;
в) Kc
=
;
в) Kc
=
![]() ;
г). Kc
=
;
г). Kc
=
![]() ?
?
24. Який із записів константи хімічної рівноваги для реакції
C
(тв)
+ H2O
(г)
![]() CO
(г)
+ H2
(г)
є
вірним:
CO
(г)
+ H2
(г)
є
вірним:
а)
Kc
=
![]() ;
б) Kc
=
;
б) Kc
=
![]() ;
в) Kc
=
;
в) Kc
=
![]() ;
г). Kc
=
;
г). Kc
=
![]() ?
?
25. Який із записів константи хімічної рівноваги для реакції
3 Н2 (г) + N2 (г) 2NH3 (г) є вірним:
а)
Kc
=
![]() ;
б)
Kc
=
;
б)
Kc
=
![]() ;
;
в)
Kc
=
![]() ;
г). Kc
=
;
г). Kc
=
 ?
?
26. Який із записів константи хімічної рівноваги для реакції
2
PbS
(тв)
+ 3 O2
(г)
![]() 2 PbO
(тв)
+
2 SO2
(г) є вірним:
2 PbO
(тв)
+
2 SO2
(г) є вірним:
а)
Kc
=
![]() ;
б) Kc
=
;
б) Kc
=
 ;
в) Kc
=
;
в) Kc
=
![]() ;
г). Kc
=
;
г). Kc
=
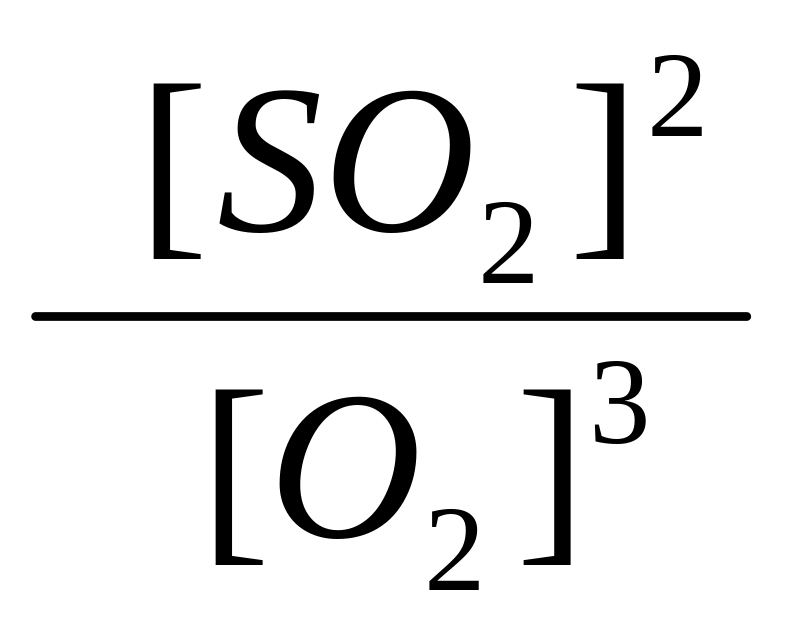 ?
?
27. Який із записів константи хімічної рівноваги для реакції
СО (г) + 2 H2 (г) СН3ОН (г) є вірним:
а)
Kc
=
![]() ;
б) Kc
=
;
б) Kc
=
![]() ;
в) Kc
=
;
в) Kc
=![]() г). Kc
=
г). Kc
=
![]() ?
?
28. При якому значенні Кс оборотні реакції проходять з найбільш повним перетворенням вихідних речовин у продукти:
а) Кс = 1; в) Кс 1; д) Кс 1.
б) Кс 1; г) Кс 1?
29. Які умови розчинення осадів електролітів відповідно до уявлення про добуток розчинності:
а) ДК < ДР; в) ДК > ДР; д) ДК ДР.
б) ДК = ДР; г) ДК ≤ ДР?
30. Яка з приведених солей найменше розчинна у воді, якщо:
а) ДР (CdS) =1,6.10-28 моль2/л2; б)ДР (CaCO3) = 4,8.10-9 моль2/л2;
в) ДР (AgI) =1,4.10-16моль2/ л2; г) ДР (CaSO4) =9,1.10-6 моль2/л2;
д) ДР (PbSO4) =1,6.10-27 моль2/л2?
31. Яка з приведених солей наймеш розчинна у воді, якщо:
а) ДР (CaC2O4) =2.10-9 моль2/л2; б) ДР (CaCO3) = 4,8.10-9 моль2/л2;
в)ДР (CdS) =1,6.10-28 моль2/л2; г) ДР (AgBr) =5,0.10-13моль2/ л2;
д) ДР (Ag2SO4) =2.10-5моль2/ л2?
32. Точним математичним виразом ДР аргентум (I) сульфату є рівняння:
а) ДР = [Ag+] [SO42-]; в) ДР= [Ag+]2 [SO42-];
б) ДР = 2[Ag+] [SO42-]; г) ДР= [Ag+]2 + [SO42-].
33. У якому варіанті вказана умова утворення пересиченого розчину аргентум (I) сульфату:
а) [Ag+]2 [SO42-] ДР; б) [Ag+] [SO42-] ДР; д) [Ag+] [SO42-] ДР.
в) [Ag+]2 [SO42-] = ДР; г) [Ag+]2 [SO42-] ДР?
34. Точним математичним виразом ДР магній (II) фосфату є рівняння:
а) ДР = [Mg2+] [РO43-]; в) ДР= [Mg2+]3 [РO43-]2; д) ДР= [Mg2+] [РO43-]2.
б) ДР = 3[Mg2+] 2[РO43-]; г) ДР= [Mg2+]3 [РO43-].
35. Пересичений розчин Ag (I) карбонату утворюється за умови, що:
а) [Ag+]2 [CO32-] = ДР; в) [Ag+] [CO32-] ДР;
б) [Ag+]2 [CO32-] ДР; г) [Ag+]2 [CO32-] ДР.
36. Точним математичним виразом ДР кальцій (II) фосфату є рівняння:
а) ДР = [Ca2+] [PO43-]; в) ДР= [Ca2+]3 [PO43-]2;
б) ДР = 3[Ca2+] 2[PO43-]; г) ДР= [Ca2+]3 + [PO43-]2.
37. Якщо в розчині Ca3(PO4)2 виконується умова [Ca2+]3 [PO43-]2 ДР, то в такому випадку утвориться:
а) насичений розчин; б) ненасичений розчин; в) пересичений розчин.
38. Добуток розчинності малорозчинних електролітів залежить від:
а) температури; б) молярної концентрації іонів;
в) концентрації солі; г) присутності іншого електроліту.
39. Яка з приведених солей найменше розчинна у воді, якщо:
а) ДР (CaCO3) =4,8.10-9 моль2/л2; б)ДР (CuS) = 4,0.10-38 моль2/л2;
в)ДР (AgBr) =5.10-13моль2/ л2 ; г)ДР (BaCO3) = 5,1.10-9 моль2/л2;
д)ДР (SrCO3) =1,1.10-10 моль2/ л2?
40. Яка умова утворення осаду важкорозчинного електроліту:
а) ДК < ДР; б) ДК > ДР; в) ДК = ДР; г) ДК ≤ ДР?
41. Як вплине присутність каталізатора на хімічну рівновагу в оборотній системі:
а) вливає лише на швидкість прямої реакції, причому рівновага порушується;
б) впливає лише на швидкість зворотної реакцій, причому рівновага порушується;
в) однаково впливає на швидкість прямої та зворотної реакцій, причому рівновага не порушиться;
г) впливає на швидкість прямої та зворотної реакцій не однаково, причому рівновага порушується?
42. Точним математичним виразом ДР аргентум (I) ортофосфату є рівняння:
а) ДР = 3[Ag+] [PO43-]; в) ДР= [Ag+]3 [PO43-];
б) ДР = [Ag+] [PO43-]; г) ДР= [Ag+] + [PO43-].
43. У якому варіанті вказана умова утворення пересиченого розчину BaSO4:
а) [Ba2+][SO42-] = ДР; в) [Ba2+][SO42-] ДР;
б) [Ba2+][SO42-] > ДР; г) [Ba2+][SO42-] ДР?
44. Якщо для розчину AgJ виконується умова [Ag+][I-] < ДР, то в такому випадку утвориться:
a) насичений розчин; б) ненасичений розчин; в) пересичений розчин.
45. Рівноважним називається такий стан системи, при якому:
а) концентрації реагуючих речовин однакові;
б) швидкості прямої і зворотної реакції рівні, вільна енергія Гіббса досягла мінімального значення;
в) вільна енергія Гіббса дорівнює нулю;
г) вільна енергія Гіббса досягла максимального значення?
46. Яка з приведених солей найбільше розчинна у воді, якщо:
а) ДР (CaSO4) =6,1.10-5 моль2/л2; б)ДР (MgCO3) = 2,0.10-4 моль2/л2;
в) ДР (CdS) =1,6.10-28 моль2/л2; г) ДР (CaCO3) = 4,8.10-9 моль2/л2;
д) ДР (AgBr) =5,0.10-13моль2/ л2?
47. Яка з приведених солей найбільше розчинна у воді, якщо:
а) ДР (CuS) =6,3.10-38 моль2/л2; б) ДР (CaCO3) = 4,8.10-9 моль2/л2;
в) ДР (AgCl) =1,7.10-10моль2/ л2 ; г) ДР (SrSO4) = 3,2.10-7 моль2/л2;
д) ДР (BaSO4) =1,1.10-10 моль2/л2?
48. Яка з приведених солей найбільше розчинна у воді, якщо:
а) ДР (ZnS) =2,5.10-22 моль2/л2; б)ДР (CaCO3) = 4,8.10-9 моль2/л2;
в) ДР (PbCl2) =1,7.10-5моль2/ л2; г) ДР (AgCl) =1,7.10-10моль2/ л2 ;
д) ДР (SrSO4) = 3,2.10-7 моль2/л2 ?
49. Яка з приведених солей найменше розчинна у воді, якщо:
а) ДР (PbS) =2,5.10-27 моль2/л2; б)ДР (CaCO3) = 4,8.10-9 моль2/л2;
в) ДР (PbCl2) =1,7.10-5моль3/ л3; г) ДР (AgCl) =1,7.10-10моль2/ л2 ;
д) ДР (SrSO4) = 3,2.10-7 моль2/л2?
50. Яка з приведених солей найменше розчинна у воді, якщо:
а) ДР (PbS) =2,5.10-27 моль2/л2; б)ДР (CdS) = 1,6.10-28 моль2/л2;
в) ДР (PbCl2) =1,7.10-5моль2/ л2; г) ДР (ZnS) =2,5.10-22 моль2/л2;
д) ДР (AgCl) =1,7.10-10моль2/ л2?
51. Яка з приведених солей найбільше розчинна у воді, якщо:
а) ДР (AgCl) =1,7.10-10 моль2/л2; б) ДР (BaCO3) = 5,1.10-10 моль2/л2;
в) ДР (PbCl2) =1,7.10-5моль2/ л2; г) ДР (PbS) =2,5.10-27 моль2/л2;
д) ДР (CdS) = 1,6.10-28 моль2/л2?
52. Яка з приведених солей найбільше розчинна у воді, якщо:
ДР (CaCO3) =4,8.10-9 моль2/л2; ДР (BaCO3) = 5,1.10-9 моль2/л2; ДР (SrCO3) =1,1.10-10 моль2/ л2; ДР (PbS) =2,5.10-27 моль2/л2; ДР (CdS) = 1,6.10-28 моль2/л2?
53. Яка з приведених солей найбільше розчинна у воді, якщо:
а) ДР (PbSO4) =1,6.10-27 моль2/л2; б) ДР (BaSO4) = 1,1.10-10 моль2/л2;
в) ДР (BaSO3) =8,0.10-7 моль2/ л2; г) ДР (CuS) = 4,0.10-38 моль2/л2;
д) ДР (AgBr) =5.10-13 моль2/ л2 ?
54. Яка з приведених солей найменше розчинна у воді, якщо:
а) ДР (CaSO4) =6,1.10-5 моль2/л2; б) ДР (BaSO3) = 8,0.10-7 моль2/л2;
в) ДР (SrCO3) =1,1.10-10 моль2/ л2 ; г) ДР (CuS) = 4,0.10-38 моль2/л2;
д) ДР (AgBr) =5.10-13 моль2/ л2 ?
55. Яка з приведених солей найбільше розчинна у воді, якщо:
а) ДР (BaSO4) = 1,1.10-10 моль2/л2; б) ДР (BaSO3) = 8,0.10-7 моль2/л2;
в) ДР (CaCO3) =4,8.10-9 моль2/ л2; г) ДР (CuS) = 4,0.10-38 моль2/л2;
д) ДР (AgBr) =5.10-13 моль2/ л2 ?
56. Яка з приведених солей найменше розчинна у воді, якщо:
а) ДР (CuS) =6,3.10-36 моль2/л2; б) ДР (CaCO3) = 4,8.10-9 моль2/л2;
в) ДР (AgCl) =1,7.10-10моль2/ л2; г) ДР (BaSO4) = 1,1.10-10 моль2/л2;
д) ДР (BaSO3) = 8,0.10-7 моль2/л2?
57. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, СaSO4, додати Na2SO4:
а) збільшиться ДР(СaSO4);
б) ДР(СaSO4) не зміниться, молярна концентрація іонів Сa2+ зменшиться, бо молярна концентрація іонів SO42- збільшиться;
в) збільшиться ДР(СaSO4) та молярна концентрація іонів Сa2+;
г) зменшиться ДР(СaSO4) та молярна концентрація іонів Сa2+?
58. При якому значенні Кс оборотні реакції проходять з найбільш повним перетворенням вихідних речовин у продукти:
а) відношення константи швидкості прямої реакції до зворотної = 1;
б) відношення константи швидкості прямої реакції до зворотної 1;
в) відношення константи швидкості прямої реакції до зворотної 1;
г) відношення константи швидкості прямої реакції до зворотної 1;
д) відношення константи швидкості прямої реакції до зворотної 1?
59. Яка з приведених солей найбільше розчинна у воді, якщо:
а) ДР (CaSO4) =9,1.10-6 моль2/л2; б)ДР (CaCO3) = 4,8.10-9 моль2/л2;
в) ДР (ВaSO4) =1,1.10-10 моль2/л2; г) ДР (PbSO4) =1,6.10-27 моль2/л2;
д) ДР (ВaCO3) = 5,1.10-9 моль2/л2?
60. Насичений розчин AgI утворюється за умови, що:
а) [Ag+][I-] > ДР; в) [Ag+][I-] ДР;
б) [Ag+][I-] = ДР; г) [Ag+][I-] ДР.
61. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, СaSO4, додати Са(NO3)2:
а) збільшиться ДР(СaSO4);
б) ДР(СaSO4) не зміниться а молярна концентрація іонів SO42- зменшиться, бо молярна концентрація іонів Са2+ збільшиться;
в) збільшиться ДР(СaSO4) та молярна концентрація іонів SO42-;
г) зменшиться ДР(СaSO4) та молярна концентрація іонів SO42-?
62. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, AgCl, додати AgNO3:
а) збільшиться ДР(AgCl);
б) ДР(AgCl) не зміниться, молярна концентрація іонів Cl- зменшиться, бо молярна концентрація іонів Ag+ збільшиться;
в) збільшиться ДР(AgCl) та молярна концентрація іонів Сl-;
г) зменшиться ДР(AgCl) та молярна концентрація іонів Сl-?
63. При поступовому додаванні розчину Na2SO4 до розчину, в якому молярні концентрації іонів - Ca2+, Sr2+, Ba2+, Pb2+ - однакові, який осад утвориться першим, якщо:
а) ДР (CaSO4) =1,3.10-4 моль2/л2; б) ДР (SrSO4) = 3,2.10-7 моль2/л2;
в) ДР (BaSO4) =1,1.10-10 моль2/л2; г) ДР (PbSO4) =1,6.10-8моль2/ л2;?
64. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом СaSO4, додати Са(NO3)2:
а) збільшиться ДР(СaSO4);
б) ДР(СaSO4) не зміниться, молярна концентрація іонів SO42- зменшиться, бо молярна концентрація іонів Сa2+ збільшиться;
в) збільшиться ДР(СaSO4) та молярна концентрація іонів SO42-;
г) зменшиться ДР(СaSO4) та молярна концентрація іонів SO42-?
65. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, BaSO3, додати BaCl2:
а) збільшиться ДР(BaSO3);
б) ДР(BaSO3) не зміниться, молярна концентрація іонів SO32- зменшиться, бо молярна концентрація іонів Ba2+ збільшиться;
в) збільшиться ДР(BaSO3) та молярна концентрація іонів SO32-;
г) зменшиться ДР(BaSO3) та молярна концентрація іонів SO32- ?
67. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, CuS, додати CuCl2:
а) збільшиться ДР(CuS);
б) ДР(CuS) не зміниться, молярна концентрація іонів S2- зменшиться, бо молярна концентрація іонів Cu2+ збільшиться;
в) збільшиться ДР(CuS) та молярна концентрація іонів S2-;
г) зменшиться ДР(CuS) та молярна концентрація іонів S2-?
68. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, CuS, додати Na2S:
а) збільшиться ДР(CuS);
б) ДР(CuS) не зміниться, молярна концентрація іонів Cu2+ зменшиться, бо молярна концентрація іонів S2- збільшиться;
в) збільшиться ДР(CuS) та молярна концентрація іонів Cu 2+;
г) зменшиться ДР(CuS) та молярна концентрація іонів Cu 2+?
69. Якщо в розчині BaSO3 виконується умова [Ba2+] [SO32-] ДР, то в такому випадку утвориться:
а) насичений розчин; б) ненасичений розчин; в) пересичений розчин.
70. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, BaF2, додати NaF:
а) збільшиться ДР(BaF2);
б) ДР(BaF2) не зміниться, молярна концентрація іонів Ba2+ зменшиться, бо молярна концентрація іонів F- збільшиться;
в) збільшиться ДР(BaF2) та молярна концентрація іонів Ba2+;
г) зменшиться ДР(BaF2) та молярна концентрація іонів Ba2+?
71. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, AgCl, додати NaCl:
а) збільшиться ДР(AgCl);
б) ДР(AgCl) не зміниться, молярна концентрація іонів Ag+ зменшиться, бо молярна концентрація іонів Cl- збільшиться;
в) збільшиться ДР(AgCl) та молярна концентрація іонів Ag+;
г) зменшиться ДР(AgCl) та молярна концентрація іонів Ag+?
72. Які зміни відбудуться, якщо до розчину, який знаходиться в рівновазі з осадом, Ag2CO3, додати AgNO3:
а) збільшиться ДР(Ag2CO3);
б) зменшиться ДР(Ag2CO3) та молярна концентрація іонів CO32-;
в) збільшиться ДР(Ag2CO3) та молярна концентрація іонів CO32-;
г) ДР(Ag2CO3) не зміниться, молярна концентрація іонів CO32- зменшиться, бо молярна концентрація іонів Ag+ збільшиться?
73. Добуток розчинності ВaSO4 1∙10-10 моль2/л2. Визначити масову концентрацію ρ(ВaSO4) в насиченому розчині. М(ВaSO4) = 233 г/моль.
а) ρ(ВaSO4) = 1.10-5 г/л; г) ρ(СaSO4) = 2,3.10-3 г/л;
б) ρ(СaSO4) = 2,3.10-19 г/л; д) ρ(СaSO4) = 2,3.10-9 г/л;
в) ρ(СaSO4) = 1∙10-10 г/л.
74. Масова концентрація кальцій сульфату в насиченому розчині
ρ(СaSO4) = 4,08.10–1 г/л. Обчислити добуток розчинності кальцій сульфату в насиченому розчині. М(CaSO4) = 136 г/моль.
а) ДР (CaSO4) = 16,0∙10-2 моль2/л2; б) ДР (CaSO4) = 9,0∙10-6 моль2/л2;
в) ДР (CaSO4) = 4,08∙10-6 моль2/л2; г) ДР (CaSO4) = 2,04∙10-1 моль2/л2;
д) ДР (CaSO4) = 4,08∙10-1 моль2/л2.
75.
Чи випаде осад при змішуванні рівних
об’ємiв
розчинів СaCl2
та Na2SO4,
молярна концентрація яких 0,01 моль/л?
![]() моль2/л2.
моль2/л2.
а) випаде тому, що ДК = 2,5.10-5 моль2/л2;
б) не випаде, тому, що ДК = 2,5.10-5 моль2/л2;
в) випаде тому, що ДК = 1.10-4 моль2/л2;
г) не випаде, тому, що ДК = 1.10-4 моль2/л2;
д) випаде тому, що ДК = 1,3.10-4 моль2/л2.
76.
Чи випаде осад при змішуванні рівних
об’ємiв
розчинів Pb(NO3)2
та HI,
молярна концентрація яких 0,04моль/л?
![]() моль3/л3.
моль3/л3.
а) випаде тому, що ДК= 8.10-6 моль3/л3;
б) не випаде, тому, що ДК= 6,4.10-5 моль3/л3;
в) випаде тому, що ДК= 1,6.10-1 моль3/л3; г). не випаде, тому, що ДК= 8.10-6 моль3/л3;
д) не випаде, тому, що ДК= 8.10-9 моль3/л3.
78.
Чи випаде осад при змішуванні рівних
об’ємiв
розчинів BaCl2
та Na2SO4,
молярна концентрація яких 0,04моль/л?
![]() моль2/л2.
моль2/л2.
а) випаде тому, що ДК = 1,6.10-3 моль2/л2;
б) не випаде, тому, що ДК = 4.10-4 моль2/л2;
в) випаде тому, що ДК = 4.10-4 моль2/л2;
г) не випаде, тому, що ДК = 1,6.10-3 моль2/л2;
д) не випаде, тому, що ДК = 1,1.10-10 моль2/л2.
79. Добуток розчинності CaSO4 9∙10-6 моль2/л2. Визначити масову концентрацію сульфату кальцію ρ(CaSO4) в насиченому розчині. М(CaSO4) = 136г/моль.
а) ρ(СaSO4) = 2,3.10-3 г/л; б) ρ(СaSO4) = 4,08.10-1 г/л;
в) ρ(СaSO4) = 5,3.10-5 г/л; г) ρ(СaSO4) = 3.10-3 г/л;
д) ρ(СaSO4) = 9,0∙10-6 г/л.
80.
Чи випаде осад при змішуванні рівних
об’ємiв
розчинів HCl
та AgNO3,
молярна концентрація яких 0,05 моль/л?
![]() моль2/л2.
моль2/л2.
а) випаде тому, що ДК = 6,25.10-4 моль2/л2;
б) не випаде, тому, що ДК = 6,25.10-4 моль2/л2;
в) випаде тому, що ДК = 2,5.10-3 моль2/л2;
г) не випаде, тому, що ДК = 2,5.10-3 моль2/л2.
81.
Чи випаде осад при змішуванні рівних
об’ємiв
розчинів AgNO3
та H2SO4,
молярна концентрація яких 0,04 моль/л?
![]() моль3/л3.
моль3/л3.
а) випаде тому, що ДК = 1,6.10-3 моль3/л3;
б) не випаде, тому, що ДК = 1,6.10-3 моль3/л3;
в) випаде тому, що ДК = 8.10-6 моль3/л3;
г) не випаде, тому, що ДК = 8.10-6 моль3/л3.
82. Масова концентрація кальцій сульфату в насиченому розчині СaSO4 ρ(СaSO4) = 4,08.10–1 г/л. Обчислити добуток розчинності кальцій сульфату. М(CaSO4) = 136 г/моль.
а) ДР (CaSO4) = 16,0∙10-2 моль2/л2; б) ДР (CaSO4) = 9,0∙10-6 моль2/л2;
в) ДР (CaSO4) = 4,08∙10-6 моль2/л2. г) ДР (CaSO4) = 3,0∙10-3 моль2/л2.
83. Хвороба “камінь нирки” - це осідання малорозчинних солей Са (II) різного складу (уратів, фосфатів та оксалатів). Чи призводить до утворення осаду СаС2О4 збільшення масової концентрації до ρ(СаС2О4)= 4,08.10–1 г/л? М(СаС2О4) = 128,08 г/моль, ДР (СаС2О4) = 2,310-9 моль2/л2 .
а) так, осад СаС2О4 утвориться через те, що ДК ДР;
б) ні, осад СаС2О4 не утвориться через те, що ДК ДР;
в) так, осад СаС2О4 утвориться через те, що ДК ДР;
г) ні, осад СаС2О4 не утвориться через те, що ДК ДР.
84. Хвороба “камінь нирки” - це осідання малорозчинних солей Са (II) різного складу (уратів, фосфатів та оксалатів). Чи призводить до утворення осаду СаС2О4 збільшення концентрації оксалат – іонів в плазмі крові до с(С2О42- )= 2,910-4 моль/л? Щодо концентрації катіону кальцію у вільному стані, то вона, становить в плазмі крові с(Са2+)=1,010-3 моль/л, ДР (СаС2О4) = 2,310-9 моль2/л2.
а) так, осад СаС2О4 утвориться через те, що ДК ДР;
б) ні, осад СаС2О4 не утвориться через те, що ДК ДР;
в) так, осад СаС2О4 утвориться через те, що ДК ДР;
г) ні, осад СаС2О4 не утвориться через те, що ДК ДР.
85. Хвороба камінь печінки повязана з утворенням малорозчинної солі Са (II) карбонату. Чи призводить до утворення осаду СаСО3 збільшення концентрації карбонат – іонів в плазмі крові до с(СО32- )= 3,810-4 моль/л? Щодо концентрації катіона кальцію у вільному стані, то вона, становить в плазмі крові с(Са2+)=1,010-3 моль/л, ДР (СаСО3) = 4,810-9 моль2/л2.
а) так, осад СаСО3 утвориться через те, що ДК ДР;
б) ні, осад СаСО3 не утвориться через те, що ДК ДР;
в) так, осад СаСО3 утвориться через те, що ДК ДР;
г) ні, осад СаСО3 не утвориться через те, що ДК ДР.
86. Кісткова тканина починає формуватися в плазмі крові, чи достатньою є концентрація катіона кальцію у вільному стані с(Са2+)=1,010-3 моль/л для утворення осаду СаНРО4? Щодо концентрації гідрогенфосфат – іонів, то вона, становить в плазмі крові с(НРО42- )= 2,910-4 моль/л, ДР (СаНРО4) = 2,710-7 моль2/л2.
а) так, осад СаНРО4 утвориться через те, що ДК ДР;
б) ні, осад СаНРО4 не утвориться через те, що ДК ДР;
в) так, осад СаНРО4 утвориться через те, що ДК ДР;
г) ні, осад СаНРО4 не утвориться через те, що ДК ДР.
87. Кісткова тканина починає формуватися в плазмі крові, чи достатньою є масова концентрація ρ(СаНРО4) = 1,36.10–6 г/л, для утворення в плазмі крові осаду СаНРО4? М(СаНРО4) = 136,05 г/моль, ДР (СаНРО4) = 2,710-7 моль2/л2.
а) так, осад СаНРО4 утвориться через те, що ДК ДР;
б) ні, осад СаНРО4 не утвориться через те, що ДК ДР;
в) так, осад СаНРО4 утвориться через те, що ДК ДР;
г) ні, осад СаНРО4 не утвориться через те, що ДК ДР.
88. Кісткова тканина починає формуватися в плазмі крові, чи достатньою є масова концентрація ρ(СаНРО4) = 4,08.10–1 г/л, для утворення в плазмі крові осаду СаНРО4? М(СаНРО4) = 136,05 г/моль, ДР (СаНРО4) = 2,710-75моль2/ л2.
а) так, осад СаНРО4 утвориться через те, що ДК ДР;
б) ні, осад СаНРО4 не утвориться через те, що ДК ДР;
в) так, осад СаНРО4 утвориться через те, що ДК ДР;
г) ні, осад СаНРО4 не утвориться через те, що ДК ДР.
89. Хвороба “камінь печінки” повязана з утворенням малорозчинної солі Са (II) карбонату. Чи призводить до утворення осаду СаСО3 збільшення масової концентрації до ρ(СаСО3)= 4,08.10–1г/л? М(СаСО3) = 100,08 г/моль, ДР (СаСО3) = 4,810-9 моль2/л2.
а) так, осад СаСО3 утвориться через те, що ДК ДР;
б) ні, осад СаСО3 не утвориться через те, що ДК ДР;
в) так, осад СаСО3 утвориться через те, що ДК ДР;
г) ні, осад СаСО3 не утвориться через те, що ДК ДР.
90. Хвороба “камінь нирки” - це осідання малорозчинних солей Са (II) різного складу (уратів, фосфатів та оксалатів). Чи призводить до утворення осаду СаС2О4 збільшення масової концентрації ρ(СаС2О4)= 1,28.10–10 г/л? М(СаС2О4) = 128,08 г/моль, ДР (СаС2О4) = 2,310-9 моль2/л2?
а) так, осад СаС2О4 утвориться через те, що ДК ДР;
б) ні, осад СаС2О4 не утвориться через те, що ДК ДР;
в) так, осад СаС2О4 утвориться через те, що ДК ДР;
г) ні, осад СаС2О4 не утвориться через те, що ДК ДР.
91. Хвороба “камінь нирки” - це осідання малорозчинних солей Са (II) різного складу (уратів, фосфатів та оксалатів). Чи призводить до утворення осаду СаС2О4 збільшення концентрації оксалат – іонів в плазмі крові до с(С2О42- )= 2,910-4 моль/л? Щодо концентрації катіона кальцію у вільному стані, то вона, становить в плазмі крові с(Са2+)=1,010-3 моль/л, ДР (СаС2О4) = 2,310-9 моль2/ л2.
а) так, осад СаС2О4 утвориться через те, що ДК ДР;
б) ні, осад СаС2О4 не утвориться через те, що ДК ДР;
в) так, осад СаС2О4 утвориться через те, що ДК ДР;
г) ні, осад СаС2О4 не утвориться через те, що ДК ДР.
92. Кісткова тканина починає формуватися в плазмі крові, чи достатньою є масова концентрація ρ(СаНРО4) = 3,0.10–1 г/л, для утворення в плазмі крові осаду СаНРО4? М(СаНРО4) = 136,05 г/моль, ДР (СаНРО4) = 2,710-7 моль2/ л2.
а) так, осад СаНРО4 утвориться через те, що ДК ДР;
б) ні, осад СаНРО4 не утвориться через те, що ДК ДР;
в) так, осад СаНРО4 утвориться через те, що ДК ДР;
г) ні, осад СаНРО4 не утвориться через те, що ДК ДР.
93. Хвороба “камінь нирки” - це осідання малорозчинних солей Са (II) різного складу (уратів, фосфатів та оксалатів). Чи призводить до утворення осаду СаС2О4 збільшення масової концентрації до ρ(СаС2О4)= 4,08.10–1 г/л? М(СаС2О4) = 128,08 г/моль, ДР (СаС2О4) = 2,310-9 моль2/ л2.
а) так, осад СаС2О4 утвориться через те, що ДК ДР;
б) ні, осад СаС2О4 не утвориться через те, що ДК ДР;
в) так, осад СаС2О4 утвориться через те, що ДК ДР;
г) ні, осад СаС2О4 не утвориться через те, що ДК ДР.
94. Хвороба “камінь печінки” повязана з утворенням малорозчинної солі Са (II) карбонату. Чи призводить до утворення осаду СаСО3 збільшення масової концентрації до ρ(СаСО3)= 1,0.10–9 г/л? М(СаСО3) = 100,08 г/моль, ДР (СаСО3) = 4,810-9 моль2/л2.
а) так, осад СаСО3 утвориться через те, що ДК ДР;
б) ні, осад СаСО3 не утвориться через те, що ДК ДР;
в) так, осад СаСО3 утвориться через те, що ДК ДР;
г) ні, осад СаСО3 не утвориться через те, що ДК ДР.
95. Якщо дисоціація комплексного іона відбувається за рівнянням
[Zn(NH3)4]2+
+ 4H2O
![]() [Zn(H2O)4]2+
+
4NH3,
[Zn(H2O)4]2+
+
4NH3,
при додаванні до розчину ZnCl2, рівновага:
а) зміщується вліво;
б) зміщується вправо;
в) не зміщується;
