
- •Тема 11 Теплові ефекти хімічних реакцій в розчинах. Направленність процесів
- •Фізична величина, що не є параметром термодинамічної системи:
- •Тема 12 Кінетика біохімічних реакцій
- •Тема № 13. Хімічна рівновага. Добуток розчинності. Константи стійкості та нестійкості комплексів
- •Г) додавання будь яких речовин не впливає на рівновагу.
- •Тема 14 Визначення окисно-відновного потенціалу
- •Підготовка огляду наукової літератури та створення електронних варіантів схем до тем:
- •Змістовий модуль 3. Термодинамічні та кінетичні закономірностьі перебігу процесів та електрохімічні явища в біологічних системах
НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
ІМЕНІ О.О. БОГОМОЛЬЦЯ
Кафедри загальної хімії
Тестові питання для підготовки
до практичних занять з дисципліни
МЕДИЧНА ХІМІЯ
Модуль 2. Рівноваги в біологічних системах
на межі поділу фаз
Змістовий модуль 3
Термодинамічні та кінетичні закономірності перебігу процесів
та електрохімічні явища в біологічних системах
Киев-2007
За загальною редакцією
Валентини Олександрівни Калібабчук, д.х.н., професора
Володимира Борисовича Ємельянова, к.х.н., доцента
Укладачі:
Лариса Валеріївна Філіппова, к.х.н., доцент
Василій Арсентійович Самарський, к.х.н., доцент
Вера Жданівна Ратушна, асистент
Олена Олегівна Костирна, к.х.н., ст. викладач
Тетяна Анатоліївна Лисенко, асистент
Ігор Геннадійович Телегєев, асистетн
ЗАТВЕРДЖЕНО
на засіданні циклової методичної
комісії з фізико-хімічних
дисциплін НМУ
Протокол № від 2007р.
Тема 11 Теплові ефекти хімічних реакцій в розчинах. Направленність процесів
Який об’єкт можна розглядати як термодинамічну систему:
а) одну молекулу; б) дві молекули;
в) десять молекул; г) один моль речовини?
Термодинамічна система ізольована за умови, якщо:
а) обмінюється з навколишнім середовищем тільки енергією;
б) не обмінюється з навколишнім середовищем ні енергією, ні речовиною;
в) обмінюється з навколишнім середовищем і енергією, і речовиною.
Термодинамічна система закрита за умови, якщо:
а) обмінюється з навколишнім середовищем тільки енергією;
б) не обмінюється з навколишнім середовищем ні енергією, ні речовиною;
в) обмінюється з навколишнім середовищем і енергією, і речовиною.
Термодинамічна система відкрита за умови, якщо:
а) обмінюється з навколишнім середовищем тільки енергією;
б) не обмінюється з навколишнім середовищем ні енергією, ні речовиною;
в) обмінюється з навколишнім середовищем і енергією, і речовиною.
Розчин натрій хлориду містить компонентів:
а) 1; б) 2; в) 3; г) 4.
Водно-спиртовий розчин йоду містить компонентів:
а) 1; б) 2; в) 3; г) 4.
Суміш, що складається з водного розчину NaCl, кусків льоду, кристалів NaCl, містить фаз:
а) 1; б) 2; в) 3; г) 4.
Фізична величина, що не є параметром термодинамічної системи:
а) P; б) V; в) Q; г) T.
Фізична величина, що не є параметром термодинамічної системи:
а) P; б) V; в) А; г) T.
Фізична величина, що не є функцією стану термодинамічної системи:
а) U; б) A; в) H; г) G.
Фізична величина, що не є функцією стану термодинамічної системи:
а) Н; б) U; в) Q; г) F.
Параметр системи абсолютне значення якого можна виміряти:
а) U; б) Т; в) H; г) G.
Параметр системи абсолютне значення якого не можна виміряти:
а) Р; б) Т; в) H; г) V.
Параметр системи абсолютне значення якого не можна виміряти:
а) U; б) Т; в) Р; г) V.
Який параметр системи є екстенсивним:
а) Т; б) Р; в) Н?
Який параметр системи є інтенсивним:
а) Р; б) U; в) V; г) Н; д)F?
Який параметр системи є інтенсивним:
а) Р б) S в) V?
Який параметр системи є екстенсивним :
а) Т б) Р в) S?
Яка величина є функцією стану:
а)тепловий ефект; б)вільна енергія Гіббса; в) робота ?
Який параметр системи є функцією стану:
а) Т; б) Н; в) V?
Який параметр системи є екстенсивним:
а) Т; б) Р; в) F?
При якій температурі ентропія чистого кристалічного тіла дорівнює нулю:
а) 100С; б) 2790С; в) 00С; г) –273,150С?
Який параметр системи є інтенсивним:
а) Т; б) U; в) V; г) S?
Процес зветься ізохорним, якщо протікає при:
а)постійному об’ємі; б)постійному тиску;
в)постійній температурі; г)постійному тиску та температурі.
д)постійному об’ємі та температурі?
Вказати математичний вираз І закону термодинаміки:
а)
![]() б)
ΔG
= ΔH
– TΔS; в)
Q
= ΔU
+ A; г)
ΔF
= ΔU
– TΔS.
б)
ΔG
= ΔH
– TΔS; в)
Q
= ΔU
+ A; г)
ΔF
= ΔU
– TΔS.
Математичний вираз І закону термодинаміки для ізохорних процесів:
а) б) Q = ΔH; в) Q = ΔU?
Який математичний вираз І закону термодинаміки для ізобарних процесів:
а) –ΔG = Аmax; б) Qр = ΔH; в) Qv = ΔU?
Який математичний вираз відповідає ІІ закону термодинаміки:
а) Q = ΔU + А; б) ΔH = ΔU + рΔV; в) ΔS = Q/Т?
Величина ΔS вимірюється в:
а) Дж; б) Дж∙моль; в) Дж/К; г) Дж∙К.
Величина ΔН вимірюється в:
а) Дж; б) Дж∙моль; в) Дж/К; г) Дж∙К.
Вказати термодинамічну умову ендотермічного процесу:
а) ΔH = 0; б) ΔH > 0; в) ΔH < 0.
Вказати термодинамічну умову самодовільного процесу в закритій системі при ΔТ=0, ΔР=0:
а) ΔG = 0; б) ΔG > 0; в) ΔG < 0.
Вказати умову термодинамічної рівноваги в ізольованій системі:
а) ΔS > 0; б) ΔS = 0; в) ΔS < 0.
Вказати термодинамічну умову ізотермічного процесу в ізольованій системі:
а) ΔH = 0; б) ΔH > 0; в) ΔH < 0.
Вказати термодинамічну умову самодовільного процесу в ізольованій системі:
а) ΔS > 0; б) ΔS = 0; в) ΔS < 0.
Вказати умову термодинамічної рівноваги в закритій системі при ΔV=0, ΔТ=0:
а) ΔF = 0; б) ΔF > 0; в) ΔF < 0.
Як змінюється ентальпія за умов ендотермічного процесу:
а) ΔH = 0; б) ΔH > 0; в) ΔH < 0.
Вказати термодинамічну умову несамодовільного процесу закритої системи при ΔТ=0, ΔР=0:
а) ΔG = 0; б) ΔG > 0; в) ΔG < 0.
Як змінюється ентропія за умов термодинамічної рівноваги ізольованої системи:
а) ΔS > 0; б) ΔS = 0; в) ΔS < 0.
Як зміниться ентальпія за умов екзотермічного процесу:
а) ΔH = 0; б) ΔH < 0; в) ΔH > 0.
Вказати термодинамічну умову не самодовільного процесу ізольованої системи:
а) ΔS = 0; б) ΔS > 0; в) ΔS < 0.
Як зміниться енергія Гіббса за умов термодинамічної рівноваги закритої системи:
а) ΔG = 0; б) ΔG > 0; в) ΔG < 0.
Як змінюється ентальпія за умов ендотермічного процесу :
а) ΔH = 0; б) ΔH > 0; в) ΔH < 0.
Вказати термодинамічну умову самодовільного ізобарно-ізотермічного процесу закритої системи:
а) ΔG = 0; б) ΔF = 0; в) ΔG > 0; г) ΔF < 0; д) ΔG < 0.
Величина ΔG вимірюється в:
а) Дж; б) Дж∙моль; в) Дж/К; г) Дж∙К.
Як позначається зв’язана енергія системи:
а) U; б) H; в) TS; г) G?
Вказати термодинамічну умову екзотермічного процесу:
а) ΔH = 0; б) ΔH > 0; в) ΔH < 0.
Стандартна теплота утворення (
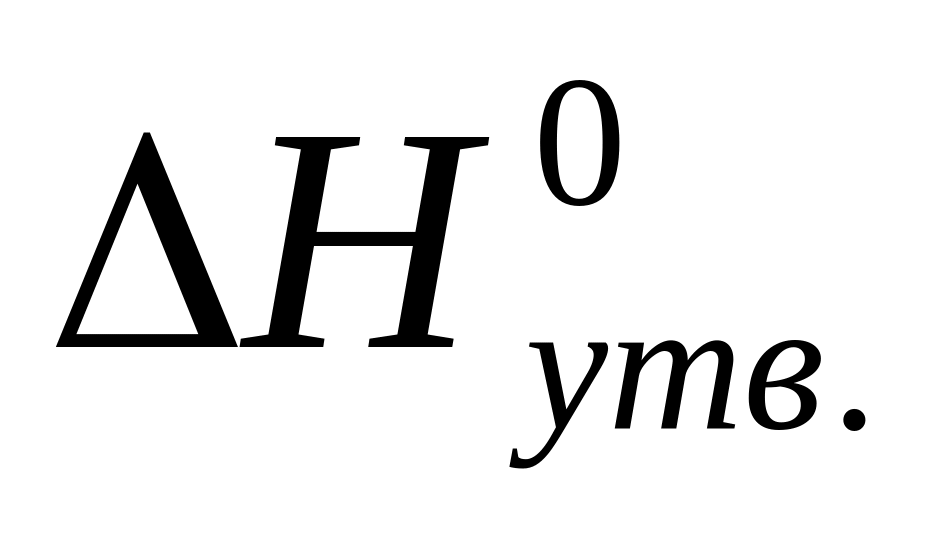 )
вимірюється в :
)
вимірюється в :
а) Дж/моль; б) Дж∙моль; в) Дж/К; г) Дж∙К.
Вказати умову термодинамічної рівноваги закритої системи при ΔV=0, ΔТ=0:
а) ΔF = 0; б) ΔG = 0; в) ΔF > 0; г) ΔH = 0; д) ΔF < 0.
Процес є ізохорно-ізотермічний, якщо:
а) ΔP = 0, ΔV = 0; б) ΔV = 0, ΔT = 0; в) ΔT = 0, ΔP = 0.
Як зміниться енергія Гіббса за умов самодовільного процесу в закритій системі:
а) ΔG = 0; б) ΔG > 0; в) ΔG <0?
Вказати умову термодинамічної рівноваги в ізольованій системі:
а) ΔS > 0; б) ΔG > 0; в) ΔS = 0; г) ΔS < 0; д) ΔF < 0.
Калорійність харчових продуктів вимірюється:
а) Дж; б) Дж∙моль; в) кДж/г; г) Дж∙г д) Дж/К.
Вказати умову термодинамічної рівноваги закритої системи при ΔТ=0, ΔР=0:
а) ΔG = 0; б) ΔF = 0; в) ΔG > 0:
г)ΔF > 0; д) ΔG < 0.
Яким рівнянням описується зміна ентропії(ΔS) закритої системи:
а) ΔF = ΔU – TΔS; б)ΔG = ΔH – TΔS;
в) ΔH = ΔU + А; г) ΔS =Q/Т?
Яким рівнянням описується зміна вільної енергії ізохорно-ізотермічного процесу:
а) ΔF = ΔU – TΔS; б) ΔG = ΔH – TΔS;
в) ΔH = ΔU + рΔV г) Q = ΔU + А?
Яким рівнянням описується зміна вільної енергії ізобарно-ізотермічного процесу:
а) Q = ΔU+А; б) ΔG = ΔH – TΔS;
в) ΔH = ΔU + рΔV; г) ΔF = ΔU – TΔS ?
Яким рівнянням описується зміна ентальпії (ΔH) системи:
а) Q = ΔU + А; б) ΔG = ΔH – TΔS;
в) ΔH = ΔU + рΔV; г) ΔF = ΔU – TΔS?
Яким рівнянням описується зміна термодинамічного потенціалу ізохорно-ізотермічного процесу:
а) ΔF = ΔU – TΔS; б) ΔG = ΔH – TΔS;
в) ΔH = ΔU + рΔV; г) Q = ΔU + А?
Яким рівнянням описується зміна ентропії (ΔS) закритої системи:
а) ΔF = ΔU – TΔS; б) ΔG = ΔH – TΔS;
в) Q = ΔU + А; г) ΔS = Q/Т?
Вказати екзергонічний процес в організмі людини:
а) рух крові в судинах; б) активний транспорт;
в) пасивний транспорт; г) синтез білків із амінокислот?
Як пов’язана зміна ентальпії (ΔH) системи з ΔU системи:
а) ΔG = ΔH – TΔS; б) ΔH = ΔU + рΔV; в) ΔF = ΔU – TΔS ?
Яким рівнянням описується зміна енергії Гельмгольца:
а) ΔF = ΔU – TΔS; б) ΔG = ΔH – TΔS;
в) ΔH = ΔU + рΔV; г) Q= ΔU + А?
Яким рівнянням описується зміна ентальпії (ΔH) системи:
а) Q = ΔU + А; б) ΔG = ΔH – TΔS;
в) ΔH = ΔU + рΔV; г) ΔF = ΔU – TΔS ?
Яким рівнянням описується зміна вільної енергії Гіббса:
а) ΔF = ΔU – TΔS; б) ΔG = ΔH – TΔS;
в) ΔH = ΔU + рΔV г) Q = ΔU+А ?
Вказати ендергонічний процес в організмі людини:
а) гідроліз білків; б) гідроліз полісахаридів;
в) синтез білків; г) окислення вуглеводів?
Вказати катаболічний процес в організмі людини:
а) гідроліз білків; б) синтез нуклеїнових кислот;
в) синтез білків; г) синтез білків?
Вказати анаболічний процес в організмі людини:
а) гідроліз полісахаридів; б) окислення глюкози;
в) синтез полісахаридів; г) окислення карбонових кислот?
Вказати самодовільний процес в організмі людини:
а) рух крові в судинах; б) активний транспорт іонів;
в) пасивний транспорт іонів; г) синтез білків?
Який математичний вираз відповідає ІІ закону термодинаміки:
а) ΔS = Q/Т; б) Qр=ΔH; в) ΔQv= ΔU; г) Q = ΔU + A?
Яка із систем стає гетерогенною внаслідок реакції, що відбувається в розчині:
а) AgNO3 + HBr→; б) HCl + K2O →; в) NaOH + H2SO4 → ?
Яка із систем залишається гомогенною після взаємодії в розчині:
а) NaCl(р)↓ + AgNO3 (р) → ; б) BaI2(р) + K2SO4(р) → ; в) H2SO4(р) + KOH(р) →?
В результаті якої із реакцій утвориться гетерогенна система:
а)
CuSO4(р)
+ K3PO4(р)
→
; б) Ca(OH)2(р)
+ HNO3(р)
→;
в) NаОН![]() +
НCl
→
?
+
НCl
→
?
В результаті якої із реакцій утвориться гетерогенна система:
а) AgNO3(р) + KBr(р) → ; б) CuSO4(р) + H2SO4(р) → ; в) NaOH(р) + HNO3(р) →?
В якому із розчинів утвориться гетерогенна система, якщо відбуваються такі реакції:
а) HCl(р) + NaOH (р) →; б) Cа(OH)2(р) + Na2CO3(р) →; в)KOH(р)+ SO3(г)→?
Яка із систем не змінює фазовий стан в результаті взаємодії:
а) AgCl↓ + 2NH3(г) → ; б) HCl(г)+NH3 (г) → ; в) NaOH(р) + H2S(р) → ?
Яка із систем стане гетерогенною в результаті взаємодії:
а) AgCl↓ + 2NH3(г) → ; б) BaSO4↓ + H2SO4→ ; в) К2SO4(р)+Ba(OH)2(р) →?
Яка з реакцій відбувається з утворенням гетерогенної системи:
а) BaCl2(р) + Na2SO4(р) → ; б) NaОН3(р) + HCl(р) → ; в) H3PO4р) + NaOH(р) →?
Яка із систем залишиться гомогенною в результаті взаємодії в розчині:
а) NaOH + H2SO4→ ; б) AgNO3 + HCl → ; в) BaCl2 + K2SO4 → ?
Яка із систем залишається гомогенною в результаті взаємодії:
а) H2SO4(р) + КOН(р) →; б) ) КCl(р) + AgNO3р → ; в) FeO(т) + H3PO4(р) → ?
Яка реакція відбувається зі збільшенням ентропії:
а) N2(г) + 3H2(г) = 2NH3(г); б) H2(г) + Cl2(г) = 2HCl(г); в)CaCO3(т)→CaO(т)+CO2↑?
Яка реакція відбувається зі зменшенням ентропії:
а)
N2(г)
+
3H2(г)
=
2NH3(г); б)
H2![]() + Cl2
= 2HCl
;
+ Cl2
= 2HCl
;
в)CaCO3![]() →CaO
+CO2
↑?
→CaO
+CO2
↑?
Яка реакція проходить без зміни ентропії:
а) N2(г) + 3H2(г) = 2NH3(г); б) H2(г) + Cl2(г) = 2HCl(г); в)CaCO3(т)→CaO(т)+CO2↑?
Як змінюється ентропія системи: 2СО (г)
 С
(т)+СО2
(г)
С
(т)+СО2
(г)
а) зменшиться; б) збільшиться; в) залишиться без змін ?
Визначити зміну ентропії в такій реакції COCl(г) = CO(г) + Cl2 :
а) ΔS > 0; б) ΔS = 0; в) ΔS < 0.
Як зміниться ентропія системи Н2 + І2
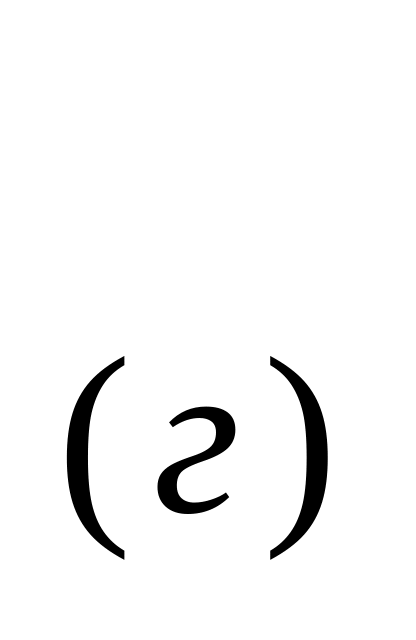 →
2НІ(г):
→
2НІ(г):
а) збільшиться; б) зменшиться; в) не зміниться ?
Як зміниться ентропія системи Н2 + Сl2 →2HCl(г):
а)збільшиться; б) зменшиться; в) не зміниться ?
Яка реакція проходить зі збільшенням ентропії:
а) N2(г) + 3H2(г) = 2NH3(г); б) H2(г) + Cl2(г) =2HC(г); в)ВaCO3(т)→ВaO(т)+CO2 (г)↑?
Яка реакція відбувається зі зменшенням ентропії:
а) NH3 + HCl → NH4Cl ; б) H2 +Cl2 =2HCl ;
в) CaCO3(т)→CaO(т)+CO2 ?
Яка реакція відбувається без зміни ентропії:
а) N2 +3H2 =2NH3 ; б) H2 +F2 =2HF ;
в)
MgCO3![]() →MgO
+CO2
↑?
→MgO
+CO2
↑?
Як зміниться ентропія системи: 2Cu(NO3)2(т) → CuO(т) + 4NO2 + O2
а) зменшиться; б) збільшиться; в) не зміниться?
Як змінитьсO ентропія системи 2SO2 + O2 = 2SO3 :
а) зменшиться; б) збільшиться; в) не зміниться?
Як зміниться ентропія системи 2S(т) + 3О2 → 2SO3 :
а) зменшиться; б) збільшиться; в) не зміниться ?
Як зміниться ентропія системи Н2 + Br2 →HBr :
а) зменшиться; б) збільшиться; в) не зміниться ?
Як зміниться ентропія в результаті реакції 2Mn(NO3)2 → 2MnO(т)↓ + 4NO2 + O2 :
а) зменшиться; б) збільшиться; в) не зміниться ?
Чи можливий самодовільний процес при ΔH>0 та TΔS>0:
а)
можливий при
![]() б)
можливий при
б)
можливий при
![]()
в) можливий за будь - яких умов ?
Чи можливий самодовільний процес, якщо ΔH > 0, ТΔS < 0:
а) самодовільний б) несамодовільний; в) рівноважний ?
Чи можливий самодовільний процес, якщо ΔU > 0, TΔS < 0:
а) можливий; б) неможливий; в) процес рівноважний ?
Якщо ΔH < 0 та TΔS > 0, то процес:
а) самодовільний; б) не самодовільний; в) рівноважний.
Якщо ΔH > 0, а TΔS < 0, то термодинамічний процес:
а) самодовільний; б) не самодовільний; в) рівноважний.
Розрахувати можливість самодовільного процесу при Т0=298 К, якщо ΔH0 =300 кДж, ΔS0 = 26 Дж/К.
При якій температурі (Т,К) можливим є самодовільний процес, що характеризується такими змінами: ΔH0=60,0 кДж, ΔS0=360 Дж/К, ΔG0=48 кДж?
Визначити, чи є самодовільним процес окиснення глюкози при Т0=298К, якщо ΔH0реакції = –2803 кДж, ΔS0реакції = 260 Дж/К?
Як змінюється ентропія реакції повного окиснення глюкози при Т0=298К, якщо ΔG0реакції = –2876 кДж, а ΔH0реакції= –2803 кДж?
При якій температурі відбувається самодовільний процес окиснення глюкози, якщо ΔG= –2876 кДж, ΔH = –2803 кДж, а ΔS = 260 Дж/К?
Чому дорівнює ΔH0 реакції повного окиснення глюкози при Т=298К, якщо відомо ΔG0реакції = –2876 кДж, а ΔS0 = 260 Дж/К?
Розрахувати калорійність 200г молока, яке вміщує 3,2% жирів, 5,5% вуглеводів, та 26,6% білків, якщо ΔНзгор(жирів) = –39,9 кДж/г, а ΔНзгор.(білків) = –17 кДж/г; ΔН0згор(вуглеводів) = –17 кДж/г.
Розрахувати калорійність 100г бісквіту, у якому ω(вуглеводів)= 23%, ω(жирів)=15% та 36% білків, якщо калорійність їх відповідно становить 17 кДж/г, 39,9 кДж/г та 17 кДж/г.
Розрахувати калорійність 100г каші у якій ω(вуглеводів)=20%, ω(білків)=15% та ω(жирів)=7%, якщо їх калорійність відповідно дорівнює 17 кДж/г, 17 кДж/г та 39,9 кДж/г.
Розрахувати калорійність 1 яйця масою 70г в якому ω( жирів)12%,ω(білків)69%, а ω(вуглеводів) 3%, якщо калорійність їх відповідно дорівнює 39,9 кДж/г, 17 кДж/г, 17 кДж/г.
В 1кг тріски міститься 116г білків та 3г жирів. Розрахувати калорійність 200г тріски, якщо калорійність жирів 39,9 кДж/г, а білків 17 кДж/г.
Добова потреба в білках, жирах та вуглеводах для людей розумової праці складає, відповідно, 445г, 106г, 413г. Яка калорійність цього набору, якщо калорійність, відповідно, складає 17кДж/г, 39,9 кДж/г, 17 кДж/г.
Розрахувати масу жиру, що є еквівалентною до втрати енергії спортсменом через потовідділення 360 г води, якщо ΔH0(випаровування) = 41кДж/моль, а ΔH0згор.(жиру) = = –39,9 кДж/г.
Прачка втратила через потовідділення 410 кДж енергії. Яка маса салату, що складається з білків та вуглеводів, калорійність яких дорівнює 17 кДж/г, поповнить цю енергію?
Калорійність жирів дорівнює 39,9 кДж/г. Яка маса жиру є еквівалентною до втрати енергії через потовідділення 900 г Н2О, якщо ΔH0 (випаровування) дорівнює 41 кДж/моль.
Як зміниться ентропія в процесі повного окиснення 1 моль глюкози, якщо відомі стандартні значення відповідних сполук (в Дж/мольК): S0(C6H12O6)=212, S0(O2)=205, S0(CO2)=214, S0(H2Op)=70?
