
- •Адсорбция
- •Дисперсные системы
- •-Это гомогенные многокомпонентные системы, состав которых может меняться в некоторых пределах без скачкообразного изменения свойств.
- •Жидкие растворы
- •1.Молярная концентрация, с :
- •4.Массовая доля вещества, :
- •Термодинамика процессов растворения.
- •Растворимость.
- •Общие свойства растворов
- •Законы идеальных растворов
- •Температура кипения раствора выше температуры кипения растворителя (т.К находится в зависимости от рн.П)
- •Температура замерзания раствора ниже температур замерзания чистого растворителя (т.К находится в зависимости от рн.П).
- •Эбуллиоскопические и криоскопические постоянные некоторых растворителей
Лекция10.

это поглощение одного вещества поверхностью другого вещества.
Адсорбция – разновидность сорбции (процесса поглощения одного вещества другим).
Если вещество поглощает другое вещество объемом, то происходит абсорбция.
Адсорбция осуществляется вследствие наличия у поверхностных частиц избыточной поверхностной свободной энергии.
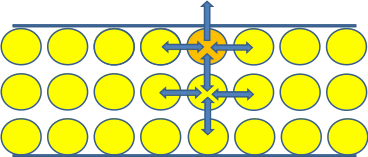
Происходит повышение концентрации поглощаемого вещества на границе раздела фаз – адсорбция.
Адсорбент - вещество, которое поглощает, адсорбирует.
Адсорбат–вещество, которое поглощается, адсорбируется.
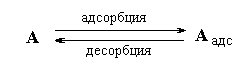
Десорбция - процесс, обратный адсорбции.
Количественной характеристикой адсорбента является его удельная площадь поверхности S0.
S0 = S/ V, м2см-3
S0 = S/ m, м2г-1
S – поверхность адсорбента, м2; V – объём, см3; m – масса, г.
Чем больше S0, тем лучше адсорбционная способность адсорбента.
Большой S0 обладают активированные угли, алюмосиликаты, силикагель (аморфный кремнезем) – вещества с развитой поверхностью.
S0 активированного угля достигает 400 – 900 м2 г -1
Количественной мерой адсорбции адсорбата является величина адсорбции Г - избыток адсорбированного вещества в поверхностном слое по сравнению с объемом.
[Г]=[моль/м2адсорбента]; [моль/см2адсорбента]; [моль/г адсорбента]
Так, при адсорбции газа на поверхности твердого тела:
Г = n/S =( С0 - С ) ∙V∕ S, моль/м2.,
где С0-концентрация газа в объеме до адсорбции(моль/м3), С-концентрация газа в объеме после адсорбции(моль/м3),
V- объем сосуда ( м3), S - поверхность твердого тела ( м2).
Адсорбция



Физическая адсорбция происходит, когда
при взаимодействии адсорбата и адсорбента возникают вандерваальсовы взаимодействия; характерен невысокий тепловой эффект адсорбции(DНадс = –(3-15) кДж/моль);
DНадс - тепловой эффект адсорбции- это количество теплоты, в основном , выделяемое при поглощении 1 моля адсорбата поверхностью адсорбента.
Физическая адсорбция - обратимый процесс.
Cl2 ↔ Cl2 адс.на С. С ↑ Т десорбция возрастает.
Химическая адсорбция (хемосорбция) происходит, когда
при взаимодействии адсорбата и адсорбента возникают химические связи; характерен высокий тепловой эффект (DНадс = DrН хим реак).
Химическая адсорбция - необратимый процесс.
CO2 + Ca(OH)2(Т)↔ CaCO3(Т) + H2O
Термодинамика адсорбции.
Адсорбция протекает самопроизвольно Þ DGадс < 0.
При взаимодействии адсорбата с адсорбентом теплота выделяется Þ DНадс < 0.
В процессе адсорбции происходит упорядочение частиц Þ DSадс < 0.
При
некоторой температуре Тр
наступает равновесие:
υадc
= υдес
 DGадс
=
0
и
Тр
=
DНадс/DSадс.
DGадс
=
0
и
Тр
=
DНадс/DSадс.
Адсорбционное равновесие подвижно и подчиняется принципу Ле Шателье. Так: с↑ Т адсорбция ↓, десорбция ↑.
Изотерма адсорбции - это
зависимость величины адсорбции Г от равновесной концентрации C или равновесного парциального давления р адсорбата при постоянной температуре: Г = f (c), Г = f (p)
Наиболее часто используется уравнение изотермы адсорбции Лэнгмюра.
Уравнение Лэнгмюра предполагает, что поверхность адсорбента однородна и при максимальном заполнении образуется мономолекулярный слой.
Q = Г/Г¥ - степень заполнения поверхности адсорбатом.
1- Q - свободная поверхность
Г¥ – максимальная адсорбция при образовании монослоя;
υадc = kадc (1- Q)рА – при адсорбции газа А на свободной поверхности
υадс = kадс (1- Q)сА – при адсорбции адсорбата А из раствора
υдес = kдесQ - пропорциональна занятой поверхности
При равновесии υадс = υдес Þ kадс(1- Q) рА = kдесQ
kадс(1- Q)сА = kдесQ
Ка = kадс/ kдес =Q/(1- Q) рА
Ка = kадс/ kдес =Q/(1- Q) сА или
Q=Kа∙pА /(1+Kа∙pА)
Q=Kа∙cА /(1+Kа∙cА)
Заменяя Q = Г/Г¥ получаем уравнение адсорбции Лэнгмюра :
Г=Г∞∙ Kа∙ pА /(1+Kа∙pА)
Г=Г∞∙ Kа∙ сА /(1+Kа∙сА)
сА – равновесная концентрация адсорбата;
рА – равновесное давление адсорбата;
Ка – константа адсорбционного равновесия.
При малых концентрациях или парциальных давлениях адсорбция пропорциональна концентрации или парциальному давлению.
При высоких концентрациях или парциальных давлениях, достигается максимальное заполнение Г = Г¥.

Характеристики адсорбента Г¥ и Ка находят графически по экспериментальным данным.
Уравнение Лэнгмюра в координатах 1/Г и 1/с- уравнение прямой.
![]()
y=a+bx (1/ Ka Г∞ = tg a)
Уравнение адсорбции Ленгмюра хорошо описывает процессы адсорбции из газовой фазы.
Адсорбция из растворов осложняется тем, что адсорбируется не только растворенное вещество, но и сам растворитель и адсорбция зависит от соотношения сил взаимодействий частиц в растворе. Для описания процесса наиболее часто используют уравнение Лэнгмюра и другие уравнения, например, уравнение Фрейндлиха: a = K∙cn ,
где а - количество адсорбированного вещества, с - равновесная концентрация, К и n - эмпирические константы для данного адсорбента и данной Т.
