
- •1. История, современное состояние и перспективы развития газоснабжения
- •2.Современноесостояние и перспективы развития газоснабжения Беларуси
- •3. Закон Бойля-Мариотта
- •4. Уравнение состояния идеального газа
- •5. Закон Авогадро
- •6. Закон Грейама
- •7. Закон Дальтона
- •8. Закон Рауля
- •9 .Закон Генри
- •10. Критические параметры газов
- •11. Физико-химические свойства реальных газов
- •12. Состав и свойства горючих газов
- •13. Давление
- •14. Температура
- •14*. Объем
- •15. Масса, плотность и удельный объём газа.
- •16. Вязкость
- •17. Влажность газов
- •18. Диффузия газов
- •19. Теплоемкость газов
- •20. Теплопроводность газов
- •21. Теплота сгорания газов
- •22. Взаимозаменяемость газов. Число Воббе
- •23. Горение газов
- •24. Температура горения газов
- •25. Температура воспламенения газов
- •26. Пределы воспламеняемости
- •27. Скорость распространения пламени
- •28. Зависимость нормальной скорости распространения пламени от температурных условий
- •29. Зависимость критического диаметра (диаметра гашения) от температуры подогрева газовоздушной смеси
- •30.Природные газы
- •31.Попутные нефтяные газы
- •32.Сжиженные углеводородные газы
- •33. Пиролизные газы.
- •34. Газы безостаточной газификации
- •35. Топливо будущего – водород
- •36. Сероводород
- •37. Влага
- •38. Нафталин, пыль и смола
- •39. Балластные примеси
- •40. Влияние газов и продуктов их сгорания на организм человека
- •41. Окись углерода
- •42. Сероводород и сернистый газ
- •43. Сероуглерод
- •44. Аммиак
- •45. Цианистый водород
- •46. Предельные углеводороды
- •47. Азот и водород
- •48. Углекислота (диоксид углерода)
- •49. Окислы азота (no и no2)
- •50. Очистка газа от пыли и смолы
- •51. Осушка и охлаждение газовой смеси
- •52. Методы очистки газов от аммиака
- •53. Очистка газов от сероводорода, нафталина и цианистых соединений
- •54. Одоризация газов
- •55. Компрессорные станции (кс). Назн-е и размещение кс
- •56. Составные элементы кс
- •57. Газораспределительные станции (грс)
- •59. Прокладка газопроводов
- •61. Оборудование и сооружения на газопроводе
- •62. Стальные трубы
- •63. Полиэтиленовые трубы и их детали
- •64. Соединительные части и детали стальных труб
- •65. Уплотнительные материалы
- •66. Запорная и регулирующая арматура
- •67. Задвижки
- •68. Краны
- •69. Вентили
- •70. Гидравлические затворы
- •71 Спец. Устройства и устройства для предохранения газопроводов от повреждений.
- •72 Назначение и класификация грп (гру)
- •73 Размещение грп :
- •74. Размещение шкафных грп
- •75. Размещение гру:
- •76. Оборудование грп и гру.
- •77.Компоновка отдельно стоящих грп.
- •78. Компоновка шкафных грп.
- •82.Предохранительно-запорный клапан.
- •83. Предохранительно-сбросной клапан.
- •84.Газовые фильтры.
10. Критические параметры газов
При изменении определенных параметров газов все они могут быть превращены в жидкость, а из жидкости в пар. Этими определенными параметрами является давление и температура. Причем для каждого газа эти параметры свои.Для любого газа существует строго определенная температура, превышение которой не может привести к переводу газа в жидкость при любом увеличении давления.Такую температуру наз. критической. Давление же, при котором происходит переход газа в жидкость при этой температуре, называют критическим.
Критические параметры газов исследовал во второй половине 19-го века Д.И. Менделеев. Он же и предложил впервые понятие критической температуры. При этой температуре по представлениям Д.И. Менделеева происходит исчезновение сил сцепления между молекулами жидкости, и она вне зависимости от давления, превращается в газ.
Описанные выше определения присущи главным образом для отдельных химически чистых веществ.
Если же мы имеем дело с техническими газами, которые представляют собой смеси, то значение критической температуры изменяется. В таких случаях критическая температура выше критической температуры самого низкокипящего компонента, входящего в газовую смесь и ниже критической температуры самых высококипящих компонентов.
Для газовых смесей критические параметры могут быть подсчитаны по закону аддитивности:
![]() ,
,
где Ткр
,
![]() –
критические температуры компонентов,
входящих в газовую смесь;
–
критические температуры компонентов,
входящих в газовую смесь;
y1, y2, yn – объемные или весовые концентрации компонентов, входящих в газовую смесь.
Аналогично подсчитываются все другие критические параметры газов.
Критические параметры, определенные по приведенному выше закону называют псевдокритическими или среднекритическими.
11. Физико-химические свойства реальных газов
Реальные газы отклоняются от законов, действующих для идеальных газов. Чем выше температура газа и чем ниже его давление, тем происходит меньшее отклонение от законов идеальных газов. Это объясняется тем, что у реальных газов в обычных условиях расстояния между молекулами меньше. Кроме того, в этих газах действуют межмолекулярные силы. Однако для таких газов как водород, азот, кислород, при условиях, приближающихся к нормальным (давление 760 мм.рт.ст. и температура 0 0C) отклонение от законов для идеальных газов является минимальным.
Отклонение реальных газов от законов для идеальных газов учитывает уравнение Ван-дер-Ваальса. Это уравнение учитывает изменения, по сравнению с уравнением закона газового состояния для идеальных газов, в объеме, занимаемом молекулами газа, а также учитывает силы межмолекулярного сцепления. Уравнение Ван-дер-Ваальса в общем виде:
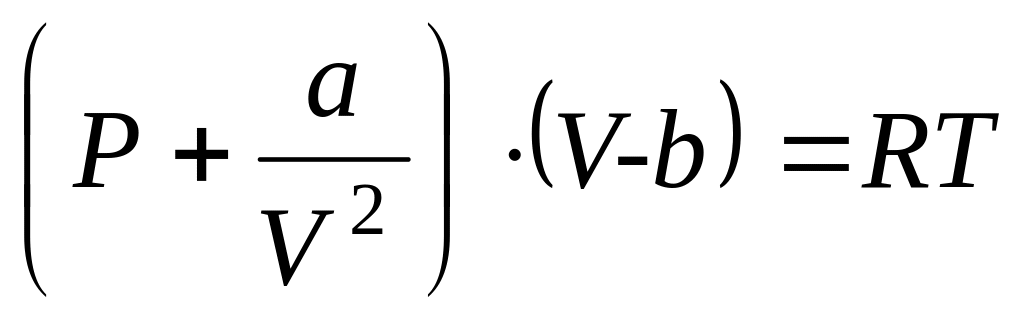 ,
,
где
![]() - внутреннее давление молекул;
- внутреннее давление молекул;
b – поправка на объем.
Значения постоянных a и b в уравнении Ван-дер-Ваальса могут быть рассчитаны по формулам или взяты из специальных таблиц.
В практических расчетах использование уравнения Ван-дер-Ваальса громоздко и поэтому в уравнение состояния идеального газа ввели эмпирический безразмерный коэффициент z. Тогда уравнение приняло следующий вид:
PV = zRT
z
=![]() -коэффициент
сжимаемости газов.
-коэффициент
сжимаемости газов.
Значение этой величины можно определить также и по специальным графикам.
В практических расчетах газовых сетей низкого и среднего давления можно считать z = 1. При расчете сетей высокого давления предположение, что z = 1 также не приводит к значительным погрешностям. При расчете же магистральных газопроводов введение корректирующего коэффициента z является необходимым условием.
