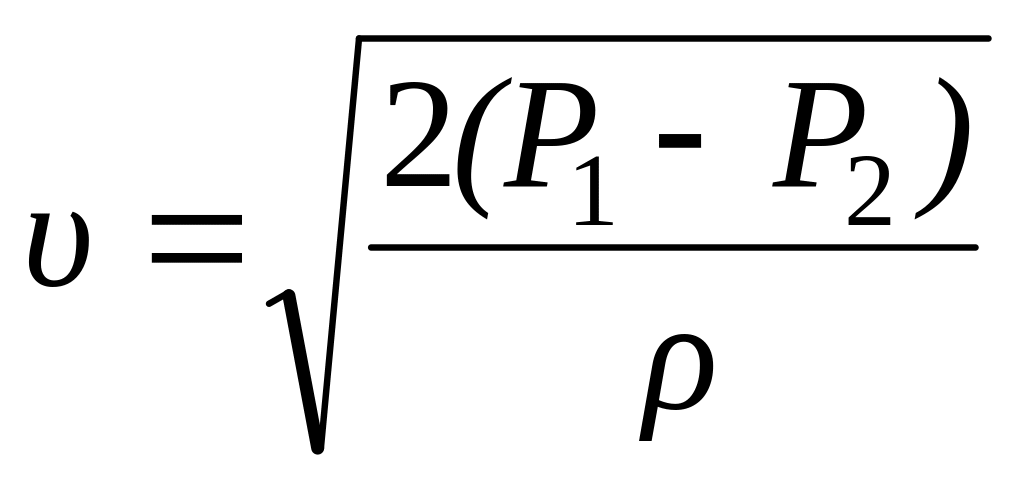- •1. История, современное состояние и перспективы развития газоснабжения
- •2.Современноесостояние и перспективы развития газоснабжения Беларуси
- •3. Закон Бойля-Мариотта
- •4. Уравнение состояния идеального газа
- •5. Закон Авогадро
- •6. Закон Грейама
- •7. Закон Дальтона
- •8. Закон Рауля
- •9 .Закон Генри
- •10. Критические параметры газов
- •11. Физико-химические свойства реальных газов
- •12. Состав и свойства горючих газов
- •13. Давление
- •14. Температура
- •14*. Объем
- •15. Масса, плотность и удельный объём газа.
- •16. Вязкость
- •17. Влажность газов
- •18. Диффузия газов
- •19. Теплоемкость газов
- •20. Теплопроводность газов
- •21. Теплота сгорания газов
- •22. Взаимозаменяемость газов. Число Воббе
- •23. Горение газов
- •24. Температура горения газов
- •25. Температура воспламенения газов
- •26. Пределы воспламеняемости
- •27. Скорость распространения пламени
- •28. Зависимость нормальной скорости распространения пламени от температурных условий
- •29. Зависимость критического диаметра (диаметра гашения) от температуры подогрева газовоздушной смеси
- •30.Природные газы
- •31.Попутные нефтяные газы
- •32.Сжиженные углеводородные газы
- •33. Пиролизные газы.
- •34. Газы безостаточной газификации
- •35. Топливо будущего – водород
- •36. Сероводород
- •37. Влага
- •38. Нафталин, пыль и смола
- •39. Балластные примеси
- •40. Влияние газов и продуктов их сгорания на организм человека
- •41. Окись углерода
- •42. Сероводород и сернистый газ
- •43. Сероуглерод
- •44. Аммиак
- •45. Цианистый водород
- •46. Предельные углеводороды
- •47. Азот и водород
- •48. Углекислота (диоксид углерода)
- •49. Окислы азота (no и no2)
- •50. Очистка газа от пыли и смолы
- •51. Осушка и охлаждение газовой смеси
- •52. Методы очистки газов от аммиака
- •53. Очистка газов от сероводорода, нафталина и цианистых соединений
- •54. Одоризация газов
- •55. Компрессорные станции (кс). Назн-е и размещение кс
- •56. Составные элементы кс
- •57. Газораспределительные станции (грс)
- •59. Прокладка газопроводов
- •61. Оборудование и сооружения на газопроводе
- •62. Стальные трубы
- •63. Полиэтиленовые трубы и их детали
- •64. Соединительные части и детали стальных труб
- •65. Уплотнительные материалы
- •66. Запорная и регулирующая арматура
- •67. Задвижки
- •68. Краны
- •69. Вентили
- •70. Гидравлические затворы
- •71 Спец. Устройства и устройства для предохранения газопроводов от повреждений.
- •72 Назначение и класификация грп (гру)
- •73 Размещение грп :
- •74. Размещение шкафных грп
- •75. Размещение гру:
- •76. Оборудование грп и гру.
- •77.Компоновка отдельно стоящих грп.
- •78. Компоновка шкафных грп.
- •82.Предохранительно-запорный клапан.
- •83. Предохранительно-сбросной клапан.
- •84.Газовые фильтры.
3. Закон Бойля-Мариотта
В 1662 году английский ученый Роберт Бойль (1627-1619) и несколько позднее (в 1676 г.) французский физик Эдм Мариотт (1620-1684) пришли к выводу, что при постоянной температуре объем газа обратно пропорционален давлению, т.е. при постоянной температуре произведение давления газа на его объем есть величина постоянная.
P0V0 = P1V1 = PV = const,
где V0 – объем газа с температурой T0, абсолютном давлении P0;
V1 – объем газа с температурой T1, абсолютном давлении P1 и т.д.
Известно, что плотность газа может быть выражена следующим отношением:
![]()
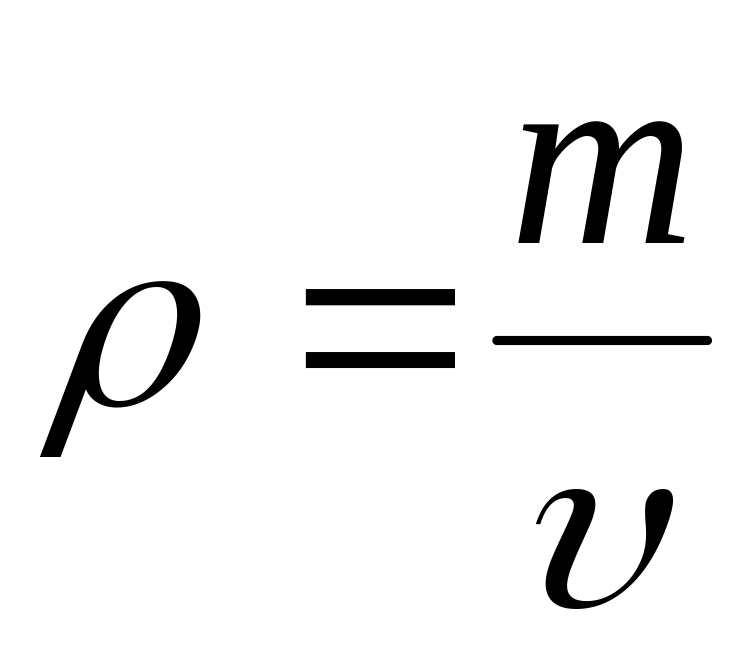 ,
,
где
-
плотность газа; m
– масса газа;
![]() -
удельный объем газа.
-
удельный объем газа.
Вследствие того, что удельные объемы газа равны величине обратной плотности , то:
![]() =
=
![]()
и
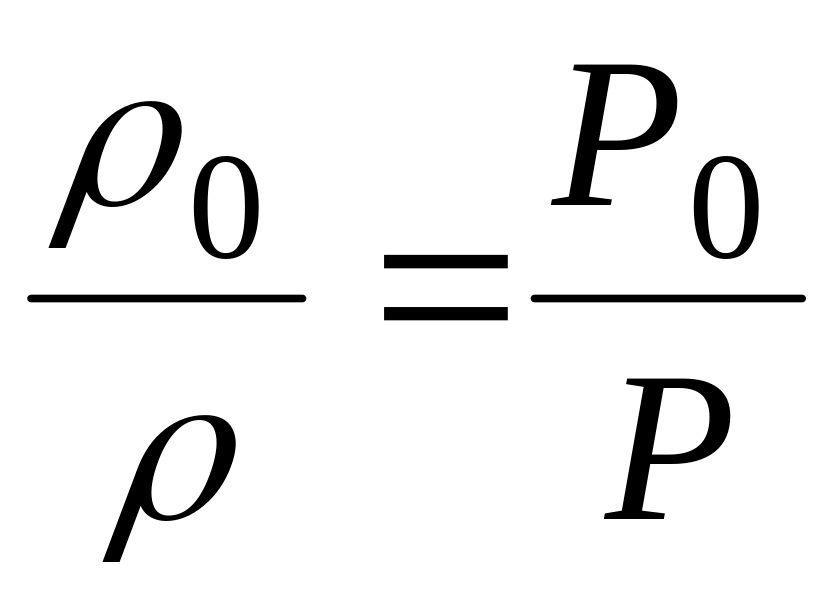
Исходя из последнего соотношения следует, что если выразить концентрацию газа как весовое его количество в единице объема, то давление газа прямо пропорционально его концентрации при постоянной температуре.
4. Уравнение состояния идеального газа
Объединив законы Бойля – Мариотта и Гей-Люссака можно получить одно общее уравнение для идеального газа, которое объединяет все три фактора: давление, температуру и объем.
Первым к такому решению пришел в 1834 году французский ученый Бенуа Поль Эмиль Клапейрон (1799-1864). Для более общего случая уравнение состояния идеальных газов было получено Д.И.Мендлеевым в 1874 г. Вследствие чего это уравнение называется уравнением Клапейрона - Менделеева.
После объединения законов Бойля - Мариотта и Гей-Люссака можем получить:
V=V1![]()
![]() (2.5) и
(2.5) и
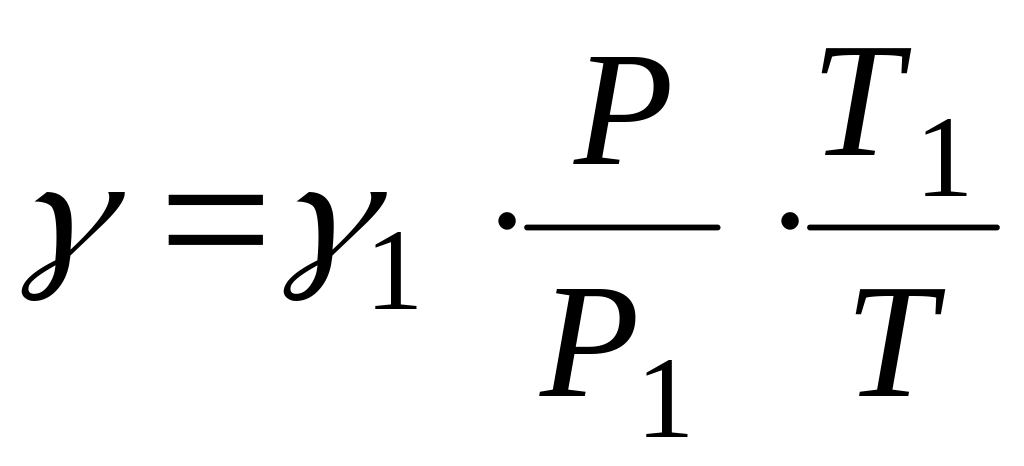
Из
уравнения (2.5) имеем: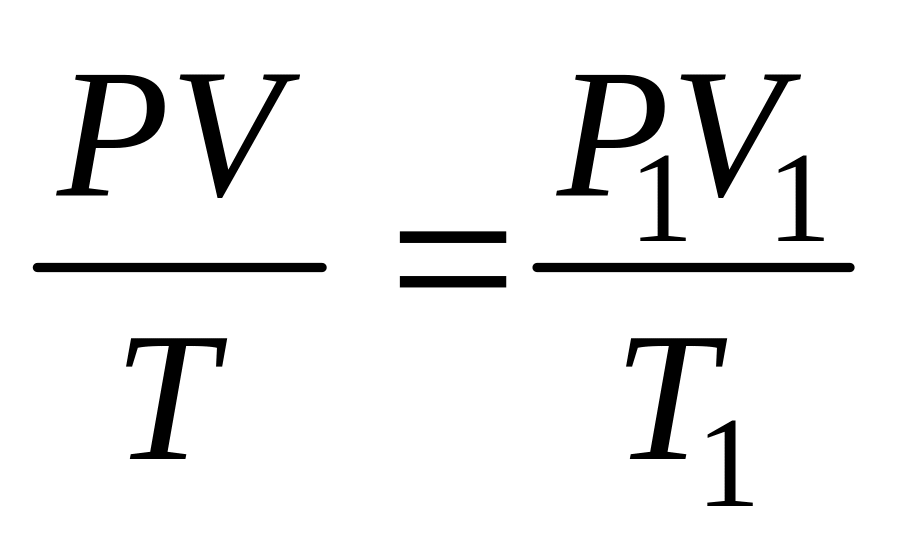 или
или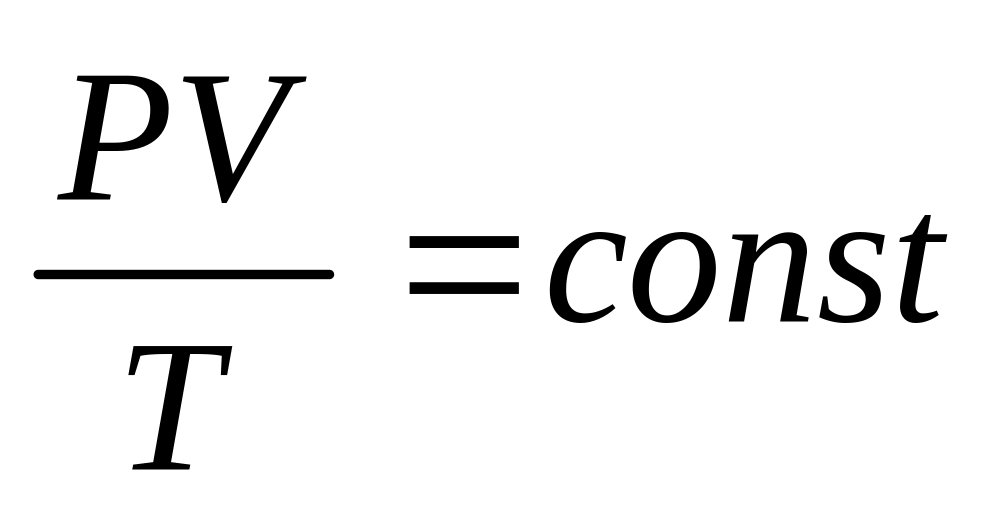 .
.
Обозначим
значение
![]() через R,
тогда получим следующее уравнение:
через R,
тогда получим следующее уравнение:
PV = RT
Величину R называют универсальной газовой постоянной, а уравнение – уравнением состояния идеального газа.
Из последнего уравнения величину R можно выразить следующим образом:
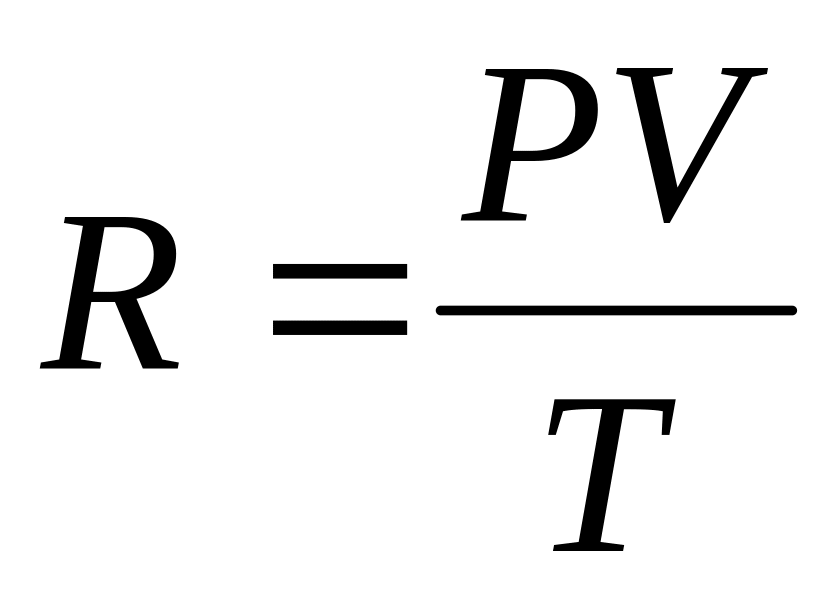
В этом уравнении числитель представляет собой работу газа при увеличении объема от 0 до V против внешнего давления и при повышении температуры на 1 0C.
Если в уравнение состояния подставить значения входящих в него величин для одного моля (P = 101325 H/м3 ; Vm = 22.414 м3/кмоль ; T = 273.15 K), то получим следующее численное значение универсальной газовой постоянной:
R
=
8314.41
![]() =
8314.41
=
8314.41
![]() = 8.31441
= 8.31441![]()
5. Закон Авогадро
В начале 19 века итальянский ученый Амадео Авогадро (1776-1856) установил, что если взять равные объемы различных газов и поддерживать для них одинаковую температуру и давление, то содержание молекул в этих объемах будет одинаковым или иными словами одинаковое число молекул различных газов будет занимать один и тот же объем при нормальных условиях.
Было установлено, что одна грамм-молекула любого газа при нормальных условиях занимает объем 22.414 л. Этот объем называют грамм-молекулярным или числом Авогадро.
6. Закон Грейама
В первой половине 19-го века английский ученый Томас Грейам (1805-1869) проводил исследования по изучению явления диффузии в газах. Он установил, что скорость диффузии газа обратно пропорциональна корню квадратному из его плотности.
Для случая истечения газа из малых отверстий этот закон формулируется следующим образом.
При
одинаковых давлениях и температурах
скорости истечения разных газов υ из
малых отверстий обратно пропорциональны
корням квадратным из их плотности
![]() :
:
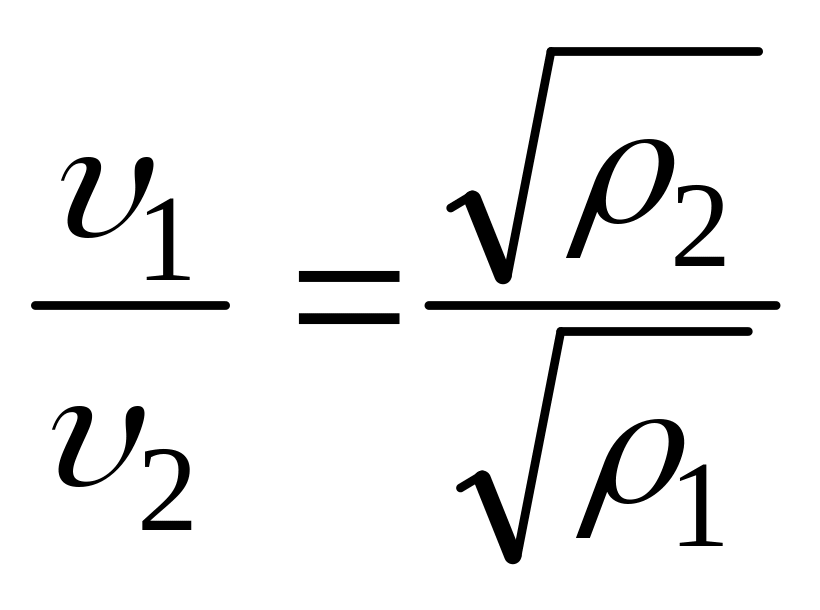
На основании этого закона мы можем определить также и скорость истечения газа через отверстие сечением F в единицу времени. Для этого определим в начале массу газа вытекающего из отверстия сечением F в единицу времени:
m
= F![]()
Тогда работа, затрачиваемая на истечение газа через малые отверстия, может быть выражена следующим уравнением:
A = F(P1 – P2),
где P1 – давление газа в емкости;
P2 – давление газа в пространстве, куда поступает газ.
Принимая
во внимание, что затраченная работа
равна
![]() ,
получаем после подстановки и соответствующих
преобразований следующее выражение:
,
получаем после подстановки и соответствующих
преобразований следующее выражение: