
- •Модуль і. Фізичні основи видобутку нафти і газу. Тема: Стани вуглеводневих газорідинних сумішей.
- •Фазові стани вуглеводневих сумішей.
- •Стани вуглеводневих газорідинних сумішей при зміні тиску та температури.
- •Тема: Пластові води нафтових і газових родовищ.
- •Тема: Нафтові емульсії.
- •Тема: Пластова енергія і сили, що діють у покладах.
- •Модуль іі. Розробка нафтових і газових свердловин. Тема: Дослідження нафтових і газових свердловин і пластів.
- •Тема: Апаратура для дослідження свердловин.
- •Тема: Проектування розробки нафтових покладів.
- •Тема: Методи підвищення нафтовіддачі пластів.
- •3. Теплові методи.
- •Модуль ііі. Експлуатація нафтових свердловин. Тема: Обладнання гирла фонтанних свердловин.
- •Типові схеми фонтанних арматур:
- •Тема: Дослідження фонтанних свердловин.
- •Тема: Пуск газліфтної свердловини в експлуатацію.
- •Тема: Верстати – качалки (вк).
- •Тема: Інші види безштангових насосів.
- •Модуль іv Експлуатація газових і газоконденсатних свердловин. Тема: Сепарація газу.
- •Тема: Автоматизація газового промислу.
- •Модуль V Методи збільшення продуктивності свердловин. Тема: Призначення та класифікація методів дії на привибійну зону пласта.
- •Тема: Різновид кислотних обробок.
- •Тема: Обладнання для грп.
- •Тема: Віброобробка вибоїв свердловин.
- •Тема: Підземний ремонт свердловин.
- •3. Склад робіт.
- •Список літератури
- •Перелік питань для самоперевірки.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ

К О Н С П Е К Т
для самостійного опрацювання
з предмета
“ Експлуатація нафтових і газових свердловин ”
для спеціальності
5.04010304 “Розвідування нафтових і газових родовищ”
Розробила викладач Дяченко Ю.Г.
Розглянуто і схвалено на засіданні
МЦК експлуатаційних дисциплін
Протокол № ___ від “___”____ 20 року
Голова МЦК . Крицький В.В.
ВСТУП
Конспект призначений для самостійної роботи студентів з предмету “Експлуатація нафтових і газових свердловин”, який є дисципліною циклу професійної та практичної підготовки.
Указана дисципліна викладає теорію підйому нафтогазопромислової продукції на денну поверхню для потреб промисловості, транспорту, комунального господарства та побуту.
Самостійну роботу з вивчення дисципліни необхідно починати із засвоєння теоретичного матеріалу, усвідомлення фізичної сутності питань, а потім переходити до відповідей на питання для самоперевірки.
Навчальний матеріал подається у вигляді окремих змістових модулів, покладених в основу кредитно-модульної системи навчання.
Модуль і. Фізичні основи видобутку нафти і газу. Тема: Стани вуглеводневих газорідинних сумішей.
План:
Основні закони газового стану.
Фазові стани вуглеводневих сумішей.
Стани вуглеводневих газорідинних сумішей при зміні тиску та температури.
1. При вивченні руху газу в пласті, системах транспорту газу необхідно знати , як змінюються його властивості с зміною тиску і температури. Зв'язок між параметрами, характеризують властивості газу, і умови, в яких він знаходиться, виражається газовими законами. В практичних обчисленнях більш часто використовують газові закони Авогадро, Дальтона, Бойля – Маріотта, Гей – Люссака, Шарля.
Згідно закону Авагадро в рівних об’ємах різних ідеальних газів при однаковому тиску та температурі вміщує одне і те ж число молекул. З цього закону також слідує і рівність об’ємів одного моля різних газів в однакових умовах.
Закони Дальтона и Амага виражають адитивність парціальних об’ємів і парціального тиску суміші індивідуальних газів. Це означає ,що кожний газ в суміші поводить себе так, як що б він був в даному об’ємі був один. Парціальний тиск компонента газової суміші - тиск, який мав би газ, як би один займав об’єм, рівний суміші при такій же температурі. Згідно закону Дальтона загальний тиск суміші газів p рівний сумі парціальних тисків компонентів pi:
p=![]()
Парціальний об’єм – це об’єм, який займав би даний компонент суміші газів, якщо б з неї видалили інші компоненти при умові зберігання основного тиску і температури. В сумісності с законом Амага загальний об’єм суміші газів V при постійному тиску дорівнює сумі парціальних об’ємів компонентів Vi:
V=![]()
В нафтогазопромисловій практиці для розрахунку стану реального газу більш часто використовують рівняння Клапейрона – Менделєєва, в які вводиться поправка , яка враховує відклонення реальних газів від ідеальних і називається коефіцієнт зверхстиснення ( іноді стискання) газу. Загальне рівняння газів рівняння Клапейрона – Менделєєва має наступний вигляд:
![]()
де
z
– коефіцієнт
зверх стискування газу; m-
маса газу; M-
молекулярна
маса газу; R-
універсальна
газова постійна (8,31441 Дж/(моль![]() К)); Т – температура газу.
К)); Т – температура газу.
Фазові стани вуглеводневих сумішей.
При русі нафти і газу в пласті, стволі свердловини, система збору та підготовки змінюється тиск і температура, що зумовлює зміну фазового стану вуглеводнів – перехід від рідкого в газоподібний стан і навпаки. Так як нафта і газ складаються більше з різних по властивостям компонентів , то при певних умовах частина цих компонентів може знаходитись в рідкій фазі, а інша – паровій (газовій) фазі. Умови дальнього транспорту нафти та газу і послідуючі переробки потребують відділення легко випаровуючи компонентів від рідкої конденсованої фракції. Тому вибір технології розробки родовища, системи внутрішньо промислової підготовки нафти та газу багатьом пов’язана с вивченням фазового стану вуглеводнів в змінних термодинамічних умовах.
Фазові перетворення вуглеводневих систем ілюструють діаграми фазових станів, що показують зв'язок між тиском, температурою та питомим об’ємом речовини.
Н а
малюнку приведена діаграма стану чистого
газу (етану).
а
малюнку приведена діаграма стану чистого
газу (етану).
С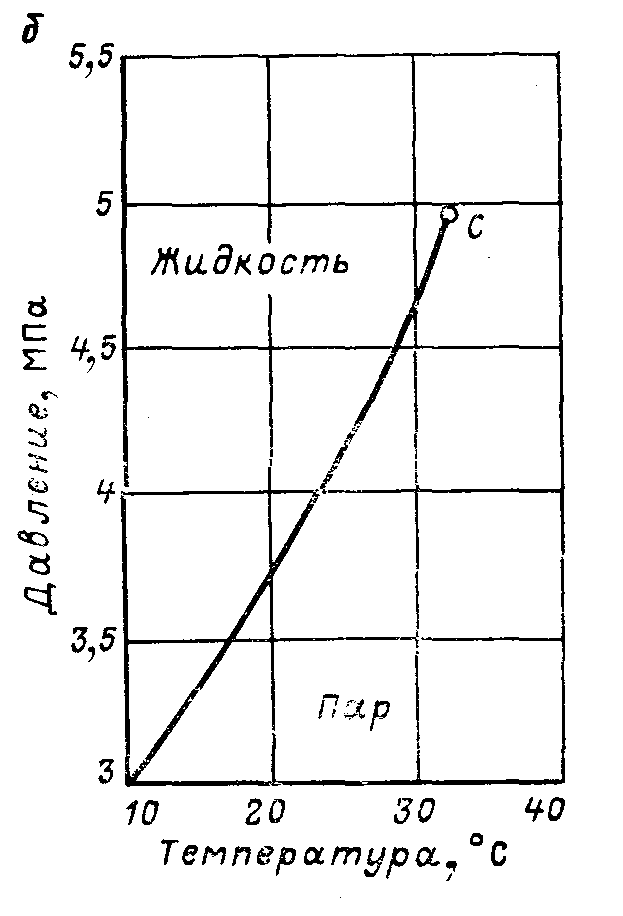 уцільними
лініями на діаграмі вказаний зв'язок
тиску з питомим об’ємом речовини при
постійних температурах. Лінії, які
проходять через область, обмежену
пунктирною кривою, має три характерні
ділянки. Якщо розглядати одну з ліній
області високих тисків, то спочатку
ріст тиску супроводжується невеликим
збільшенням питомого об’єму речовини,
яке володіє стискуванням і в цій області
знаходиться в рідкому стані. При деякому
тиску ізотерма різко зламується і має
вигляд горизонтальної лінії. При
постійному тиску відбувається непереривне
збільшення об’єму рідини. В цій області
рідина випаровується і переходить в
парову фазу. Випаровування закінчується
в точці другого зламу ізотерми, після
якого зміна об’єму супроводжується
майже пропорційним зменшенням тиску.
В цій області всі речовини знаходяться
в газовому стані( паровій фазі). Пунктирною
лінією , яка з’єднує точки зламу ізотерм,
обмежена область переходу рідини з
рідкого в паровий стан або навпаки. Ця
область відповідає умовам, при яких
рідина знаходиться одночасно в двох
станах рідкому і газовому. Пунктирна
лінія , знаходиться вліво від точки С,
називається кривою
точок пароутворення.
Координати точок даної лініях – тиск
і температура, при яких починається
кипіння речовин. Вправо від точки С
лежить пунктирна лінія, називається
кривою
точок конденсації або точок роси.
При розгляданні ізотерми, не перетинаючи
двохфазної області видно, що властивості
рідини змінюють безперервно і перехід
рідини з рідкого стану в газоподібний
або навпаки відбувається, оминаючи
двохфазний стан.
уцільними
лініями на діаграмі вказаний зв'язок
тиску з питомим об’ємом речовини при
постійних температурах. Лінії, які
проходять через область, обмежену
пунктирною кривою, має три характерні
ділянки. Якщо розглядати одну з ліній
області високих тисків, то спочатку
ріст тиску супроводжується невеликим
збільшенням питомого об’єму речовини,
яке володіє стискуванням і в цій області
знаходиться в рідкому стані. При деякому
тиску ізотерма різко зламується і має
вигляд горизонтальної лінії. При
постійному тиску відбувається непереривне
збільшення об’єму рідини. В цій області
рідина випаровується і переходить в
парову фазу. Випаровування закінчується
в точці другого зламу ізотерми, після
якого зміна об’єму супроводжується
майже пропорційним зменшенням тиску.
В цій області всі речовини знаходяться
в газовому стані( паровій фазі). Пунктирною
лінією , яка з’єднує точки зламу ізотерм,
обмежена область переходу рідини з
рідкого в паровий стан або навпаки. Ця
область відповідає умовам, при яких
рідина знаходиться одночасно в двох
станах рідкому і газовому. Пунктирна
лінія , знаходиться вліво від точки С,
називається кривою
точок пароутворення.
Координати точок даної лініях – тиск
і температура, при яких починається
кипіння речовин. Вправо від точки С
лежить пунктирна лінія, називається
кривою
точок конденсації або точок роси.
При розгляданні ізотерми, не перетинаючи
двохфазної області видно, що властивості
рідини змінюють безперервно і перехід
рідини з рідкого стану в газоподібний
або навпаки відбувається, оминаючи
двохфазний стан.
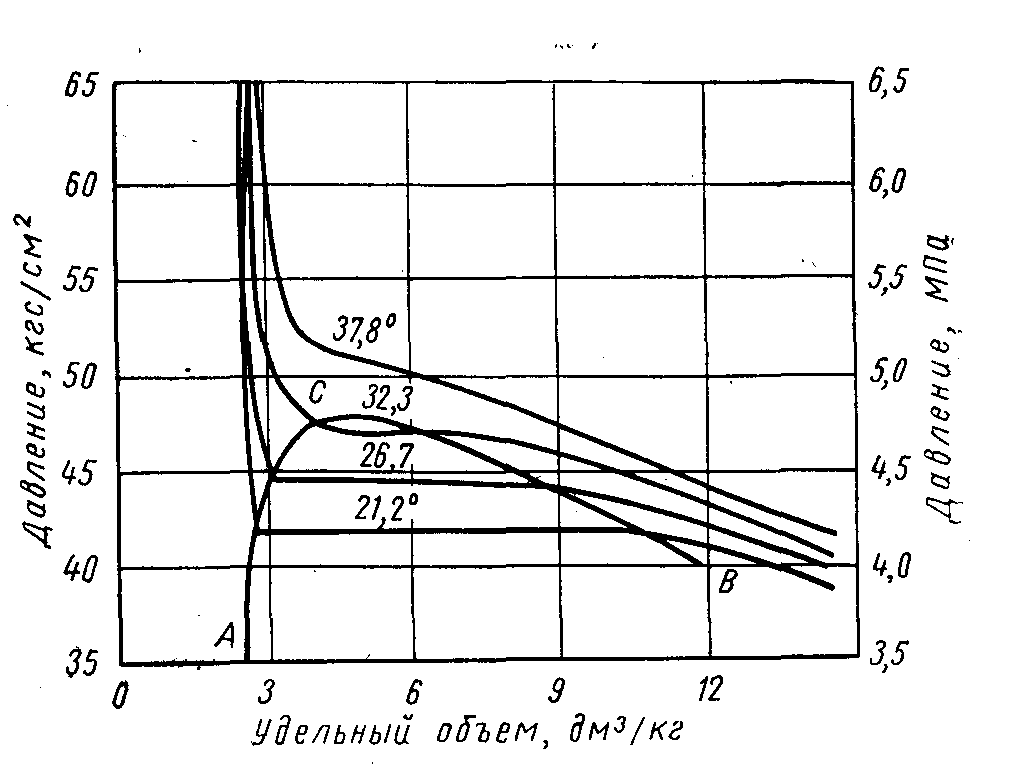 На
малюнку приведена діаграма стану етану,
перебудована в координатах тиску –
температура. Так як чиста речовина з
одного фазового стану в інше переходить
при постійному тиску, то криві точок
випаровування і конденсації на цій
діаграмі співпадають і закінчуються
критичною точкою С. Отримана лінія межує
області рідкого і парового стану рідини.
В двохфазному стані речовина може
знаходитись тільки при тиску і температурі,
які відповідають координатам цієї
лінії. Закономірності фазових переходів
складніше, якщо рідина являє собою
багатокомпонентну систему.
На
малюнку приведена діаграма стану етану,
перебудована в координатах тиску –
температура. Так як чиста речовина з
одного фазового стану в інше переходить
при постійному тиску, то криві точок
випаровування і конденсації на цій
діаграмі співпадають і закінчуються
критичною точкою С. Отримана лінія межує
області рідкого і парового стану рідини.
В двохфазному стані речовина може
знаходитись тільки при тиску і температурі,
які відповідають координатам цієї
лінії. Закономірності фазових переходів
складніше, якщо рідина являє собою
багатокомпонентну систему.
