
- •Введение
- •Раздел 1. Хромопротеины
- •1.1. Гемопротеины
- •1.1.1. Гемоглобин (Нb)
- •Оксигенирование гемоглобина
- •Транспорт двуокиси углерода
- •Патологические производные гемоглобина
- •1.1.2. Миоглобин (Mb)
- •1.1.3. Ферментные гемопротеины
- •1.2. Обмен Fe-содержащих хромопротеинов
- •1.2.1. Экзогенный обмен (распад гемоглобина в желудочно-кишечном тракте)
- •1.2.2. Эндогенный обмен хромопротеинов (тканевый обмен)
- •1. Конъюгация билирубина с глюкуроновой кислотой
- •2. Транспорт коньюгированного билирубина из печени в желчь
- •Нарушение обмена Fe-содержащих хромопротеинов
- •Вопросы для самоподготовки
- •Тестовые задания для самоподготовки
- •Раздел II. Углеводы. Углевод-белковые комплексы
- •2.1. Структура биологически важных углеводов. Распространение в природе (в том числе в пищевом сырье)
- •2.1.1. Моносахариды (простые углеводы)
- •Классификация
- •2.1.2. Дисахариды
- •2.1.3. Полисахариды
- •Гомополисахариды. Представители, биологическое значение, распространение в природе
- •2.2. Гликопротеины и протеогликаны
- •2.2.1. Общие черты синтеза углеводной части гликопротеинов и протеогликанов
- •Особенности биосинтеза протеогликанов
- •2.2.2. Гликопротеины
- •Физико-химические свойства гликопротеинов
- •Биологическая роль гликопротеинов
- •2.2.3. Протеогликаны
- •Структура и биологическая роль отдельных представителей
- •Р ис.8. Схема строения протеогликана из хряща – «ершик».
- •Вопросы для самоподготовки
- •Тестовые задания для самоподготовки
- •Раздел III. Липиды. Липопротеины.
- •3.1. Липиды
- •Наиболее распространенные ненасыщенные (непредельные) жирные кислоты природных липидов
- •3.1.1. Классификация липидов
- •3.1.2. Простые липиды Триацилглицеролы (триглицериды, тг)
- •Жирные кислоты, входящие в состав восков
- •Стериды (или стероиды)
- •Простагландины
- •3.1.3. Сложные липиды
- •Глицерофосфолипиды (или фосфоглицериды)
- •Р ис.10 Схема амфифильной структуры фосфолипидов
- •Сфингофосфолипиды (сфингомиелины)
- •Гликолипиды (гликосфинголипиды)
- •Содержание ганглиозидов в тканях человека (концентрации выражены в нмолях липидосвязанной сиаловой кислоты – характерного компонента ганглиозидов на 1 г свежей ткани)
- •3.2. Липопротеины
- •3.2.1. Структурные липопротеины
- •3.2.2. Транспортные липопротеины
- •Плазмы крови в полиакриламидном геле
- •Липопротеидных частиц и их плотностью
- •3.2.3. Строение и состав липопротеинов
- •Представители аполипопротеинов
- •3.2.4. Образование и функции липопротеинов
- •3.2.5. Нарушения липидного обмена Гиперлипопротеинемии
- •Вопросы для самоподготовки
- •Тесты для самоподготовки
- •6. Установить соответствие:
- •15. Стерины находятся в крови обычно в форме:
- •Раздел IV. Нуклеиновые кислоты. Нуклеопротеины
- •4.1. Общая Характеристика нуклеиновых кислот
- •П роизводные нуклеотидов
- •4.2.3. Биологические функции нуклеотидов
- •4.3. Структура нуклеиновых кислот
- •4.3.1. Первичная структура.
- •4.3.2. Вторичная и третичная структуры днк
- •Третичная структура днк
- •4.3.3. Вторичная и третичная структура рнк
- •Р ис. 15. Вторичная структура тРнк
- •4.3.4. Физико-химические свойства нуклеиновых кислот
- •4.4.2. Распад нуклеопротеинов
- •Р ис.18. Схема переваривания нп в тонком кишечнике
- •Распад пуриновых оснований в тканях
- •Распад пиримидиновых азотистых оснований
- •4.5. Получение трансгенных растений
- •Вопросы для самоподготовки
- •Тесты для самоподготовки
- •7. Какие соединения являются дезоксирибонуклеозидтрифосфатами? а) дГдф в) удф д)дУдф
- •Терминологический словарь
- •Библиографический список
- •Оглавление
- •Раздел 1. Хромопротеины 4
- •Раздел II. Углеводы. 21
- •Раздел III. Липиды. Липопротеины. 53
- •Раздел IV. Нуклеиновые кислоты. Нуклеопротеины 83
Биологическая роль гликопротеинов
Функции, выполняемые гликопротеинами:
1) «смазочные» и защитные агенты (муцин, слизистые секреты);
2) транспортные молекулы для витаминов, липидов, минералов и микроэлементов;
3) иммунологические и защитные молекулы (иммуноглобулины, антигены гистосовместимости, комплемент, интерферон и другие острофазовые белки);
4) гормоны (хорионический гонадотропин, тиреотропин);
5) ферменты (протеазы, нуклеазы, гликозидазы, гидролазы, факторы свертывания);
6) места клеточных контактов и распознавания (клетка-клетка, вирус-клетка, бактерия-клетка, гормональные рецепторы);
7) антифризные функции у антарктических рыб;
8) лектины (от латинского «выбирать») – гликопротеины растений.
1. Белки–слизи – это вязкие студенистые соединения. Находятся в слюне, желудочно-кишечном тракте, мочевыводящих путях, в крови. В своем составе имеют основной компонент слизи – муцин. Это гликопротеины большой молекулярной массы, значительная доля которой приходится на олигосахариды, состоящие из остатков фукозы, глюкозамина, сиаловой кислоты и других. Благодаря межмолекулярному взаимодействию муцины в воде образуют трехмерные молекулярные сети. Вследствие этого образуется гель, защищающий эпителиальные клетки ЖКТ от активных форм пищеварительных ферментов (то есть предохраняет от самопереваривания) и действия соляной кислоты в желудке. Белковая часть муцинов относительно устойчива к перевариванию благодаря защитному действию углеводов. Муцины синтезируются и секретируются особыми бокаловидными клетками кишечного эпителия в соответствии с потребностями пищеварения. Кроме того, муцины термостабильны (предохраняют слизистую рта от ожогов), а также защищают слизистую рта от химических и механических повреждений. В комплексе с лизоцимом муцин обладает бактерицидным действием.
Гастромукопротеин – муцин желудка. Внутренний фактор Касла – фактор кроветворения. Он связывает витамин В12, повышает его растворимость, снижает токсичность, способствует всасыванию в кишечнике и предохраняет витамин В12 от поглощения микрофлорой кишечника. Витамин В12 участвует в гемопоэзе, то есть в синтезе гемоглобина. При тотальной резекции желудка развивается анемия, так как нарушается всасывание витамина В12.
Урогликопротеины – муцины, которые обнаружены в моче. Обладают бактерицидным действием. Предохраняют мочевыводящие пути от механических повреждений, так как препятствуют конгломерации нерастворимых уратов – кислых солей мочевой кислоты, щавелевой кислоты и других.
2. Гликопротеины плазмы крови (серомукоиды (серум – сыворотка)). Они синтезируются в печени, а затем поступают в кровь, главным образом в составе глобулиновой фракции. Наиболее известными представителями являются группоспецифические субстанции крови, протромбин, фибриноген, γ-глобулины, гаптоглобин, трансферрин, церулоплазмин, α1-кислый гликопротеин и другие острофазовые и транспортные белки.
Биологические функции гликопротеинов сыворотки крови
а) При тех значениях рН и концентрации кислорода, которые характерны для тканей, стабильная форма железа – Fe3+. Трехвалентный ион Fe3+ склонен образовывать сложные нерастворимые гидроксиды. В процессе эволюции возникли белки, способные поддерживать железо в форме, удобной для транспортировки и использования при синтезе гема. Этими белками являются трансферрин и ферритин.
Трансферрин – синтезируется в печени, имеет два центра связывания железа. Железо в составе трансферрина находится в трехвалентном состоянии и присоединяется вместе с анионом гидрокарбоната. Главная функция трансферрина – перенос железа с током крови к местам депонирования и использования. Содержания трансферрина в плазме крови равно ≈ 0,4 г/100 мл крови. Место депонирования – ферритин тканей (см. тему «Хромопротеины»).
б) Гаптоглобин – синтезируется в печени. Находится в крови в составе α2-глобулиновой фракции. Связывает гемоглобин в крови после гемолиза эритроцитов и транспортирует гемоглобин (Нb) в клетки ретикулоэндотелиальной системы, главным образом селезенки. Гемоглобин в свободном состоянии нерастворим и очень токсичен. Кроме того, Нb – это низкомолекулярный белок и в несвязанном состоянии с гаптоглобином он способен выводиться с мочой и вызывать острую почечную недостаточность. Тем самым гаптоглобин способствует сохранению железа в организме и снижает его токсичность. Благодаря пероксидазной активности комплекс гаптоглобин – Нb участвует в процессах детоксикации, защищает от протеолиза (является ингибитором катепсина В), участвует в транспорте витамина В12. Гаптоглобин содержится в плазме крови в концентрации 1–3 г/л.
в) Церулоплазмин (ЦП) – медьсодержащий белок, голубого цвета, обладающий свойствами фермента феррооксидазы и участвующий благодаря этому в окислении двухвалентного железа кислородом воздуха (восстанавливая кислород до воды). Церулоплазмин синтезируется в печени в составе α2–глобулиновой фракции. Также как гаптоглобин, церулоплазмин относится к белкам острой фазы. В состав ЦП входят 80 % белка, 16 % углеводов и 0,32 % меди (по 2 атома на каждую полипептидную цепь). На одну молекулу ЦП приходиться 8 атомов меди, четыре из которых постоянно находятся в одновалентном состоянии (Сu+), а остальные – могут быть – Сu2+ и Сu+ – в зависимости от присутствия лиганда.
Активное состояние ЦП обусловлено Сu2+. Восстановление меди до Сu+ сопровождается потерей оксидазной активности и присущей белку синей окраски. Это может произойти, например, при взаимодействии ЦП с аскорбиновой кислотой. Уровень концентрации в крови ЦП контролируется гормонами и медиаторами иммунной системы: глюкагоном, кортикостероидными гормона-ми, простагландинами класса Е2, интерлейкином – I. ЦП чувствителен к действию протеолитических ферментов, под влиянием которых он распадается на три полипептидных фрагмента. Физиологическая и биохимическая роль церулоплазмина еще полностью не раскрыта. Одно из главных предназначений ЦП – осуществление переноса меди из печени, где синтезируется ЦП, к органам и тканям, в которых Сu входит в состав фермента цитохром оксидазы (цитохром А3) и супероксиддисмутазы. Будучи ферроксидазой, ЦП способствует насыщению железом (Fe3+) апотрансферрина. Тем самым ЦП опосредованно участвует в кроветворении.
ЦП способен ферментативно окислять различные полиалкоголи, полифенолы и полиамины, такие как аскорбиновая кислота, гидрохиноны, катехолы. Ферментативная реакция активируется ионами Fe2+, эстрогенами, андрогенами, ингибируется цианидами, хлоридами, а также (в больших концентрациях) мочевиной, мочевой кислотой и билирубином.
ЦП обладает антиокислительной активностью. Обнаружено, что он восстанавливает О2– ∙.(супероксидный анион-радикал) до кислорода (О2) и воды, то есть обладает супероксиддисмутазной активностью и функционирует в крови. ЦП перехватывает свободнорадикальные формы кислорода, которые образуются в макрофагах и лейкоцитах при фагоцитозе и развитии перекисного окисления липидов в очаге воспаления, предохраняя тем самым липидсодержащие структуры от перекисного окисления.
Таким образом, церулоплазмин следует рассматривать как:
белок острой фазы – гликопротеин (защитные функции);
медьсодержащий (транспортирует Сu в крови);
белок, участвующий в обмене железа и, следовательно, в кроветворении;
антиокислитель.
Концентрация ЦП в плазме колеблется в пределах 150–600 мг/л. В настоящее время разработана технология получения церулоплазмина из донорской крови и использования его как лекарственного препарата при воспалительных процессах, анемии, ожогах, радиационных поражениях.
Углеводная часть сиалоцерулоплазмина содержит на концах цепей олигосахарида – сиаловую кислоту:
Концевой моносахарид
Фрагмент
олигосахарида
Скорость обновления этого белка в крови довольно велика: время полужизни измеряется несколькими часами. Если же удалить концевой остаток – сиаловую кислоту, то время полужизни ЦП (асиалоцерулоплазмина – асиалоЦП) уменьшается до нескольких минут. Такой асиалоЦП улавливает рецепторами гепатоцитов, комплементарными к дисахаридным остаткам «галактоза-N-ацетилглюкозамин». Присоединение асиалоЦП к рецепторам запускает механизм эндоцитоза, эндоцитозный пузырек затем сливается с лизосомой и асиалоЦП разрушается гликозидазами и протеазами лизосом. Если у асиалоЦП удалить еще галактозу, то рецепторы печени не способны связать такой асиалоЦП и время полужизни становится таким же, как у исходного церулоплазмина. Таким образом, углеводная часть гликопротеина определяет продолжительность его существования в крови.
Такими рецепторами, узнающими углевод, в гликопротеинах снабжены многие клетки. Причем набор рецепторов в клетках разного типа не одинаков. Например, некоторые асиалогликопротеины, если от них отщепить и следующие моносахариды, улавливаются не печенью, а почками. Таким образом, углеводная часть гликопротеинов служит чем-то вроде путевки, в которой при помощи определенного чередования моносахаридов записан адрес следования гликопротеина. При некоторых заболеваниях печени (рак, цирроз, гепатит), наблюдается повышение концентрации асиалогликопротеинов в крови в 2–3 раза.
Делаются попытки применить полисахаридную «путевку» для доставки лекарственных веществ в нужный орган или нужные клетки.
Кроме того, гликопротеины плазмы крови участвуют:
в процессе свертывания крови (протромбин, фибриноген);
участвуют в определении групп крови;
выполняют защитную функцию (иммуноглобулины);
входят в состав острофазовых белков (α1-кислый гликопротеин, интерфероны, комплемент).
3. Гликопротеины – рецепторы. Часть мембранных белков представлена углеводсодержащими белками – гликопротеинами. Углеводная часть (простетическая группа) этих белков представлена моносахаридными или олигосахаридными цепями. Некоторые интегральные белки прошивают мембрану насквозь, выступая за ее пределы по обе стороны. Примером может служить белок гликофорин, входящий в состав плазматической мембраны эритроцитов. На его долю в этой мембране приходится около 10% от всех белков. Полипептидная цепь гликофорина состоит приблизительно из 200 аминокислотных остатков, к которым присоединено около 20 олигосахаридных цепей длиной до 12 моносахаридов. Углеводы составляют примерно половину всей массы гликопротеина. Все углеводные цепи сосредоточены на N-концевой части молекулы. Белки мембран различны по составу и выполняют разную функцию. Это могут быть и структурные белки, и ферменты, и белки, осуществляющие трансмембранный перенос веществ, и рецепторы гормонов или других регуляторов функций (например, родопсин зрительных палочек улавливает свет).
Олигосахаридные
цепи рецептора на наружной стороне
мембраны
α–спираль ппц
рецептора
Внутренняя
сторона мембраны
Мембрана
Внешняя сторона
мембраны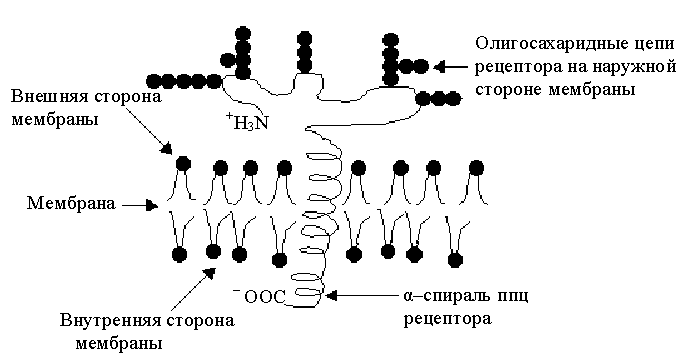
Рис.7. Гликофорин в мембране эритроцита
4. Лектины. Способны вызывать агрегацию или склеивание клеток, путем специфического взаимодействия лектинов с углеводными компонентами поверхности клеток (эритроцитов, бактерий и клеток тканей). Лектины соевых бобов, зародыши пшеницы используют для определения группы крови, изучения поверхности здоровых и больных клеток (например, раковых).
Отсутствие высокой активности лектинов в белковых продуктах из бобовых является одним из санитарно-гигиенических требований, предусматриваемым сертификацией для использования их в хлебопечении, кондитерской и других отраслях промышленности, в целях повышения пищевой ценности изделий. Снижение активности лектинов достигается кипячением при 80 0С.
