
- •3. Зразки розв’язування задач та виконання вправ
- •Методичні рекомендації до розв’язання розрахункових задач
- •Приклади розв’язання задач з відповідними міркуваннями
- •Розв’язання:
- •Розв’язування задач та виконання вправ
- •Mr(h2wo4) − ? певного виду, що входять до однієї молекули сполуки (формульної одиниці речовини);
- •H2wo4 − дигідроґен тетраоксовольфрамат(vі) або
- •Розв’язування:
- •Д ано: Розв’язування:
- •Розв’язування
- •Алгоритм дій:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •2 Моль а12о3 –– 3342 кДж
- •1 Моль а12о3 –– х кДж
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •За р.Р. П 1 моль
- •44,1 Г (12%) −− 12 г (44,1% тобто крис-т) і 32,1 г (0% тобто вода)
- •Алгоритм дій:
- •В иконання вправи:
- •Алгоритм дій:
- •Алгоритм дій:
- •Відповідь:
- •Алгоритм дій:
- •Алгоритм дій:
- •Виконання завдань:
- •Відповідь:
- •Алгоритм дій:
- •В иконання вправи:
- •В.: 270 г 8%-ного та 60 г 30%-ного.
- •В.: 750 г 3%-ного та 510 г 45%-ного.
- •В.: 440 г 16%-ного та 80 г 42%-ного.
- •Найбільш поширені формули та аналітичні вирази правил і законів, що використовуються при розв’язуванні задач з хімії
- •Масова частка домішок у технічному зразку речовини:
- •Співмірність одиниць виміру реагуючих речовин та продуктів реакцій:
- •Загальні схеми більшості хімічних властивостей представників основних класів неорганічних сполук
- •13Б. Середні солі (кристалічні) (які складаються із залиш-
- •2. Взаємодія сульфатної кислоти (н2sо4) з металами
- •3. Взаємодія нітратної кислоти (нnо3) з металами
- •4. Термічний розклад нітратів
- •5. Несолетворні (або індиферентні) оксиди
- •6 . Поведінка основних окисників у різних середовищах
- •У “Електрохімічному ряді напруг” метали розташовані так (див. Табл. 2):
- •Графічні формули деяких неорганічних сполук
- •Розчинність основ, кислот і солей у воді. Відносні молекулярні маси речовин
- •Відносна електронегативність елементів
- •Основна
- •Додаткова
Розв’язування:
1. Який тепловий ефект реакції?
Na2O(к.) + H2O(p.) = 2NaOH(p.) + Qp..
Qp. = (Qутв.(продуктів)) − (Qутв.(вихідних речовин));
Qp. = [п(NаОН) Qутв.(NаОН) ] −
−[п(Nа2O) Qутв.(Nа2O) + п(Н2О) Qутв.(Н2О)] ;
Qp. = [2 470,0 ] − [1 416,0 + 1 285,8] ;
Qp. = 940,0 − 760,3 = 238,2 (кДж).
2. Яка кількість теплоти виділиться, якщо вступить в реакцію 124 г натрій оксиду?
Na2O(к.) + H2O(p.) = 2NaOH(p.) + 238,2 кДж
за р.р. п 1 моль
М 62 г/моль
m 62 г 238,2 кДж
за у.з. 124 г х кДж
62 : 124 = 238,2 : х
х = ![]() = 476,4 (кДж)
= 476,4 (кДж)
В.: Q = 476,4 кДж
Приклад 26. Доокиснення сульфур(ІV) оксиду (SО2) зоб-ражується такою схемою реакції:
SО2(г.) + О2(г.) SО3(р.) + Qр. кДж.
Яка кількість теплоти виділиться при доокисненні 4032 дм³ (н.у.), якщо теплоти утворення сульфур(ІV) оксиду та суль-фур(VІ) оксиду відповідно дорівнюють (кДж/моль): 296 і 439 ?
Дано: Алгоритм дій:
1. Урівнюємо
дану схему р
Qутв.(О2) = 0 кДж/моль
Qутв.(SО2) = 296 кДж/моль
Qутв.(SО3) = 439 кДж/моль
V(SО2) = 4032 дм³
Q − ?
реакції.
2. Знаходимо тепловий ефект реакції.
3. Обчислюємо теплоту, що виділить-
 ся, якщо в реакцію
вступить суль-
ся, якщо в реакцію
вступить суль-
фур(ІV) оксид об’ємом 4032 дм³.
Розв’язування:
1. Який тепловий ефект реакції ?
2SО2(г.) + 3О2(г.) = 2SО3(р.) + Qр. кДж.
Qp. = (Qутв.(продуктів)) − (Qутв.(вихідних речовин));
Qp. = [п(SО3) Qутв.(SО3) ] − [п(SO2) Qутв.(SO2) ] ;
Qp. = (2 439,0 ) − (2 296,0) ;
Qp. = 878,0 − 592,0 = 286,0 (кДж).
2. Яка теплота виділиться, якщо в реакцію вступить сульфур(ІV)
оксид об’ємом 4032 дм³ ?
2SО2(г.) + О2(г.) = 2SО3(р.) + Qр. кДж.
за р.р. п 2 моль
Vm,o 22,4 дм³/моль
V 44,8 дм³ 286 кДж
за у.з. 4032 дм³ х кДж
44,8 : 4032 = 286 : х
х =![]() = 2570 (кДж)
= 2570 (кДж)
В.: Q = 25740 кДж
Приклад 27. Купрум(ІІ) оксид взаємодіє з воднем за схе-мою рівняння реакції: СuO(к.) + H2(г.) Cu(к.) + H2O(р.) + Qр. .
Якщо реагує 10 г купрум(ІІ) оксиду, то виділяється 15,475 кДж теплоти. Яка теплота утворення кристалічного купрум(ІІ) оксиду, якщо теплота утворення рідкої води дорівнює 285,8 кДж/моль ?
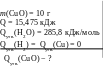 Дано: Алгоритм
дій:
Дано: Алгоритм
дій:
1. Урівнюємо дану схему рівняння
реакції.
2. Обчислюємо тепловий ефект
реакції
3. Знаходимо теплоту утворення
купрум(ІІ) оксиду.
Розв’язування:
1. Який тепловий ефект реакції?
СuO(к.) + H2(г.) = Cu(к.) + H2O(р.) + Qр. .
За р.Р. П 1 моль
М 80 г/моль
m 80 г х кДж
за у.з. 10 г 15,475 кДж
80 : 10 = х : 15,475 х =![]() = 123 (кДж)
= 123 (кДж)
2. Яка теплота утворення купрум(ІІ) оксиду?
Qp. = (Qутв.(продуктів) )− (Qутв.(вихідних речовин));
Qp. = [п(Н2О) Qутв.(Н2О) ] − [п(СuO) Qутв.(СuO)] ;
123,8 = (1 285,8 ) − (1 х) ;
123,8 = 285,8 − х ;
х = 285,8 − 123,8 = 162,0 (кДж/моль)
В.: Qутв.(СuО)(к.) = 162,0 кДж/моль
Приклад 28. Розчин масою 280 г містить сіль натрій хлорид масою 20 г. Яка масова частка розчиненої речовини у розчині?
m(NaC1розч.) = 280 г
m(NaC1) = 20 г
w(%)(NaC1) − ? Дано: Розв’язування:
Дано: Розв’язування:
1. Яка масова частка солі у розчині ?
w(%)(Х) =![]() 100
100
w(%)(NaC1) =![]() 100;
100;
w(%)(NaC1) =![]() 100 = 7,14
100 = 7,14
В.: w(%)(NaCl) = 7,14.
Приклад 29. Сірководень (Н2S) масою 3,9 г розчинили у воді і одержали розчин з масовою часткою речовини 6,5%. Яка маса розчину ?
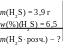 Дано: Розв’язування:
Дано: Розв’язування:
1. Яка маса розчину сірководню ?
w(%)(X) = 100
w(%)(H2S) =![]() 100
100
m(H2Sрозч.) =![]() 100;
m(H2Sрозч.) =
100;
m(H2Sрозч.) =![]() 100 = 60 (г)
100 = 60 (г)
В.: m(H2Sрозч.) = 60 г.
Приклад 30. Масова частка розчину цукру в розчині ма-сою 500 г становить 36%. Яка маса цукру міститься у розчині ?
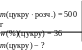 Дано: Розв’язування:
Дано: Розв’язування:
1. Яка маса цукру в розчині ?
w(%)(X) = 100
w(%)(цукру) =![]() 100
100
36 =![]() 100
х =
100
х =![]() = 180 (г)
= 180 (г)
В.: m(цукру) = 180 г.
Приклад 31. Натрій гідроксид масою 20 г розчинили у во-ді масою 180 г. Яка масова частка речовини в одержаному розчині ?
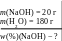 Дано: Розв’язування:
Дано: Розв’язування:
1. Яка маса розчину натрій гідроксиду ?
m(аОНрозч.) = m(аОН) + m(Н2О) ;
m(аОНрозч.) = 20 + 180 = 200 (г)
2. Яка масова частка розчину натрій гідрокси-
ду в розчині ?
w(%)(X) = 100
w(%)(NaOH) =![]() ;
w(%)(NaOH) =
;
w(%)(NaOH) =![]() 100 = 10
100 = 10
В.: w(%)(аОН) = 10.
Приклад 32. У якій масі води розчинили 14 г калій гідро-ксиду, якщо одержали розчин з масовою часткою речовини 5% ?
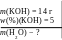 Дано: Розв’язування:
Дано: Розв’язування:
1. Яка маса розчину калій гідроксиду ?
w(%)(X) = 100
w(%)(KOH) =![]() 100
100
5 = ![]() 100 x =
100 x =![]() 100 = 280 (г)
100 = 280 (г)
2. Яка маса води ?
m(КОНрозч.) = m(КОН) + m(Н2О) ;
m(Н2О) = m(КОНрозч.) − m(КОН) ;
m(Н2О) = 280 − 14 = 266 (г) .
В.: m(Н2О) = 266 г .
Приклад 33. У розчині цукру масою 250 г масова частка речовини становить 15%. Яку масу води використали для приготування такого розчину ?
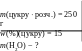 Дано: Розв’язування:
Дано: Розв’язування:
1. Яка маса цукру міститься у розчині?
w(%)(X) = 100 ;
w(%)(цукру) = 100 ;
15 = ![]() 100 х =
100 х = ![]() = 37,5 (г)
.
= 37,5 (г)
.
2. Яка маса води ?
m(цукрурозч.) = m(цукру) + m(Н2О) ;
m(Н2О) = m(цукрурозч.) − m(цукру) ;
m(Н2О) = 250 − 37,5 = 212,5 (г) .
В.: m(Н2О) = 212,5 г .
Приклад 34. Які маси глауберової солі (а2SО4 10Н2О) та води треба взяти, щоб приготувати розчин масою 200 г з масовою часткою речовини безводної солі 12% ?
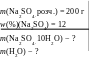 Дано: Розв’язування:
Дано: Розв’язування:
1. Яка масова частка безводної
солі у кристалогідраті?
а2SО410Н2О −− а2SО4
п 1 моль 1 моль
М 322 г/моль 142 г/моль
m 322 г 142 г
w(%)(X) = 100 ;
w(%)(Na2SO4) =![]() 100
;
100
;
w(%)(Na2SO4) =![]() 100 = 44,1
.
100 = 44,1
.
2. Які маси кристалогідрату і води треба взяти для приготування розчину потрібної маси з потрібною масовою часткою речовини ?
Використовуємо квадрат Пірсона (правило змішування, правило хреста):
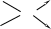
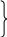 (кристалогідрат) 44,1%
12 г
(кристалогідрат) 44,1%
12 г
12 + 44,1 г
(Н2О) 0% 32,1 г
Для приготування розчину масою 44,1 г з масовою част-кою речовини 12% треба взяти 12 г кристалогідрату і 32,1 г води. Або схематично теоретичні дані з хреста можна представити так:
