
- •3. Зразки розв’язування задач та виконання вправ
- •Методичні рекомендації до розв’язання розрахункових задач
- •Приклади розв’язання задач з відповідними міркуваннями
- •Розв’язання:
- •Розв’язування задач та виконання вправ
- •Mr(h2wo4) − ? певного виду, що входять до однієї молекули сполуки (формульної одиниці речовини);
- •H2wo4 − дигідроґен тетраоксовольфрамат(vі) або
- •Розв’язування:
- •Д ано: Розв’язування:
- •Розв’язування
- •Алгоритм дій:
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •2 Моль а12о3 –– 3342 кДж
- •1 Моль а12о3 –– х кДж
- •Розв’язування:
- •Розв’язування:
- •Розв’язування:
- •За р.Р. П 1 моль
- •44,1 Г (12%) −− 12 г (44,1% тобто крис-т) і 32,1 г (0% тобто вода)
- •Алгоритм дій:
- •В иконання вправи:
- •Алгоритм дій:
- •Алгоритм дій:
- •Відповідь:
- •Алгоритм дій:
- •Алгоритм дій:
- •Виконання завдань:
- •Відповідь:
- •Алгоритм дій:
- •В иконання вправи:
- •В.: 270 г 8%-ного та 60 г 30%-ного.
- •В.: 750 г 3%-ного та 510 г 45%-ного.
- •В.: 440 г 16%-ного та 80 г 42%-ного.
- •Найбільш поширені формули та аналітичні вирази правил і законів, що використовуються при розв’язуванні задач з хімії
- •Масова частка домішок у технічному зразку речовини:
- •Співмірність одиниць виміру реагуючих речовин та продуктів реакцій:
- •Загальні схеми більшості хімічних властивостей представників основних класів неорганічних сполук
- •13Б. Середні солі (кристалічні) (які складаються із залиш-
- •2. Взаємодія сульфатної кислоти (н2sо4) з металами
- •3. Взаємодія нітратної кислоти (нnо3) з металами
- •4. Термічний розклад нітратів
- •5. Несолетворні (або індиферентні) оксиди
- •6 . Поведінка основних окисників у різних середовищах
- •У “Електрохімічному ряді напруг” метали розташовані так (див. Табл. 2):
- •Графічні формули деяких неорганічних сполук
- •Розчинність основ, кислот і солей у воді. Відносні молекулярні маси речовин
- •Відносна електронегативність елементів
- •Основна
- •Додаткова
Розв’язування задач та виконання вправ
ІЗ ЗАГАЛЬНОЇ ХІМЇ
Приклад 1. Обчисліть відносну молекулярну масу речови-ни, формула якої Н2WO4; назвіть речовину за новою номенклатурою.
 Дано: Розв’язування:
Дано: Розв’язування:
H2WO4 1. Яка Mr(H2WO4) ?
Ar(H) = 1 Mr(X) = n(EI)Ar(EI) + n(EII)Ar(EII) +
Ar(W) = 184 + n(EIII)Ar(EIII)+ …. ,
A r(O) = 16
де п(ЕІ),
п(ЕІІ),
n(EIII)і
т.д. – кількість атомів
r(O) = 16
де п(ЕІ),
п(ЕІІ),
n(EIII)і
т.д. – кількість атомів
Mr(h2wo4) − ? певного виду, що входять до однієї молекули сполуки (формульної одиниці речовини);
Ar(EI), Ar(EII), Ar(EIІІ) – відносна атомна маса певного елемен-та, що входить до складу молекули сполуки (формульної одини-ці речовини) (числове значення вказано у періодичній таблиці);
Mr(X) – відносна молекулярна маса певного елемента, що вхо-дить до складу молекули сполуки (формульної одиниці речовини).
Mr(H2WO4) = n(Н)Ar(Н) + n(W)Ar(W) + n(O)Ar(O)
Mr(H2WO4) = 21+1184+ 416 = 250 .
H2wo4 − дигідроґен тетраоксовольфрамат(vі) або
гідроґен вольфрамат(VІ), або
гідроґен вольфрамат(6+), або
гідроґен вольфрамат.
В.: Mr(H2WO4) = 250 .
Приклад 2. Які масові частки (%) елементних Натрія, Сульфуру та Оксиґену в сполуці Na2S2O3. Назвіть речовину.
Д
Na2S2O3
Mr(Na2S2O3)
= 158
Mr(X)
= M(X)
M(Na2S2O3)
= 158 г/моль
w(%)(Na) − ?
w(%)(S) − ?
w(%)(O) − ?
![]() 100
100
Так як М(Х) = Mr(X) і m(E1) = mr(E1),
то
w(%)(X) = ![]() 100,
100,
д е
m(E1)
− маса атомів елементів, що
е
m(E1)
− маса атомів елементів, що
що входить у сполуку, яка взята
кількістю 1 моль;
М(Х) − маса (в г) сполуки, яка взята кількістю 1 моль (молярна маса − г/моль);
mr(E) – відносна маса певного елемента, що входить до скла-ду однієї молекули сполуки (формульної одиниці речовини), числове значення знаходиться за форму-лою: mr(E) = n(E) Ar(E) .
Тоді:
w(%)(X) = ![]() 100.
100.
Розв’язування:
1. Яка w(%)(Na) ?
w(%)(Na) = ![]() 100;
100;
w(%)(Na) = ![]() 100
;
100
;
w(%)(Na) = ![]() 100 = 29,11
.
100 = 29,11
.
2. Яка w(%)(S) ?
w(%)(S) = ![]() 100
;
100
;
w(%)(S) = ![]() 100
;
100
;
w(%)(S) = ![]() 100 = 40,5
.
100 = 40,5
.
3. Яка w(%)(O) ?
w(%)(O) = ![]() 100
;
100
;
w(%)(O) = ![]() 100
;
100
;
w(%)(O) = ![]() 100 = 30,38
.
100 = 30,38
.
Na2S2O3 − динатрій дисульфур триоксиген або натрій тіосульфат
B.: w(%)(Na) = 29,11; w(%)(S) = 40,51; w(%)(O) = 30,38
Приклад 3. Яке відношення мac речовин елементних Маґнію та Нітроґену в сполуці Mg3N2? Назвіть речовину.
Д ано: Розв’язування:
Mg3N2 Нехай дано 100 г речовини
Mr(Mg3N2) = 100 (Див. M(Mg3N2)).
Mr(X) = M(X) 1. Яка m(Mg) ?
M(Mg3N2) = 100 г/моль mr(Mg) = n(Mg)Ar(Mg) = 324 = 72
mr(Mg) = 72; mr(Mg) = m(Mg); m(Mg) = 72 г
m (Mg) : m(N) − ?
2. Яка
m(N) ?
(Mg) : m(N) − ?
2. Яка
m(N) ?
mr(N) = n(N)Ar(N) = 214=28
mr(N) = 22; mr(N) = m(N); m(N)=28 г
3. Яке m(Mg) : m(N) ?
m(Mg) : m(N) = 72 : 28 = 36 : 14 = 18 :7
Mg3N2 − тримаґній динітроґен або маґній нітрид
В.: m(Mg) : m(N) = 18 : 7
Приклад 4. Масові частки речовин елементних Калію, Хрому та Оксиґену відповідно дорівнюють (%): 26,53, 35,37 38,10. Яка найпростіша формула речовини? Дайте їй назву.
Д ано:
ано: ![]()
w(%)(K) = 26,53 де п(Х) – кількість речовини; m(X) – маса
w(%)(Cr) = 35,37 речовини; М(Х) – молярна маса речовини.
w(%)(O) = 38,10 Якщо речовина проста і молекула її представ-
Ar(K) = 39 лена одним атомом, то М(Х) = Мr(X) = Ar(X)
Ar(Cr) = 52
Ar(O) = 16 Розв’язування:
K xCryOz − ? Нехай
дано 100 г речовини. Тоді
xCryOz − ? Нехай
дано 100 г речовини. Тоді
m(K)=26,53 г, m(Cr)=35,37 г, m(O)=38,10 г.
1. Яка n(K) ?
n(K) = m(K) : Ar(K); n(K) = 26,53 : 39 = 0,68 (моль) .
2. Яка n(Cr) ?
n(Cr) = m(Cr) : Ar(Cr); n(Cr) = 35,37 : 52 = 0,68 (моль)
3. Яка n(O) ?
n(O) = m(O) : Ar(O); n(O) = 38,10 : 16 = 2,38 (моль) .
4. Яке співвідношення n(K) : n(Cr) : n(O) ?
n(K) : n(Cr) : n(O) = 0,68 : 0,68 : 2,38 = 68 : 68 : 238 = 2 : 2 : 7
Отже, формула речовини − K2Cr2O7.
K2Cr2O7 − дикилій дихром гептаоксиген або
калій дихромат(VІ), дикалій дихромат(VІ), або
калій дихромат(6+), або калій дихромат.
В.: найпростіша формула речовини − K2Cr2O7.
Приклад 5. Яка відносна густина бутану (С4Н10) за повітрям ?
Д
C4H10,
повітря де D(X1/Х2) – відносна
густина одного
![]()
М(С4Н10) =58 г/моль газу за іншим;
М(пов.) = 29 г/моль М(Х1) – молярна маса газу, відносну
D(C4H10/пов.) − ? густину якого шукають за іншим газом;
М(Х2) – молярна маса газу, відносно
якого шукають відносну густину пер-
шого газу.
Розв’язування:
1. Яка D(C4H10/пов.) ?
![]()
![]()
В.: D(C4H10/пов.) = 2
Приклад 6. Яку кількість речовини становить калій хло-рат(V) масою 24,5 г ?
Д ано: Розв’язування
ано: Розв’язування
m(КС1О3) = 24,5 г 1. Яка п(КС1О3) ?
М (КС1О3)
= 122,5 г/моль
(КС1О3)
= 122,5 г/моль ![]()
п(КС1О3) − ?
п(КС1О3) = m(КС1О3) : М(КС1О3)
п(КС1О3) = 24,5 г : 122,5 г/моль = 0,2 моль
В.: п(КС1О3) = 0,2 моль.
Приклад 7. У посудині об’ємом 16,8 дм³ міститься природній газ метан (СН4) (н.у.). Розрахувати кількість речовини, число молекул та їх масу в посудині.
Д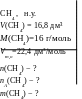 ано:
ано: ![]()
NA = 6,021023 стр. част. = 1 моль будь-
якої речовини;
m(X) = n(X)M(X)
