- •Оглавление
- •Лекция № 7. Растворы. Растворимость……………………………….. 30 Лекция № 8. Концентрация растворов………………………………… 32
- •Лекция № 11. Окислительно-восстановительные реакции…………… 52
- •Лекция №1 основные понятия и законы химии
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Решение
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро ди Кваренья
- •Уравнение Менделеева – Клайперона
- •Лекция №2. Основы химической термодинамики
- •Ядро атома
- •Изотопы
- •Радиоактивность
- •Лекция №3. Строение атома
- •Квантовые числа электронов
- •Принципы заполнения орбиталей
- •Полная электронная формула элемента
- •Полная электронная формула элемента
- •Лекция № 4. Периодический закон д. И. Менделеева
- •Физический смысл химической периодичности
- •Лекция №5. Химическая связь строение молекул
- •4.1. Ковалентная связь
- •4.2. Ионная связь
- •4.3. Водородная связь
- •4.4. Металлическая связь
- •4.5. Гибридизация орбиталей
- •Лекция № 6. Кинетика химических реакций скорость химических реакций
- •Факторы, влияющие на скорость химических реакций.
- •Примеры
- •Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
- •Химическое равновесие
- •Способы смещения равновесия
- •Лекция № 7. Растворы. Растворимость
- •Ненасыщенные, насыщенные и перенасыщенные растворы
- •Растворение как физико-химический процесс
- •Растворимость
- •Лекция № 8. Концентрация растворов Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание, разбавление, концентрирование, смешивание растворов
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •Лекция № 9. Электролитическая диссоциация электролиты и неэлектролиты Теория электролитической диссоциации
- •Механизм электролитической диссоциации ионных веществ
- •Механизм электролитической диссоциации полярных веществ
- •Электролиты и неэлектролиты
- •Сильные электролиты
- •Слабые электролиты
- •Неэлектролиты
- •Степень диссоциации. Константа диссоциации
- •Произведение растворимости Определение
- •Образование осадков
- •Влияние концентрации растворов
- •Влияние количества осадителя
- •Влияние одноименного иона
- •Влияние температуры
- •Растворение осадков
- •Лекция № 10. Ионные реакции. Гидролиз Ионные реакции в растворе
- •Правила составления ионных уравнений реакций
- •Порядок составления ионных уравнений реакции
- •Условия необратимости реакций ионного обмена
- •Растворимость солей, кислот и оснований в воде
- •Ионное произведение воды
- •PH раствора
- •Определение гидролиза
- •Отсутствие гидролиза в растворах
- •Гидролиз по катиону
- •1 Ступень:
- •2 Ступень:
- •3 Ступень:
- •Гидролиз по аниону
- •Гидролиз по катиону и аниону
- •Реакции обмена, сопровождаемые гидролизом
- •Количественные характеристики реакции гидролиза
- •Лекция № 11. Окислительно-восстановительные реакции Степень окисления
- •Расчет степени окисления
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •Классификация окислительно-восстановительных реакций Межмолекулярные окислительно-восстановительные реакции
- •Внутримолекулярные окислительно- восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Типичные реакции окисления-восстановления Реакции с участием перманганата калия в качестве окислителя
- •Реакции в кислой среде.
- •Реакции в нейтральной среде
- •Реакции в щелочной среде.
- •Реакции с дихроматом калия в качестве окислителя
- •Окислительные свойства азотной кислоты
- •Пероксид водорода в окислительно-восстановительных реакциях
- •Лекция № 12. Полимеры
Химическое равновесие
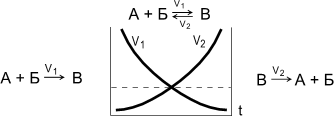
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
|
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
|
V1 |
|
A + Б |
|
В |
|
V2 |
|
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
|
V1 |
|
|
A + Б |
|
В |
; увеличение P приводит к V1 > V2 |
|
V2 |
|
|
2 |
|
1 |
|
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
|
V1 |
|
A + Б |
|
В + Q, то увеличение tC приводит к V2 > V1 |
|
V2 |
|
|
V1 |
|
A + Б |
|
В - Q, то увеличение tC приводит к V1 > V2 |
|
V2 |
|
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
4. Катализаторы не влияют на положение равновесия.
Лекция № 7. Растворы. Растворимость
Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов).
Размеры частиц в истинных растворах - менее 10-9 м (порядка размеров молекул).