
- •Оглавление
- •Введение
- •1. Основные понятия термодинамики
- •1.1. Термодинамическая система
- •1.2. Состояние и параметры состояния термодинамической системы
- •1.3. Термодинамическое состояние
- •1.4. Уравнение состояния идеального газа
- •1.5. Термодинамический процесс
- •1.6. Внутренняя энергия
- •2. Основные законы термодинамики
- •2.1. Первое начало (первый закон) термодинамики
- •2.2. Второе начало термодинамики
- •3. Дифференциальные уравнения термодинамики
- •4. Основные термодинамические процессы
- •4.1. Политропный процесс
- •4.2. Расчет политропных процессов идеального газа
- •4.3. Частные случаи политропных процессов
- •5. Термодинамика систем с переменным числом частиц
- •5.1. Уравнение Гиббса
- •5.2. Термодинамические потенциалы и характеристические функции
- •5.3. Химический потенциал и его свойства
- •5.4. Термодинамика фазовых переходов
- •5.4.1. Фазы и компоненты
- •5.4.2. Фазовые переходы I и II рода
- •5.4.3. Правило фаз Гиббса. Условия термодинамического равновесия однофазной и многофазных систем
- •5.4.4. Уравнение Клапейрона – Клаузиса
- •6. Реальные газы (водяной пар)
- •6.1. Термодинамические свойства водяного пара
- •6.2. Процессы водяного пара
- •6.3. Диаграмма
- •7. Термодинамика потока
- •7.1. Основные законы для потока
- •7.1.1. Первое и второе начала термодинамики для потока
- •7.1.2. Массовый расход. Уравнение неразрывности
- •7.2. Сопло и диффузор
- •7.3. Скорость истечения и расход в адиабатически изолированных каналах без трения
- •7.4. Закон обращения геометрического воздействия
- •7.5. Дросселирование газов и паров
- •Список литературы
- •Дополнительная литература
- •Методические разработки
- •Часть 1 Основные законы и процессы термодинамики
4.2. Расчет политропных процессов идеального газа
Расчет термодинамических процессов включает
вычисление термодинамических параметров
 системы в начальном и конечном состояниях;
системы в начальном и конечном состояниях;вычисление количеств работы изменения объема
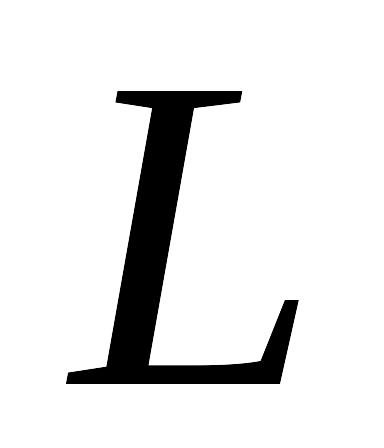 ,
полезной внешней работы
,
полезной внешней работы
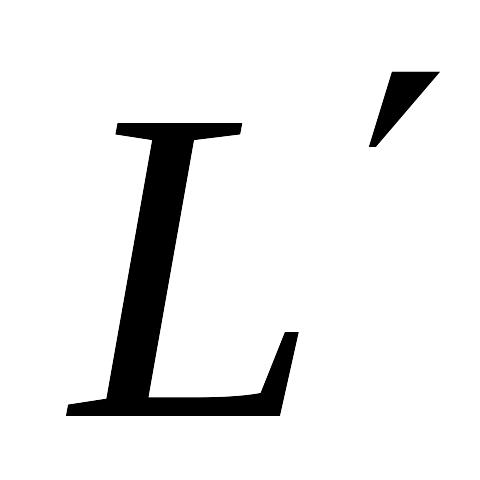 и теплоты
и теплоты
 в процессе;
в процессе;вычисление изменения внутренней энергии
 ,
энтальпии
,
энтальпии
 и энтропии
и энтропии
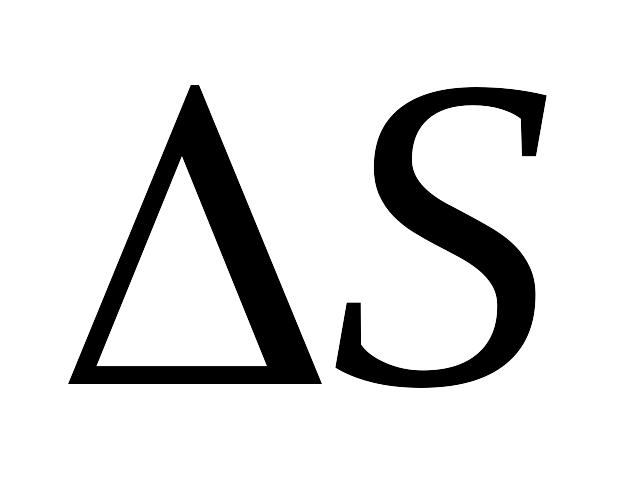 в процессе;
в процессе;графическое изображение процесса в термодинамических диаграммах
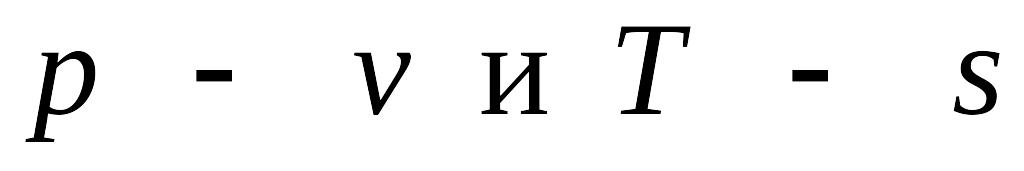 .
.
Из уравнения политропного процесса и состояния идеального газа можно получить соотношения между параметрами в политропном процессе:
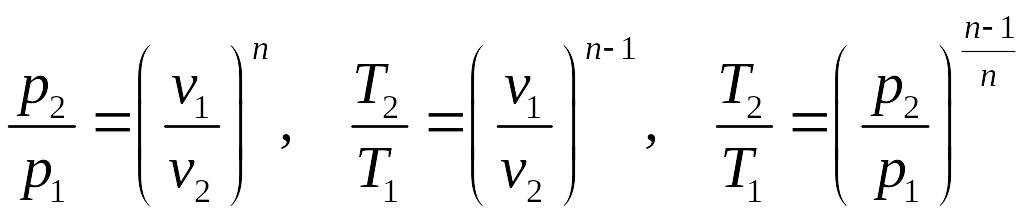 .
.
Количество теплоты в политропном процессе
![]() .
.
Работа изменения объема в политропном процессе может быть найдена интегрированием выражения для работы:
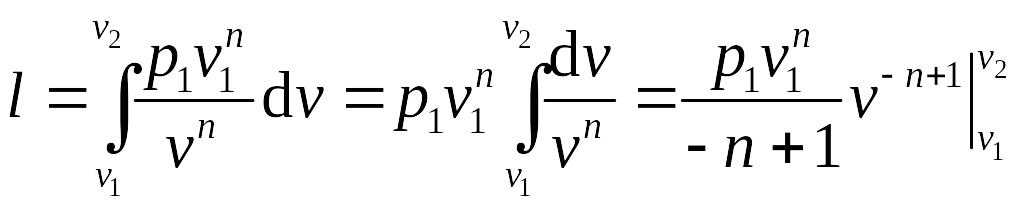 .
.
использование соотношений между параметрами в политропном процессе позволяет записать выражение для удельной работы изменения объема в трех эквивалентных формах:
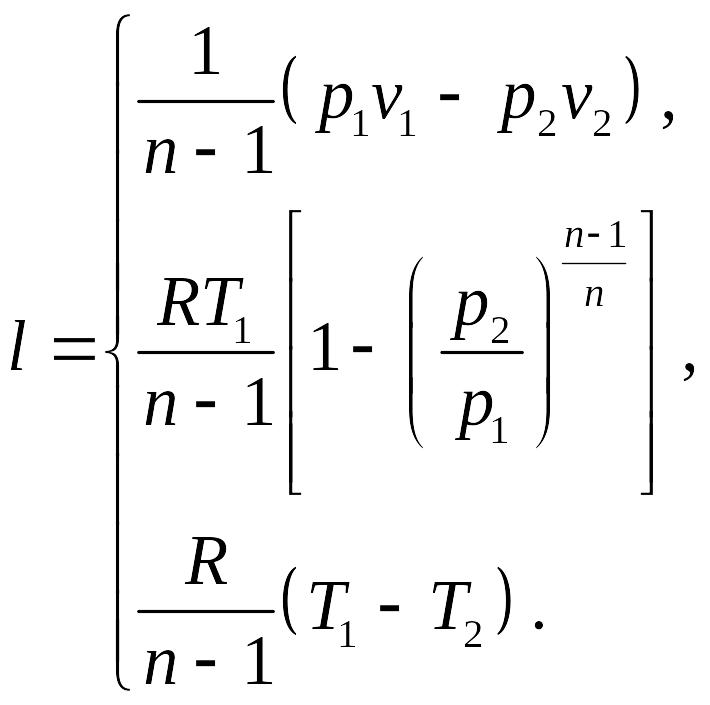
Полезная внешняя работа также может быть вычислена, приняв во внимание тот факт, что
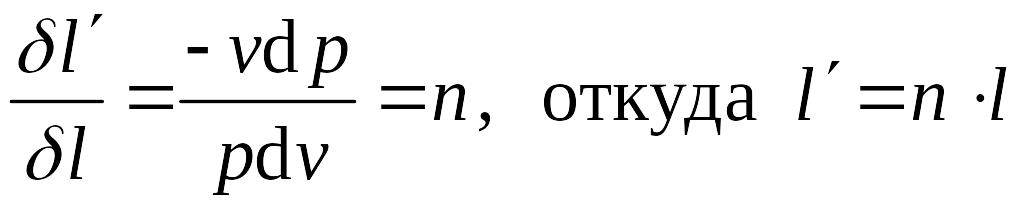 .
.
Лекция 8
4.3. Частные случаи политропных процессов
Как следует из определения показателя политропы, он может принимать значения от –∞ до +∞. Чаще всего на практике имеют дело с четырьмя частными случаями политропных процессов.
Изохорный процесс
По определению изохорным (изохорическим) процессом называется процесс, в течение которого поддерживается постоянным объем системы, т.е. уравнение изохорного процесса можно записать в виде
![]() .
.
Показатель политропы для изохорного процесса может быть найден из уравнения политропного процесса:
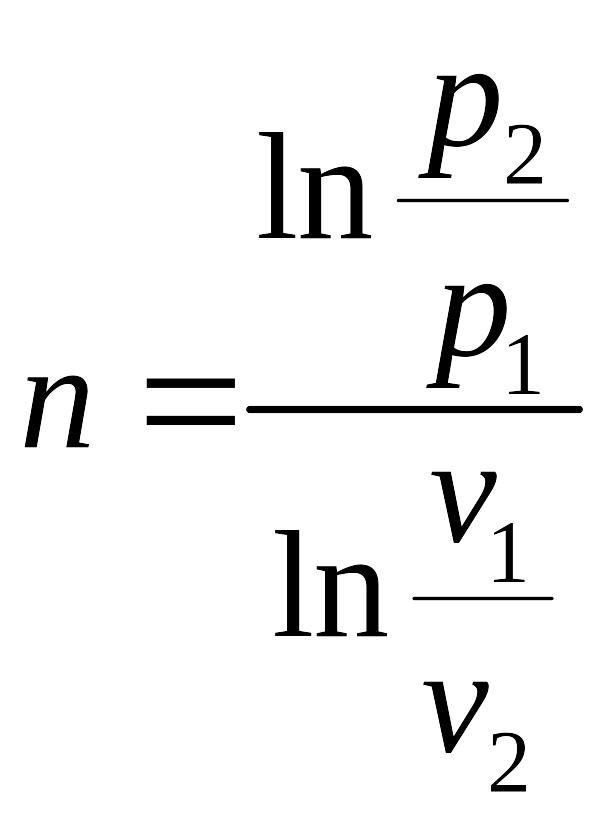 ,
, ![]() .
.
Тогда термодинамический расчет изохорного процесса сведется к использованию формул для политропного процесса, в которых :
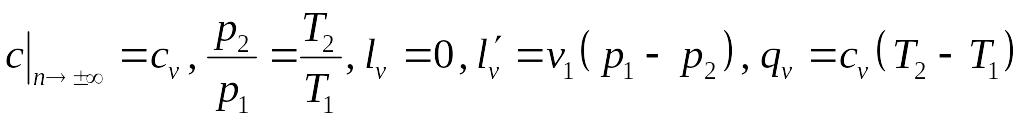 .
.
И зображение
изохорного процесса в термодинамических
диаграммах показано на рис.3.1.
зображение
изохорного процесса в термодинамических
диаграммах показано на рис.3.1.
Изобарный процесс
Изобарным (изобарическим)
называется процесс при постоянном
давлении, т.е.
![]() .
Показатель политропы изобарного
процесса:
.
Показатель политропы изобарного
процесса:
![]() .
Тогда, полагая во всех формулах для
политропного процесса
,
получаем
.
Тогда, полагая во всех формулах для
политропного процесса
,
получаем
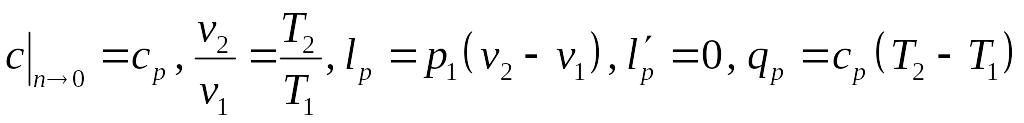
 .
.
На рис.3.2 изображен изобарный процесс в термодинамических диаграммах.
На диаграмме пунктиром показан также изохорный процесс, который изображается экспоненциальной кривой бόльшей крутизны, что следует из сравнения производных
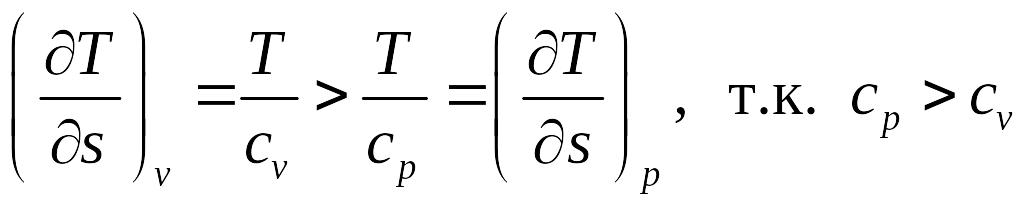 .
.
Изотермический процесс
Изотермическим называется
процесс, в котором поддерживается
постоянной температура системы:
![]() .
.
Показатель политропы изотермического процесса для идеального газа будет равен 1, n = 1.
Теплоемкость изотермического
процесса оказывается равной бесконечности,
что приводит к неопределенности типа
![]() при вычислении количества теплоты в
изотермическом процессе по стандартной
формуле, которая устраняется при
использовании I закона
термодинамики:
при вычислении количества теплоты в
изотермическом процессе по стандартной
формуле, которая устраняется при
использовании I закона
термодинамики:
![]() ,
,
откуда для изотермического процесса идеального газа
![]() .
.
Работа изменения объема в изотермическом процессе (или полезная внешняя работа) может быть вычислена по определению работы, в котором давление выражено через удельный объем из уравнения состояния идеального газа:
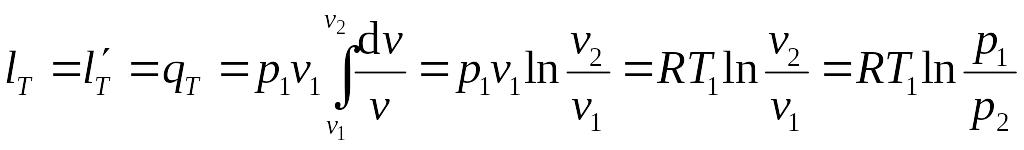 .
.
Изменение энтропии в изотермическом процессе находится из определения:
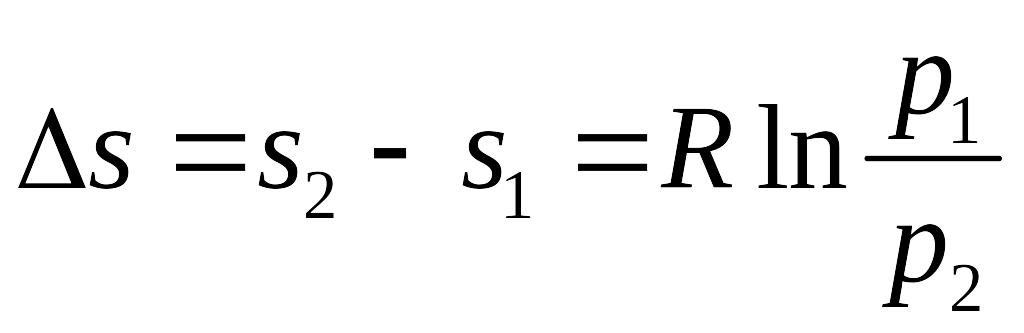 .
.
В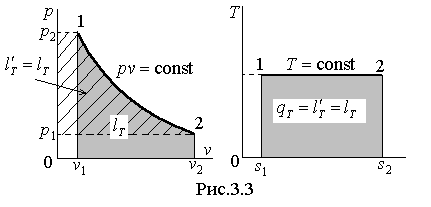 координатах p – v
изотермический процесс изображается
равнобочной гиперболой, а в T
– s – горизонтальной
прямой T=const
(рис.3.3).
координатах p – v
изотермический процесс изображается
равнобочной гиперболой, а в T
– s – горизонтальной
прямой T=const
(рис.3.3).
Адиабатический процесс
По определению адиабатическим
(адиабатным) процессом называется
процесс без теплообмена, т.е.
![]() .
Тогда теплоемкость адиабатного процесса
равна нулю (сад=0) и в обратимом
адиабатическом процессе остается
постоянной энтропия, т.е. уравнение
адиабатического процесса может быть
записано в виде
.
Тогда теплоемкость адиабатного процесса
равна нулю (сад=0) и в обратимом
адиабатическом процессе остается
постоянной энтропия, т.е. уравнение
адиабатического процесса может быть
записано в виде
![]() .
.
Из определения теплоемкости политропного процесса находим значение показателя политропы для адиабатического процесса:
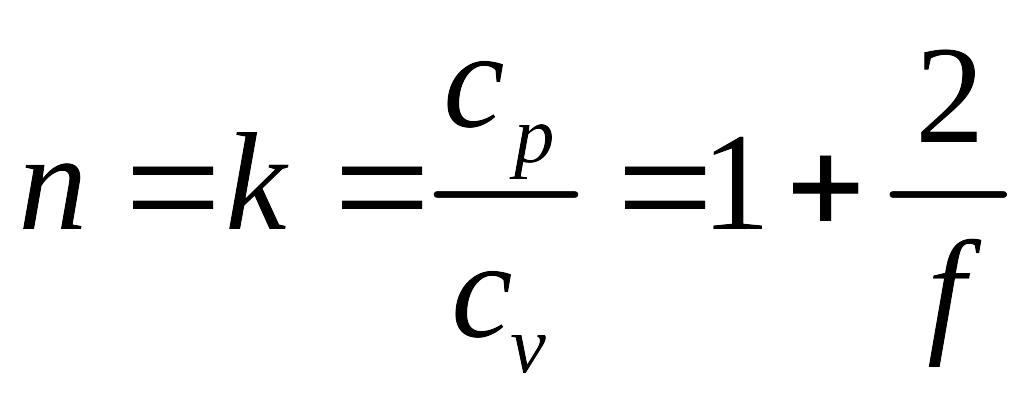 .
.
В переменных (p,v) уравнение адиабатного процесса имеет вид
![]() .
.
Работа в адиабатном процессе, как следует из I начала термодинамики, осуществляется за счет уменьшения внутренней энергии системы и вычисляется по формулам для работы политропного процесса с заменой n→k:
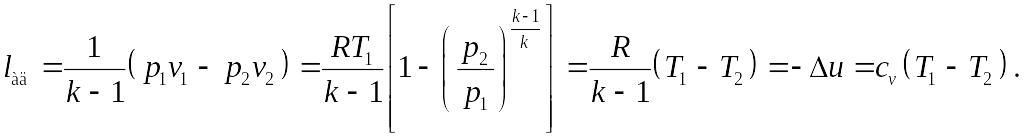
Полезная внешняя работа адиабатического процесса в k раз больше работы изменения объема и совершается за счет уменьшения энтальпии системы:
![]() .
.
И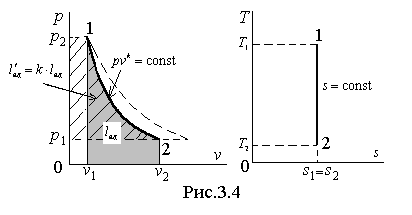 зображение
обратимого адиабатического процесса
в термодинамических диаграммах показано
на рис.3.4.
зображение
обратимого адиабатического процесса
в термодинамических диаграммах показано
на рис.3.4.
Пунктирной линией на диаграмме p – v показан изотермический процесс, который изображается более пологой, чем адиабата кривой. В самом деле, сравнивая производные от давления по объему для адиабаты и изотермы, получаем
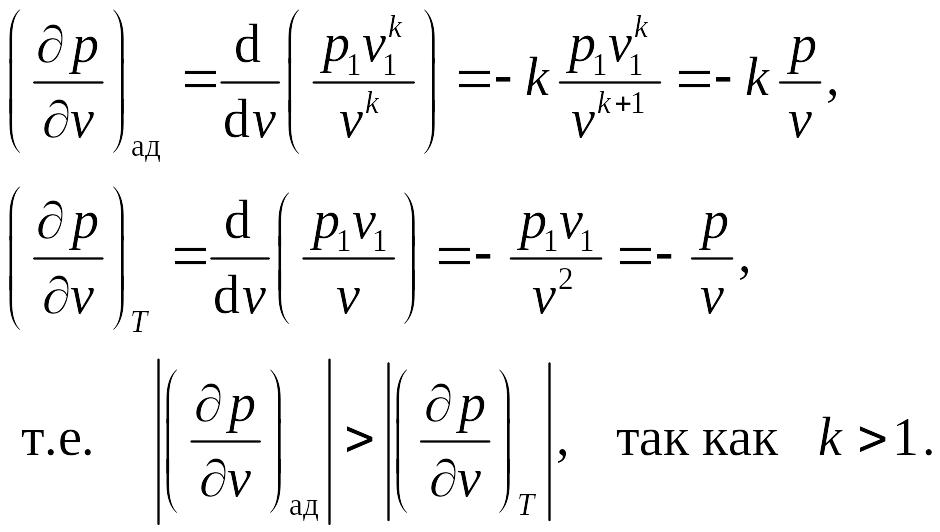
Обобщающее значение политропного процесса
Изобразим в диаграммах
рассмотренные выше четыре частных
процесса (рис.3.5), проходящих через
какое-либо одно состояние. Все они
описываются одной степенной функцией
вида
![]() ,
где показатель политропы n
и вместе с ним теплоемкость процесса c
принимают конкретные значения, которые
приведены в табл.1.
,
где показатель политропы n
и вместе с ним теплоемкость процесса c
принимают конкретные значения, которые
приведены в табл.1.
Таблица1
Характеристики политропного процесса
Процесс |
Уравнение процесса |
Показатель политропы |
Теплоемкость процесса |
Изохорный |
v=const |
n=±∞ |
c=cv |
Изобарный |
p=const |
n=0 |
c=cp |
Изотермичский |
T=const |
n=1 |
c=±∞ |
Адиабатичский |
q=0 или s=const |
n=k |
c=0 |
В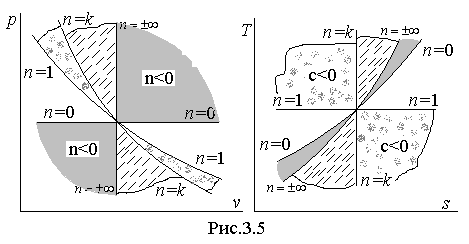 затененных секторах показатель политропы
n принимает отрицательные
значения.
затененных секторах показатель политропы
n принимает отрицательные
значения.
Лекция 9
