
- •Оглавление
- •Введение
- •1. Основные понятия термодинамики
- •1.1. Термодинамическая система
- •1.2. Состояние и параметры состояния термодинамической системы
- •1.3. Термодинамическое состояние
- •1.4. Уравнение состояния идеального газа
- •1.5. Термодинамический процесс
- •1.6. Внутренняя энергия
- •2. Основные законы термодинамики
- •2.1. Первое начало (первый закон) термодинамики
- •2.2. Второе начало термодинамики
- •3. Дифференциальные уравнения термодинамики
- •4. Основные термодинамические процессы
- •4.1. Политропный процесс
- •4.2. Расчет политропных процессов идеального газа
- •4.3. Частные случаи политропных процессов
- •5. Термодинамика систем с переменным числом частиц
- •5.1. Уравнение Гиббса
- •5.2. Термодинамические потенциалы и характеристические функции
- •5.3. Химический потенциал и его свойства
- •5.4. Термодинамика фазовых переходов
- •5.4.1. Фазы и компоненты
- •5.4.2. Фазовые переходы I и II рода
- •5.4.3. Правило фаз Гиббса. Условия термодинамического равновесия однофазной и многофазных систем
- •5.4.4. Уравнение Клапейрона – Клаузиса
- •6. Реальные газы (водяной пар)
- •6.1. Термодинамические свойства водяного пара
- •6.2. Процессы водяного пара
- •6.3. Диаграмма
- •7. Термодинамика потока
- •7.1. Основные законы для потока
- •7.1.1. Первое и второе начала термодинамики для потока
- •7.1.2. Массовый расход. Уравнение неразрывности
- •7.2. Сопло и диффузор
- •7.3. Скорость истечения и расход в адиабатически изолированных каналах без трения
- •7.4. Закон обращения геометрического воздействия
- •7.5. Дросселирование газов и паров
- •Список литературы
- •Дополнительная литература
- •Методические разработки
- •Часть 1 Основные законы и процессы термодинамики
1.6. Внутренняя энергия
Любая термодинамическая система обладает энергией, которая называется внутренней энергией U. Внутренняя энергия тела складывается из всех видов энергий всех частиц, составляющих систему.
Для идеального газа единственной формой энергии частиц может быть только их кинетическая энергия поступательного движения.
1.7. Работа и теплота
Закрытая система может обмениваться со средой энергиями в форме работы и теплоты. Работа это макроскопическая форма обмена энергией между системой и средой. В термодинамике количество работы обозначают буквой L и вычисляют как скалярное произведение силы на перемещение.
Б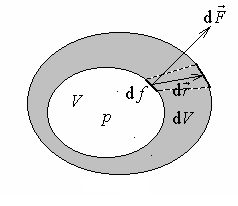 есконечно
малое количество работы, совершаемое
при перемещении элемента поверхности
оболочки
есконечно
малое количество работы, совершаемое
при перемещении элемента поверхности
оболочки
![]() на расстояние
на расстояние
![]() (рис.1.1)
равно
(рис.1.1)
равно![]() .
.
Рис.1.1. Вычисление работы
Сила, действующая со стороны термодинамической системы на элементарную площадку оболочки, пропорциональна величине этой площадки:
![]() .
.
Интегрирование по всей замкнутой поверхности оболочки дает
![]() или
или ![]() .
.
Количество работы системы при изменении ее объема от V1 до V2 вычисляется интегрированием:
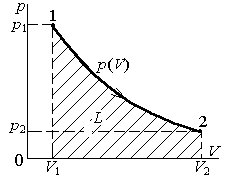
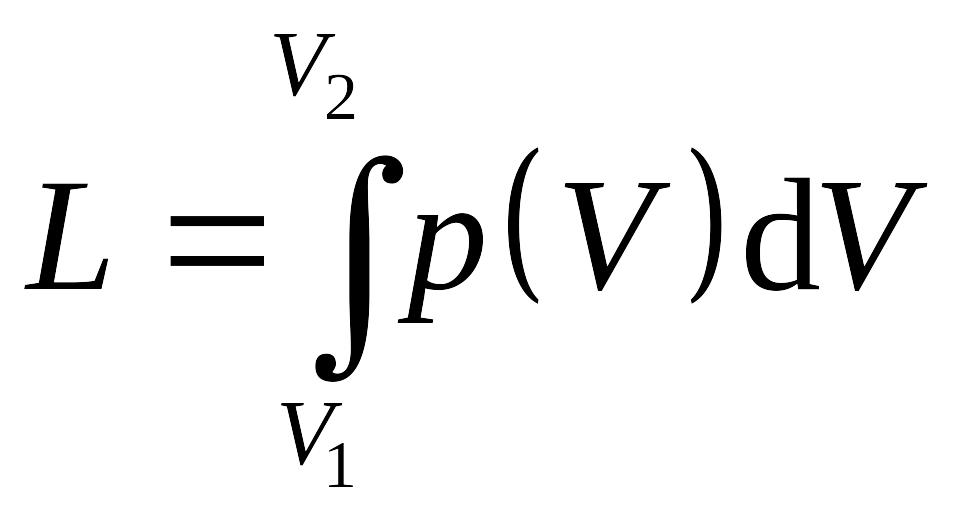 .
.
Отнесенное к единице массы системы количество работы называется удельным количеством работы,
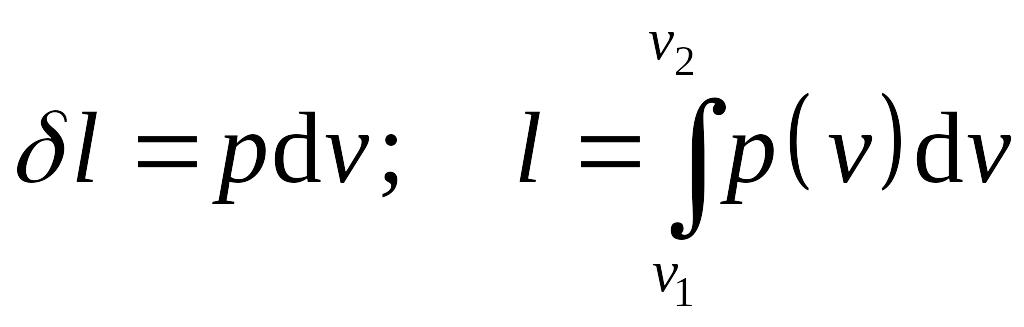 .
.
Рис.1.2. Графическое изображение
количества работы.
Количеству работы соответствует площадь под кривой p(v) в системе прямоугольных координат (p – v), что следует из геометрического смысла определенного интеграла (рис.1.2).
Теплота – это микроскопическая форма обмена энергией между системой и средой, приводящая к изменению состояния системы.
Количество теплоты можно определить как величину, пропорциональную изменению температуры системы:
![]() .
.
Величина C (с размерностью Дж/К) называется теплоемкостью.
Теплоемкость
Теплоемкость
C может принимать
самые различные значения от
![]() в зависимости от процесса подвода или
отвода теплоты. В общем случае теплоемкость
термодинамической системы C
зависит от количества вещества,
составляющего систему; физических
свойств вещества; температуры; давления
и процесса. Теплоемкость, отнесенная к
единице количества вещества системы,
носит название удельной теплоемкости.
В зависимости от способа определения
количества вещества используют различные
удельные теплоемкости:
в зависимости от процесса подвода или
отвода теплоты. В общем случае теплоемкость
термодинамической системы C
зависит от количества вещества,
составляющего систему; физических
свойств вещества; температуры; давления
и процесса. Теплоемкость, отнесенная к
единице количества вещества системы,
носит название удельной теплоемкости.
В зависимости от способа определения
количества вещества используют различные
удельные теплоемкости:
массовая
теплоемкость,
![]() ;
объемная теплоемкость
;
объемная теплоемкость
![]() ,
,
мольная теплоемкость
![]() .
.
Эти теплоемкости связаны соотношением
![]() .
.
Количество теплоты, отнесенное к единице массы системы, называется удельным количеством теплоты:
![]() .
.
Рассматриваемые выше теплоемкости представляет собой среднюю теплоемкость в интервале температур ΔT = T2 - T1. При учете зависимости теплoемкости от температуры ее следует определять как отношение бесконечно малого количества теплоты к бесконечно малому изменению температуры:
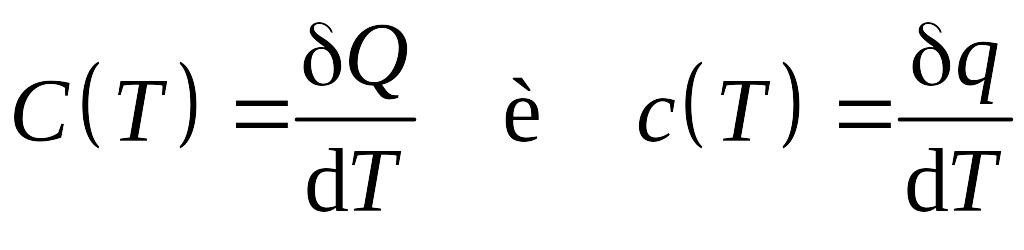 .
.
Определенные таким образом теплоемкости называются истинными при данной температуре, тогда количество теплоты
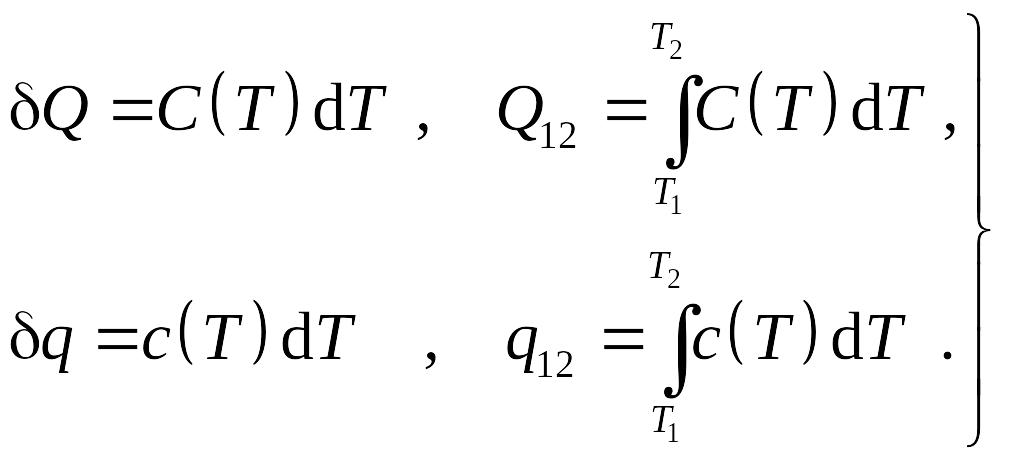
Для удобства в инженерных расчетах выражение для количества теплоты обычно записывается в более простой форме:
![]()
где
![]() – средняя удельная теплоемкость в
интервале температур (
– средняя удельная теплоемкость в
интервале температур (![]() ),
определяемая по теореме о среднем как
),
определяемая по теореме о среднем как
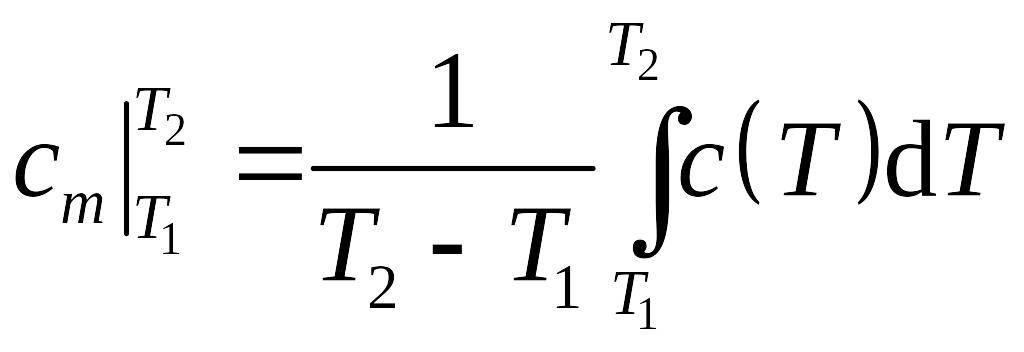 .
.
Классическая теория теплоемкости
Как известно из статистической
физики, энергия ситстемы равнораспределена
по степеням свободы (возможным движениям
тела) и на каждую степень свободы молекулы
приходится одинаковая энергия, равная
![]() ,
где
,
где
![]() постоянная
Больцмана. Тогда внутренняя энергия
идеального газа равна
постоянная
Больцмана. Тогда внутренняя энергия
идеального газа равна
![]() .
.
где f – количество степеней свободы.
Количество молекул N можно вычислить как произведение числа Авогадро NA на число киломолей ν газа, которое определяется делением массы газа M на молярную массу газа μ. Таким образом,
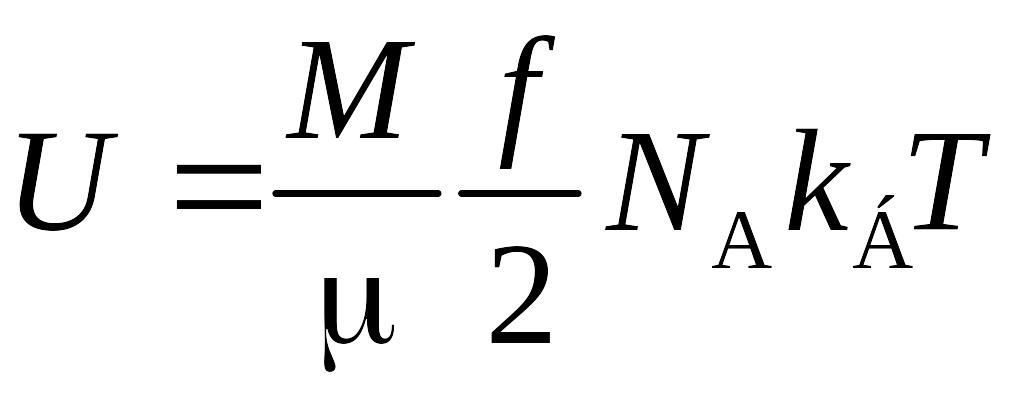 .
.
Учитывая, что
![]() ,
получим
,
получим
![]() .
.
Теплоемкости при постоянном объеме и при постоянном давлении для идеального газа
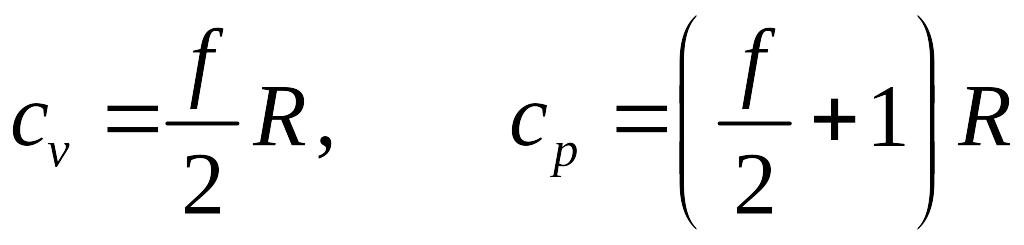 .
.
Формула для cp получена с учетом известной формулы Майера
![]() .
.
Отношение теплоемкостей равно
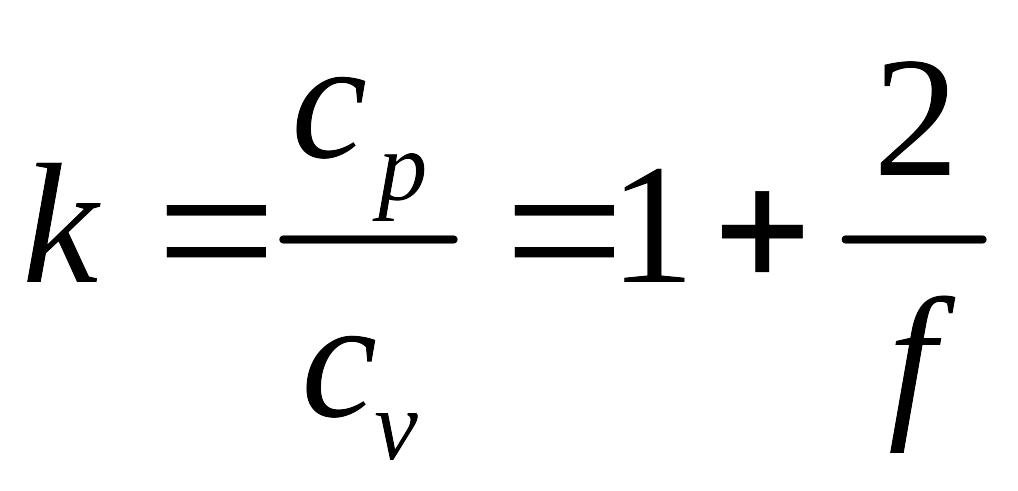 .
.
Вычисленные по этим формулам значения теплоемкостей для различных газов сравнительно хорошо совпадают с экспериментально измеренными их значениями в области комнатных температур. Расхождение с экспериментом становится существенным при повышении температуры.
Главной причиной расхождения теории с экспериментом является то, что при получении выражения для внутренней энергии газов не принимались во внимание квантовые эффекты, учет которых приводит к тому, что число вращательных и колебательных степеней свободы молекул перестает быть постоянной величиной, а зависит от энергии столкновения молекул, т.е., от температуры. Кроме того, с увеличением температуры многоатомные молекулы частично диссоциируют и химический состав газа может заметно измениться.
Лекция 4
