
- •1.Общая характеристика колебательных процессов
- •2. Дифференциальное уравнение гармонических колебаний
- •3. Колебания пружинного маятника
- •4. Колебания физического маятника
- •5. Вертикальные колебания центра тяжести судна
- •6. Энергия гармонического колебания
- •Сложение скалярных колебаний
- •8. Сложение гармонических колебаний с равными частотами
- •8.2 Сложение гармонических колебаний с близкими частотами. Биения
- •21.9. Сложение взаимно перпендикулярных (векторных) колебаний
- •Затухающие колебания
- •1. Вынужденные колебания
- •2. Вынужденные вертикальные колебания судна
- •3. Параметрический резонанс
- •4. Автоколебания
- •5. Спектр колебаний
- •. Ангармонические колебания
- •7. Фазовая траектория
- •Общая характеристика волновых процессов
- •22.2. Упругие волны
- •3. Энергетические характеристики волновых процессов
- •Акустика
- •1. Объективные и субъективные характеристики звука
- •2. Распространение звуковых волн
- •3. Ультразвук
- •4. Эффект Доплера в акустике
- •Статистическая теория газов
- •1. Средние характеристики движения молекул идеального газа
- •2. Распределение молекул по скоростям (распределение Максвелла)
- •3. Барометрическая формула
- •4. Распределение Больцмана
- •5. Средняя длина свободного пробега молекул
- •1. Общая характеристика явлений переноса
- •2. Молекулярно-кинетическая теория явлений переноса
- •8.6.3. Анализ коэффициентов переноса
- •1. Основные понятия термодинамики
- •Первое начало термодинамики и его применение к изопроцессам
- •9.3. Число степеней свободы. Внутренняя энергия идеального газа
- •1. Классическая теория теплопроводности газов
- •2. Адиабатный процесс
- •3. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •4. Идеальная тепловая машина Карно
- •1. Второе начало термодинамики
- •9.9. Энтропия
- •2. Статистический смысл второго начала термодинамики
- •4. Теорема Нернста (третье начало термодинамики)
- •5. Термодинамика необратимых процессов
- •10.1. Реальные газы
- •10.1.2. Модель реального газа по Ван-дер-Ваальсу
- •10.1.3. Опытные изотермы реальных газов
- •10.1.4. Теоретические изотермы реальных газов (изотермы Ван-дер-Ваальса)
- •10.1.5. Расчет критических параметров вещества из уравнения Ван-дер-Ваальса
- •10.2. Жидкое состояние
- •10.2.1. Общие представления. Характер теплового движения молекул жидкости
- •10.2.2. Поверхностные явления
- •10.3. Твердое тело
- •10.3.1. Общие представления о твердых телах
- •10.3.2. Теплоемкость твердых тел. Закон Дюлонга и Пти
- •10.4. Фазовые равновесия и фазовые переходы
- •10.4.1. Общие понятия
- •10.4.2. Фазовый переход первого рода. Уравнение Клапейрона-Клаузиуса
10.3. Твердое тело
10.3.1. Общие представления о твердых телах
В физике под твердыми телами подразумеваются только кристаллические тела, для которых характерно правильное периодическое расположение составляющих их частиц.
Аморфные тела, у которых такое правильное расположение частиц отсутствует, следует относить к очень вязким переохлажденным жидкостям.
Если правильное периодическое расположение частиц прослежено во всем объеме образца, последний называют монокристаллом. Монокристаллы анизотропны, т.е. их физические свойства зависят от направления в кристалле. В технике чаще встречаются поликристаллические образцы, состоящие из большого числа хаотически расположенных малых кристаллов.
Следствием закономерного расположения частиц в кристаллах является их внешняя форма, представляющая один из правильных многогранников. Для кристаллической формы справедлив закон постоянства двугранных углов: у различных кристаллов одного и того же вещества двугранные углы между гранями остаются постоянными независимо от величины и формы монокристаллов.
В зависимости от типа частиц различают кристаллы:
ионные, молекулярные, атомные и металлические. Структурными частицами этих кристаллов являются соответственно ионы, молекулы или атомы; у металлических кристаллов структурными частицами являются положительные ионы, а отрицательно заряженные электроны свободно движутся между ними.
10.3.2. Теплоемкость твердых тел. Закон Дюлонга и Пти
Частицы кристалла совершают колебательное движение около своих положений равновесия. Полная энергия колебательного движения частицы состоит из суммы кинетической и потенциальной энергий, т.е.
-
 .
.
В среднем для гармонических колебаний кинетическая энергия равна потенциальной, поэтому
-
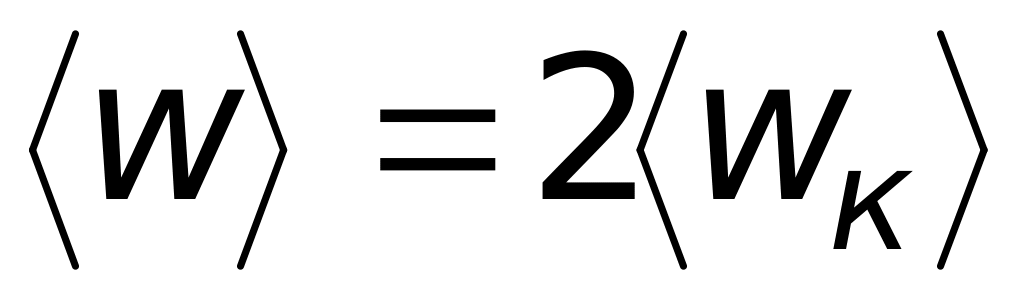 .
.
Атом имеет три степени свободы. Поскольку на одну степень свободы приходится энергия, равная (9.8), то средняя энергия колебаний атома
-
 .
.
В одном килограмм-атоме вещества находится число частиц, равное числу Авогадро. Поэтому внутренняя энергия 1 кг-атома химически простого твердого тела
-
 ,
,
а атомная теплоемкость
-
 .
.(10.11)
Последнее соотношение носит название закона Дюлонга и Пти: атомная теплоемкость химически простых кристаллических тел не зависит от их природы и равна 3R.
При не очень низких температурах этот закон хорошо выполняется.
10.4. Фазовые равновесия и фазовые переходы
10.4.1. Общие понятия
Фазой называют часть термодинамической системы, свойства которой постоянны во всем ее объеме и которая отделена поверхностью раздела от других частей термодинамической системы. При определённых условиях возможно превращение одних термодинамических фаз в другие, называемое фазовым переходом.
Различают фазовые переходы первого и второго рода. Фазовые переходы первого рода сопровождаются поглощением или выделением некоторого количества теплоты. При фазовом переходе первого рода скачкообразно изменяются такие параметры фазы, как ее плотность, вязкость и др. Примеры фазовых переходов первого рода – плавление и испарение.
Фазовые переходы второго рода происходят без затрат теплоты. Для них характерно скачкообразное изменение теплоемкости, коэффициента теплового расширения. Фазовые переходы второго рода связаны со скачкообразным изменением симметрии системы. Примерами фазовых переходов второго рода являются переход ферромагнетик - парамагнетик, переход металла из нормального в сверхпроводящее состояние и др.
