- •1.Общая характеристика колебательных процессов
- •2. Дифференциальное уравнение гармонических колебаний
- •3. Колебания пружинного маятника
- •4. Колебания физического маятника
- •5. Вертикальные колебания центра тяжести судна
- •6. Энергия гармонического колебания
- •Сложение скалярных колебаний
- •8. Сложение гармонических колебаний с равными частотами
- •8.2 Сложение гармонических колебаний с близкими частотами. Биения
- •21.9. Сложение взаимно перпендикулярных (векторных) колебаний
- •Затухающие колебания
- •1. Вынужденные колебания
- •2. Вынужденные вертикальные колебания судна
- •3. Параметрический резонанс
- •4. Автоколебания
- •5. Спектр колебаний
- •. Ангармонические колебания
- •7. Фазовая траектория
- •Общая характеристика волновых процессов
- •22.2. Упругие волны
- •3. Энергетические характеристики волновых процессов
- •Акустика
- •1. Объективные и субъективные характеристики звука
- •2. Распространение звуковых волн
- •3. Ультразвук
- •4. Эффект Доплера в акустике
- •Статистическая теория газов
- •1. Средние характеристики движения молекул идеального газа
- •2. Распределение молекул по скоростям (распределение Максвелла)
- •3. Барометрическая формула
- •4. Распределение Больцмана
- •5. Средняя длина свободного пробега молекул
- •1. Общая характеристика явлений переноса
- •2. Молекулярно-кинетическая теория явлений переноса
- •8.6.3. Анализ коэффициентов переноса
- •1. Основные понятия термодинамики
- •Первое начало термодинамики и его применение к изопроцессам
- •9.3. Число степеней свободы. Внутренняя энергия идеального газа
- •1. Классическая теория теплопроводности газов
- •2. Адиабатный процесс
- •3. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •4. Идеальная тепловая машина Карно
- •1. Второе начало термодинамики
- •9.9. Энтропия
- •2. Статистический смысл второго начала термодинамики
- •4. Теорема Нернста (третье начало термодинамики)
- •5. Термодинамика необратимых процессов
- •10.1. Реальные газы
- •10.1.2. Модель реального газа по Ван-дер-Ваальсу
- •10.1.3. Опытные изотермы реальных газов
- •10.1.4. Теоретические изотермы реальных газов (изотермы Ван-дер-Ваальса)
- •10.1.5. Расчет критических параметров вещества из уравнения Ван-дер-Ваальса
- •10.2. Жидкое состояние
- •10.2.1. Общие представления. Характер теплового движения молекул жидкости
- •10.2.2. Поверхностные явления
- •10.3. Твердое тело
- •10.3.1. Общие представления о твердых телах
- •10.3.2. Теплоемкость твердых тел. Закон Дюлонга и Пти
- •10.4. Фазовые равновесия и фазовые переходы
- •10.4.1. Общие понятия
- •10.4.2. Фазовый переход первого рода. Уравнение Клапейрона-Клаузиуса
10.1.4. Теоретические изотермы реальных газов (изотермы Ван-дер-Ваальса)
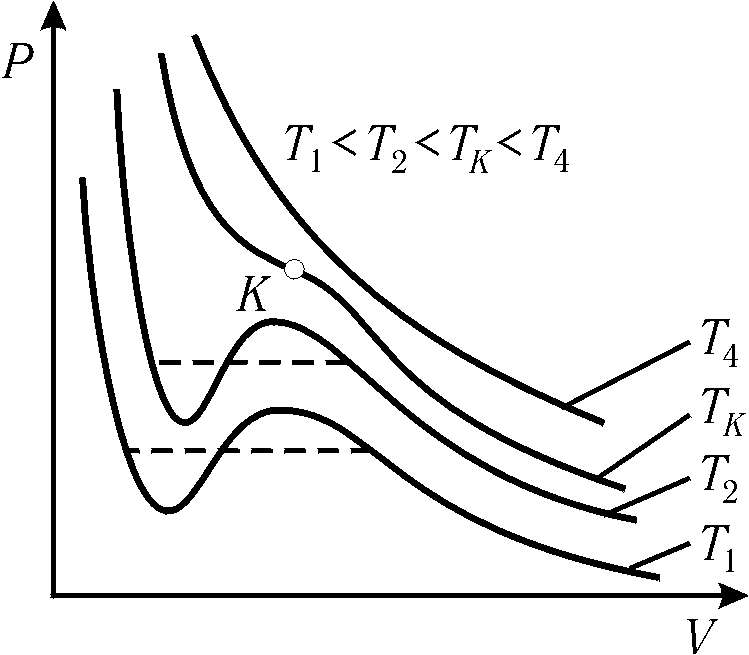
На рис. 10.6 показано семейство изотерм реального газа, рассчитанных по уравнению Ван-дер-Ваальса. В области высоких температур они достаточно близки к экспериментальным. При более низких температурах на теоретических изотермах появляется характерный "завиток", отражающий некоторые детали процессов сжижения газов и испарения жидкостей.
Рис. 10.6 |
Рис. 10.7 |
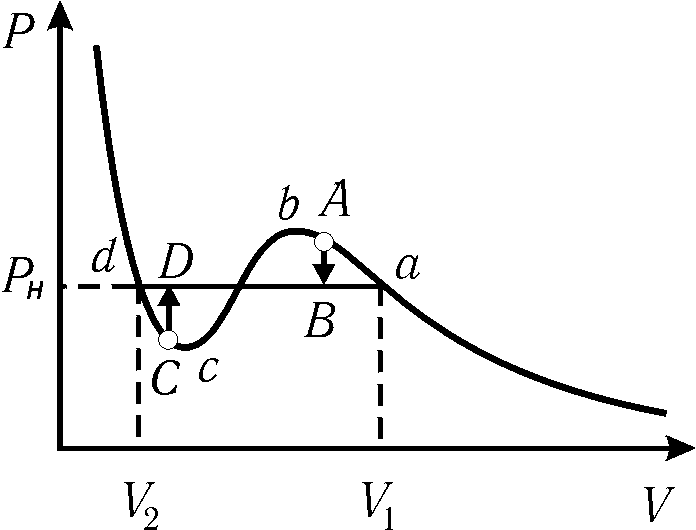
Рассмотрим подробнее этот участок.
При сжатии реального газа до объема V1 (рис. 10.7) обычно начинается его сжижение. Однако если газ очищен от примесей (пылинок, ионов и т.д.), которые могут являться центрами конденсации, он может оставаться в газовом состоянии при давлениях, более высоких по сравнению с давлением насыщенного пара – точка А на рис. 10.7. Такое состояние называется пересыщенным паром и является метастабильным (малоустойчивым) – при внесении в него центров конденсации сразу же происходит переход в более устойчивое двухфазное состояние (переход А В). Аналогичная картина наблюдается при переходе из жидкого состояния в двухфазное. Чистая жидкость, в которой отсутствуют центры парообразования, может переходить в растянутое (перегретое) малоустойчивое состояние – участок dc на рис. 10.7.
Участок cb изотермы Ван-дер-Ваальса, на котором увеличению давления соответствует увеличение объема, принципиально неустойчив и реализован быть не может.
Следует отметить, что оба метастабильных состояния вещества находят практическое применение при регистрации микрочастиц (камера Вильсона, пузырьковая камера).
10.1.5. Расчет критических параметров вещества из уравнения Ван-дер-Ваальса
На рис. 10.5 пунктиром показаны границы, разделяющие семейство изотерм Ван-дер-Ваальса на области газообразного (I), жидкого (II) и двухфазное состояние (III). Все эти области имеют общую точку К, которая является критической и совпадает с точкой перегиба критической изотермы.
Уравнения Ван-дер-Ваальса является уравнением третьей степени относительно объема и может быть представлено в виде
-
 .
.(10.3)
Как известно алгебраическое уравнение третьей степени имеет три корня, которые могут быть либо все действительными, либо один действительный, а два комплексно сопряженными. В критической точке уравнение Ван-дер-Ваальса имеет три действительных совпадающих корня, соответствующих значению критического объема VK. Пользуясь теоремой Виета, уравнение Ван-дер-Ваальса можно записать в виде
или
-

(10.4)
Сравнивая коэффициенты при различных степенях V в уравнениях (10.3) и (10.4), можно получить систему уравнений относительно критических параметров
Из этой системы следует
-
 .
.(10.5)
Результаты расчетов по формуле (10.5) достаточно близки к опытным значениям критических параметров.
Лекція 17.
10.2. Жидкое состояние
10.2.1. Общие представления. Характер теплового движения молекул жидкости
Согласно представлениям, изложенным в предыдущем параграфе, жидкое состояние по своим свойствам близко к газообразному, отличаясь от него в первую очередь большей плотностью, т.е. меньшим межмолекулярным расстоянием. Однако такие представления не совсем точны, поскольку жидкое состояние существенно ближе к твердому (кристаллическому) состоянию. Об этом свидетельствует следующее:
плотность жидкости и ее теплоемкость близки к соответствующим значениям для твердых тел;
теплота испарения значительно выше теплоты плавления;
экспериментально показано существование в жидкости определенного порядка в расположении молекул, сходного по ряду параметров с упорядоченностью, характерной для твердых тел.
Для жидкостей глубина потенциальной ямы межмолекулярного взаимодействия (см. рис. 10.1) сравнима с энергией хаотического теплового движения (kT), что обусловливает колебательно-поступательный характер теплового движения молекул жидкости. Находясь в некотором равновесном положении, молекула жидкости колеблется с частотой 1013 Гц. За время жизни в положении равновесия 10‑8 c (время "оседлости") молекула успевает совершить в среднем 105 колебаний, а затем переходит в новое положение равновесия. С повышением температуры растет средняя кинетическая энергия молекул и, кроме того, вследствие расширения жидкости в ней растет число пустых мест (вакансий). Эти факторы облегчают переход молекулы из одного положения равновесия в другое.
Время "оседлой" жизни молекул зависит от температуры
-
 ,
,
где W – энергия, необходимая для перехода молекулы из одного равновесного положения в другое (энергия активации).
Такой характер теплового движения молекул жидкости определяет их механические свойства. При кратковременных воздействиях (t < ) жидкости ведут себя как хрупкие твердые тела. Такой случай реализуется при прохождении через жидкость упругих ультразвуковых волн. При более длительных воздействиях жидкости текут и в них создаются силы сопротивления истечению – силы вязкости (внутреннего трения).