
- •1.Общая характеристика колебательных процессов
- •2. Дифференциальное уравнение гармонических колебаний
- •3. Колебания пружинного маятника
- •4. Колебания физического маятника
- •5. Вертикальные колебания центра тяжести судна
- •6. Энергия гармонического колебания
- •Сложение скалярных колебаний
- •8. Сложение гармонических колебаний с равными частотами
- •8.2 Сложение гармонических колебаний с близкими частотами. Биения
- •21.9. Сложение взаимно перпендикулярных (векторных) колебаний
- •Затухающие колебания
- •1. Вынужденные колебания
- •2. Вынужденные вертикальные колебания судна
- •3. Параметрический резонанс
- •4. Автоколебания
- •5. Спектр колебаний
- •. Ангармонические колебания
- •7. Фазовая траектория
- •Общая характеристика волновых процессов
- •22.2. Упругие волны
- •3. Энергетические характеристики волновых процессов
- •Акустика
- •1. Объективные и субъективные характеристики звука
- •2. Распространение звуковых волн
- •3. Ультразвук
- •4. Эффект Доплера в акустике
- •Статистическая теория газов
- •1. Средние характеристики движения молекул идеального газа
- •2. Распределение молекул по скоростям (распределение Максвелла)
- •3. Барометрическая формула
- •4. Распределение Больцмана
- •5. Средняя длина свободного пробега молекул
- •1. Общая характеристика явлений переноса
- •2. Молекулярно-кинетическая теория явлений переноса
- •8.6.3. Анализ коэффициентов переноса
- •1. Основные понятия термодинамики
- •Первое начало термодинамики и его применение к изопроцессам
- •9.3. Число степеней свободы. Внутренняя энергия идеального газа
- •1. Классическая теория теплопроводности газов
- •2. Адиабатный процесс
- •3. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •4. Идеальная тепловая машина Карно
- •1. Второе начало термодинамики
- •9.9. Энтропия
- •2. Статистический смысл второго начала термодинамики
- •4. Теорема Нернста (третье начало термодинамики)
- •5. Термодинамика необратимых процессов
- •10.1. Реальные газы
- •10.1.2. Модель реального газа по Ван-дер-Ваальсу
- •10.1.3. Опытные изотермы реальных газов
- •10.1.4. Теоретические изотермы реальных газов (изотермы Ван-дер-Ваальса)
- •10.1.5. Расчет критических параметров вещества из уравнения Ван-дер-Ваальса
- •10.2. Жидкое состояние
- •10.2.1. Общие представления. Характер теплового движения молекул жидкости
- •10.2.2. Поверхностные явления
- •10.3. Твердое тело
- •10.3.1. Общие представления о твердых телах
- •10.3.2. Теплоемкость твердых тел. Закон Дюлонга и Пти
- •10.4. Фазовые равновесия и фазовые переходы
- •10.4.1. Общие понятия
- •10.4.2. Фазовый переход первого рода. Уравнение Клапейрона-Клаузиуса
2. Статистический смысл второго начала термодинамики
Для того чтобы глубже уяснить суть второго начала термодинамики, обратимся к представлениям статистической физики.
Термодинамическая система может находиться в различных микросостояниях, которым соответствуют различные распределения молекул по скоростям, энергиям, координатам и т.д. Одному и тому же макросостоянию системы, находящейся в термодинамическом равновесии, вообще говоря, соответствует множество микросостояний. Термодинамически равновесная система может самопроизвольно переходить из одного микросостояния в другое, однако макроскопическое состояние, характеризуемое параметрами P, V, T и т. д., при этом не меняется
Пусть
в течение некоторого достаточно
длительного промежутка времени наблюдения
за системой i-е
микроскопическое состояние реализовывалось
Ni
раз. Тогда вероятность i-го
микросостояния определяется как
соотношение
![]() ,
где N –
общее число микросостояний, которое
реализовалось за время наблюдения.
,
где N –
общее число микросостояний, которое
реализовалось за время наблюдения.
Рис. 9.11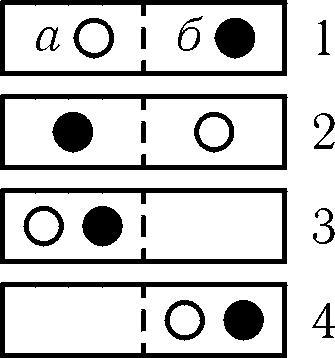
![]() каждого из них. Микросостояния 1 и 2
соответствуют равномерному распределению
газа по всему объему и являются
эквивалентными. Следовательно, вероятность
состояния, в котором газ равномерно
распределен по всему объему
каждого из них. Микросостояния 1 и 2
соответствуют равномерному распределению
газа по всему объему и являются
эквивалентными. Следовательно, вероятность
состояния, в котором газ равномерно
распределен по всему объему
![]() ,
т.е. равна вероятности отдельного
распределения на число способов, которыми
может быть осуществлено это распределение.
,
т.е. равна вероятности отдельного
распределения на число способов, которыми
может быть осуществлено это распределение.
Число способов, с помощью которых реализуется данное состояние системы, называется термодинамической вероятностью состояния. Таким образом, в рассматриваемом примере термодинамическая вероятность состояния, в котором газ равномерно распределен по всему объему, равна двум.
По мере увеличения числа молекул термодинамическая вероятность их равномерного распределения по всему объему быстро возрастает. Так, для газа, состоящего из четырех молекул a, b. c, d, возможны шесть эквивалентных микросостояний, в которых газ равномерно распределен по всему объему сосуда. Это состояния ab - cd, ac - bd, ad - bc, bc - ad, bd - ac, cd ‑ ab. Для газа, состоящего из шести молекул, термодинамическая вероятность состояния, в котором газ равномерно заполняет весь объем, возрастает до 20 и т.д. В то же время, независимо от числа молекул, термодинамическая вероятность состояния, в котором газ занимает одну из половинок сосуда, остается постоянной и равной двум.
Проделаем теперь следующий мысленный эксперимент: пусть в исходном состоянии газ находится в одной из половинок сосуда, отделённой от другой половинки непроницаемой перегородкой. Такое состояние газа характеризуется термодинамической вероятностью Р1=2. Уберём теперь перегородку. Спустя некоторое время мы обнаружим, что газ более или менее равномерно распределён по всему объёму сосуда (рис. 9.12). Такое состояние газа характеризуется термодинамической вероятностью Р2>Р1. Таким образом, в системе произошёл процесс в сторону возрастания термодинамической вероятности состояния. Обратный процесс маловероятен, поскольку из огромного числа различных способов размещения молекул лишь два из них соответствуют состоянию, когда газ самопроизвольно соберётся в одной половине сосуда.
Рис. 9.12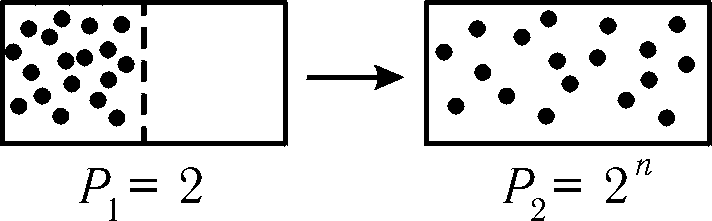
Обратимым называется такой процесс, в котором начальное и конечное состояния характеризуются одинаковым значением термодинамической вероятности. Вероятность протекания обратимого процесса в прямом и обратном направлениях одинакова.
Необратимым называется такой процесс, обратный которому маловероятен.
С помощью понятия термодинамической вероятности состояния можно переформулировать второе начало термодинамики следующим образом: все процессы в изолированной системе могут протекать в таких направлениях, когда термодинамическая вероятность состояния не убывает.
Аналогичным образом ведёт себя энтропия, поэтому между термодинамической вероятностью состояния и энтропией должна быть связь. Эта связь была установлена Больцманом (1872 г.) и имеет вид:
-
 ,
,(9.48)
где k – постоянная Больцмана.
Согласно формуле Больцмана можно дать определение энтропии как меры вероятности осуществления какого-либо макросостояния.
