
- •1.Общая характеристика колебательных процессов
- •2. Дифференциальное уравнение гармонических колебаний
- •3. Колебания пружинного маятника
- •4. Колебания физического маятника
- •5. Вертикальные колебания центра тяжести судна
- •6. Энергия гармонического колебания
- •Сложение скалярных колебаний
- •8. Сложение гармонических колебаний с равными частотами
- •8.2 Сложение гармонических колебаний с близкими частотами. Биения
- •21.9. Сложение взаимно перпендикулярных (векторных) колебаний
- •Затухающие колебания
- •1. Вынужденные колебания
- •2. Вынужденные вертикальные колебания судна
- •3. Параметрический резонанс
- •4. Автоколебания
- •5. Спектр колебаний
- •. Ангармонические колебания
- •7. Фазовая траектория
- •Общая характеристика волновых процессов
- •22.2. Упругие волны
- •3. Энергетические характеристики волновых процессов
- •Акустика
- •1. Объективные и субъективные характеристики звука
- •2. Распространение звуковых волн
- •3. Ультразвук
- •4. Эффект Доплера в акустике
- •Статистическая теория газов
- •1. Средние характеристики движения молекул идеального газа
- •2. Распределение молекул по скоростям (распределение Максвелла)
- •3. Барометрическая формула
- •4. Распределение Больцмана
- •5. Средняя длина свободного пробега молекул
- •1. Общая характеристика явлений переноса
- •2. Молекулярно-кинетическая теория явлений переноса
- •8.6.3. Анализ коэффициентов переноса
- •1. Основные понятия термодинамики
- •Первое начало термодинамики и его применение к изопроцессам
- •9.3. Число степеней свободы. Внутренняя энергия идеального газа
- •1. Классическая теория теплопроводности газов
- •2. Адиабатный процесс
- •3. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •4. Идеальная тепловая машина Карно
- •1. Второе начало термодинамики
- •9.9. Энтропия
- •2. Статистический смысл второго начала термодинамики
- •4. Теорема Нернста (третье начало термодинамики)
- •5. Термодинамика необратимых процессов
- •10.1. Реальные газы
- •10.1.2. Модель реального газа по Ван-дер-Ваальсу
- •10.1.3. Опытные изотермы реальных газов
- •10.1.4. Теоретические изотермы реальных газов (изотермы Ван-дер-Ваальса)
- •10.1.5. Расчет критических параметров вещества из уравнения Ван-дер-Ваальса
- •10.2. Жидкое состояние
- •10.2.1. Общие представления. Характер теплового движения молекул жидкости
- •10.2.2. Поверхностные явления
- •10.3. Твердое тело
- •10.3.1. Общие представления о твердых телах
- •10.3.2. Теплоемкость твердых тел. Закон Дюлонга и Пти
- •10.4. Фазовые равновесия и фазовые переходы
- •10.4.1. Общие понятия
- •10.4.2. Фазовый переход первого рода. Уравнение Клапейрона-Клаузиуса
Первое начало термодинамики и его применение к изопроцессам
Первое начало термодинамики – это обобщение закона сохранения энергии с учетом тепловых процессов. Его формулировка: количество теплоты, сообщенное системе, расходуется на выполнение работы против внешних сил и изменение ее внутренней энергии:
-
 .
.(9.3)
Первому
началу термодинамики можно дать другую
формулировку, если учесть, что
![]() ,
т.е.
,
т.е.
-
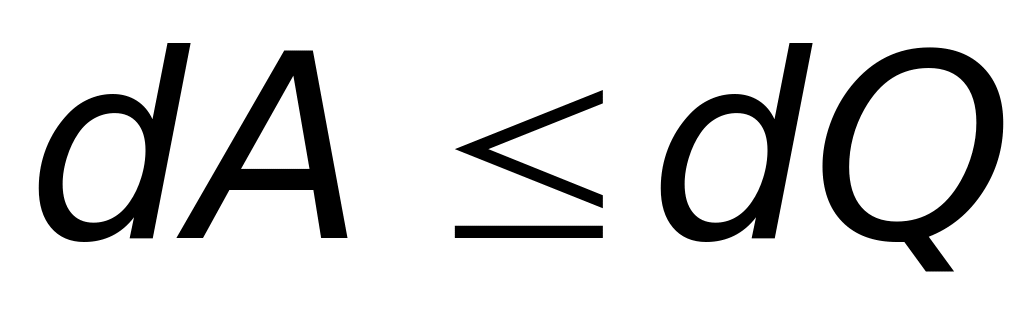 .
.(9.4)
На основании (9.4) первое начало термодинамики можно сформулировать следующим образом: невозможно построить двигатель, который совершал бы работу большую, чем количество затраченной теплоты.
Применим первое начало термодинамики к различным изопроцессам.
1. Изохорный процесс. В этом процессе объем остается постоянным, поэтому dA=PdV=0 и
-
 .
.
В изохорном процессе теплота, подведенная к системе, полностью расходуется на изменение ее внутренней энергии.
2. Изобарный процесс. Так как объем изменяется, то при подведении теплоты к системе она частично превращается в работу и поэтому первое начало термодинамики имеет вид
-
 .
.
Вычислим согласно (9.2) работу, совершаемую системой при изобарном процессе (P=const)
-
 ,
,(9.5)
3. Изотермический процесс. При постоянной температуре изменение внутренней энергии идеального газа не происходит – dU=0, поэтому
-
 .
.
В изотермическом процессе вся теплота, подведенная к газу, расходуется на совершение работы.
Поскольку Pconst, то в (9.2) его нельзя выносить за знак интеграла. Выразим давление P через объем V с помощью уравнения Менделеева-Клапейрона:
-
 .
.(9.6)
Подставим (9.6) в (9.2) и вынесем постоянные за знак интеграла
-
 ,
,
откуда
-
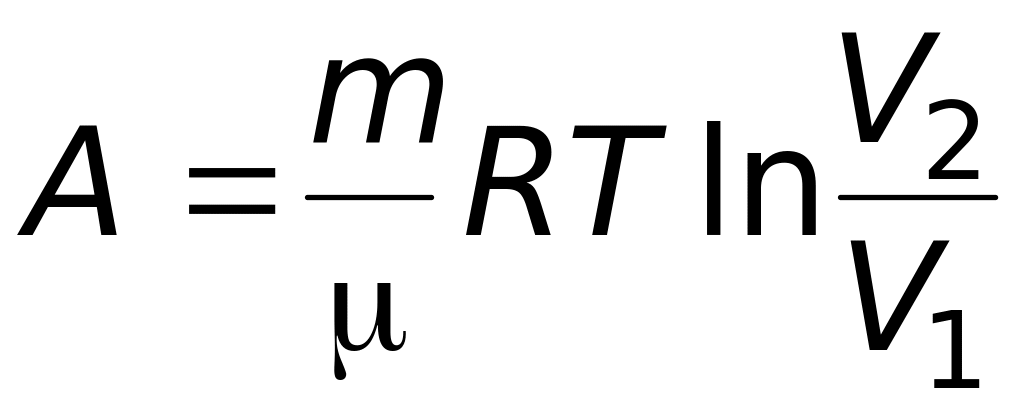 .
.
9.3. Число степеней свободы. Внутренняя энергия идеального газа
Рис. 9.4
Средняя
кинетическая энергия поступательного
движения молекулы равна
![]() –
формула (8.12). Это движение можно
рассматривать как движение с тремя
степенями свободы, поскольку молекулы
идеального газа можно принять как
материальные точки. Все три степени
свободы равноправны, поэтому можно
считать, что на одну степень свободы
приходится энергия
–
формула (8.12). Это движение можно
рассматривать как движение с тремя
степенями свободы, поскольку молекулы
идеального газа можно принять как
материальные точки. Все три степени
свободы равноправны, поэтому можно
считать, что на одну степень свободы
приходится энергия
-
 .
.(9.8)
В
статистической физике доказывается,
что на любую степень свободы движения
молекулы (поступательную, вращательную
и т.д.) приходится одна и та же энергия,
равная
![]() .
Это утверждение носит название закона
распределения энергии по степеням
свободы.
.
Это утверждение носит название закона
распределения энергии по степеням
свободы.
В общем случае, когда молекула имеет i степеней свободы, ее кинетическая энергия
-
 .
.(9.9)
Подсчитаем теперь внутреннюю энергию одного киломоля идеального газа. Эта энергия может быть найдена умножением средней энергии одной молекулы на их число, т.е. число Авогадро:
-
 .
.
Поскольку kNA=R, где R – универсальная газовая постоянная, то
-
 .
.(9.10)
Из (9.10) видно, что внутренняя энергия идеального газа полностью определяется его температурой.
Лекція 14.
Класична теорiя теплоємностi газiв. Адiабатний процес.Оборотнi та необоротнi процеси. Круговi процеси (цикли). Принцип дiї теплової машини. Ідеальна теплова машина Карно.
