
- •1.Общая характеристика колебательных процессов
- •2. Дифференциальное уравнение гармонических колебаний
- •3. Колебания пружинного маятника
- •4. Колебания физического маятника
- •5. Вертикальные колебания центра тяжести судна
- •6. Энергия гармонического колебания
- •Сложение скалярных колебаний
- •8. Сложение гармонических колебаний с равными частотами
- •8.2 Сложение гармонических колебаний с близкими частотами. Биения
- •21.9. Сложение взаимно перпендикулярных (векторных) колебаний
- •Затухающие колебания
- •1. Вынужденные колебания
- •2. Вынужденные вертикальные колебания судна
- •3. Параметрический резонанс
- •4. Автоколебания
- •5. Спектр колебаний
- •. Ангармонические колебания
- •7. Фазовая траектория
- •Общая характеристика волновых процессов
- •22.2. Упругие волны
- •3. Энергетические характеристики волновых процессов
- •Акустика
- •1. Объективные и субъективные характеристики звука
- •2. Распространение звуковых волн
- •3. Ультразвук
- •4. Эффект Доплера в акустике
- •Статистическая теория газов
- •1. Средние характеристики движения молекул идеального газа
- •2. Распределение молекул по скоростям (распределение Максвелла)
- •3. Барометрическая формула
- •4. Распределение Больцмана
- •5. Средняя длина свободного пробега молекул
- •1. Общая характеристика явлений переноса
- •2. Молекулярно-кинетическая теория явлений переноса
- •8.6.3. Анализ коэффициентов переноса
- •1. Основные понятия термодинамики
- •Первое начало термодинамики и его применение к изопроцессам
- •9.3. Число степеней свободы. Внутренняя энергия идеального газа
- •1. Классическая теория теплопроводности газов
- •2. Адиабатный процесс
- •3. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •4. Идеальная тепловая машина Карно
- •1. Второе начало термодинамики
- •9.9. Энтропия
- •2. Статистический смысл второго начала термодинамики
- •4. Теорема Нернста (третье начало термодинамики)
- •5. Термодинамика необратимых процессов
- •10.1. Реальные газы
- •10.1.2. Модель реального газа по Ван-дер-Ваальсу
- •10.1.3. Опытные изотермы реальных газов
- •10.1.4. Теоретические изотермы реальных газов (изотермы Ван-дер-Ваальса)
- •10.1.5. Расчет критических параметров вещества из уравнения Ван-дер-Ваальса
- •10.2. Жидкое состояние
- •10.2.1. Общие представления. Характер теплового движения молекул жидкости
- •10.2.2. Поверхностные явления
- •10.3. Твердое тело
- •10.3.1. Общие представления о твердых телах
- •10.3.2. Теплоемкость твердых тел. Закон Дюлонга и Пти
- •10.4. Фазовые равновесия и фазовые переходы
- •10.4.1. Общие понятия
- •10.4.2. Фазовый переход первого рода. Уравнение Клапейрона-Клаузиуса
3. Барометрическая формула
Рассмотрим поведение идеального газа в поле силы тяжести. Как известно, по мере подъема от поверхности Земли давление атмосферы уменьшается. Найдем зависимость давления атмосферы от высоты над уровнем моря, используя следующую упрощенную модель.
Температура газа и его молекулярный состав не зависят от высоты.
Ускорение свободного падения на всех высотах, где существует атмосфера, постоянно.
Известно, что давление жидкости высотой h на дно сосуда определяется формулой P=gh, где – плотность жидкости, а g – ускорение свободного падения. Эта формула справедлива, если =const. Для жидкостей это условие хорошо выполняется, т.к. жидкость мало сжимаема. С другой стороны, для воздуха это условие нарушается, т.к. с ростом высоты уменьшается.
Выделим на некоторой высоте h над поверхностью моря объем газа высотой dh и сечением S (рис. 8.6). Тогда давление воздуха на нижнее основание выделенного цилиндра будет
Рис. 8.6.
-
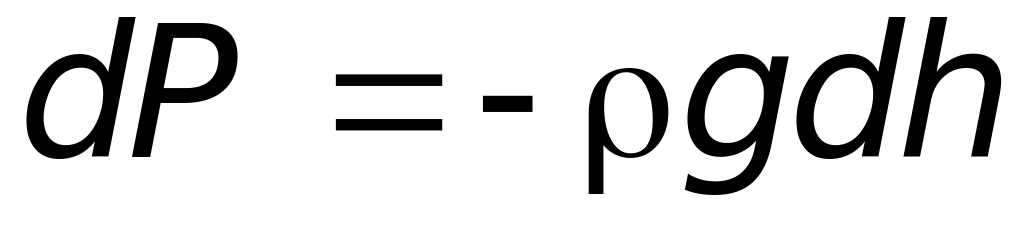 ,
,(8.20)
где – плотность воздуха на высоте h, а знак «минус» указывает, что с ростом высоты, давление атмосферы падает.
Найдём плотность воздуха из уравнения Менделеева–Клапейрона
и подставим в (8.20). После разделения переменных получим:
-
 .
.
Интегрируя последнее выражение в пределах от h0 до h, получаем
-
 ,
,(8.21)
где P и P0 – давление атмосферы на высоте соответственно h и h0.
Последняя формула выражает зависимость давления атмосферы от высоты над уровнем моря и называется барометрической формулой.
Если в выражении (8.21) положить h0=0 (т.е. высоту отсчитывать от уровня моря), то барометрическая формула примет вид
-
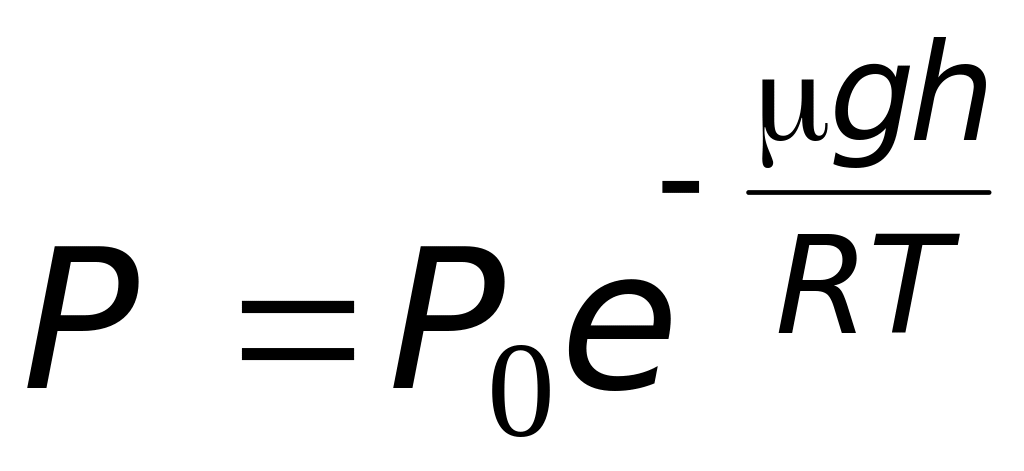 ,
,(8.22)
Рис. 8.7.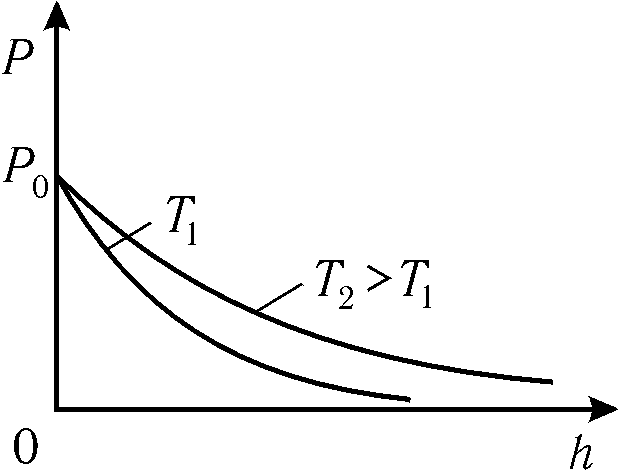
Нетрудно видеть, что при возрастании температуры зависимость P(h) будет более пологой (рис. 8.7), что может приводить к рассеиванию атмосферы на больших высотах – покиданию более быстрыми молекулами сферы притяжения данной планеты. Дальнейший анализ (8.22) позволяет также сделать ряд важных для астрономии выводов (отсутствие атмосферы на Луне вследствие малости g и т.д.).
4. Распределение Больцмана
Выразим давление газа на высотах h и h0 через соответствующее число молекул в единице объема n и n0:
-
 .
.(8.23)
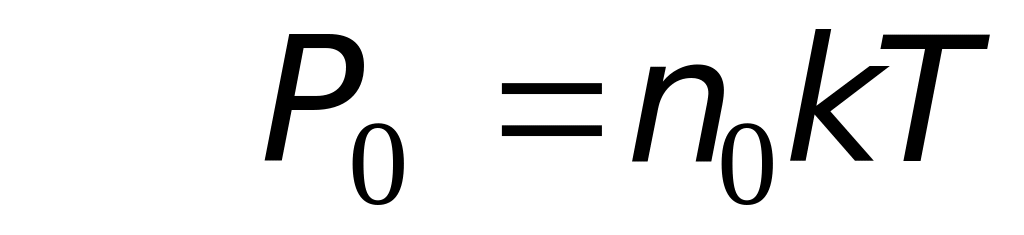 .
.(8.24)
Показатель степени в (8.21) преобразуем следующим образом:
-

(8.25)
где Wp= mgh–mgh0 – изменение потенциальной энергии молекулы.
Температуру T на разных высотах по-прежнему будем считать постоянной.
Подставив (8.23) – (8.25) в формулу (8.21), получим
-
 ,
,(8.26)
Это и есть распределение Больцмана для частиц, находящихся в потенциальном поле. Хотя эта формула была выведена нами для частного случая распределения молекул в поле тяжести Земли, она имеет универсальный характер – описывает распределение частиц по энергиям в любом потенциальном поле (например, зарядов в электростатическом поле).
Если потенциальную энергию частицы отсчитывать от нуля, то
-
 ,
,(8.27)
Рис. 8.8.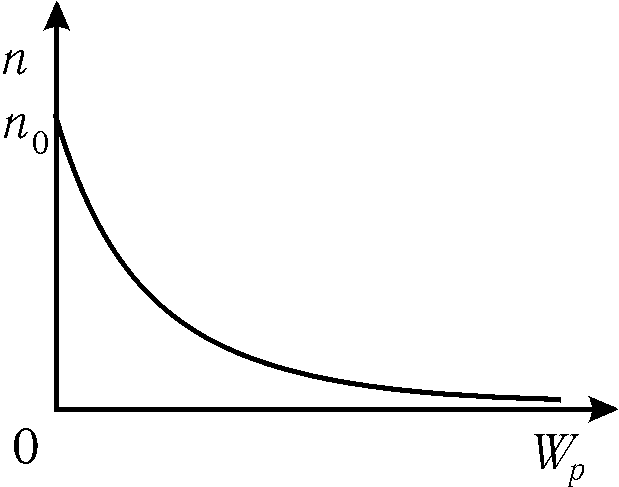
В заключение отметим, что распределение Больцмана (8.27) можно обобщить, заменив потенциальную энергию полной энергией:
-
 ,
,(8.28)
