- •Генетика у ветеринарній медицині конспект лекцій
- •Модуль 1. Загальна генетика
- •1. Предмет вивчення генетики
- •2. Коротка історія розвитку генетики.
- •4. Значення генетики:
- •1. Основні поняття і символи, які використовують у генетиці
- •1.2. Символи
- •2. Закони г.Менделя, їх статистичний характер і цитологічні основи
- •2.1. Гібридологічний метод дослідження
- •2.2. Об’єкт дослідження г. Менделя
- •2.3. Закони Менделя (відкриті у 1865 р.)
- •Число класів гібридних особин за фенотипом і генотипом і характер розщеплення у f2 при різній кількості пар ознак і повному домінуванні
- •3. Закон чистоти гамет. Методи перевірки генотипу гібридних особин.
- •3.1. Закон чистоти гамет
- •Успадкування безрогості у великої рогатої худоби:
- •Успадкування безрогості у великої рогатої худоби:
- •1. Причини відхилення при розщепленні від типових кількісних співвідношень, встановлених г.Менделем.
- •3. Взаємодія неалельних генів
- •1. Закон зчепленого успадкування генів т.Моргана
- •1.1. Об’єкт дослідження т.Моргана
- •1.2. Поняття, які використовують при зчепленому успадкуванні генів
- •1.3. Порівняння незалежного та зчепленого успадкування генів
- •2. Генетичні карти хромосом та принципи їх побудови (основи картування закладені т.Морганом)
- •Фрагмент генетичної карти хромосоми дрозофіли
- •2.2. Методи картування хромосом:
- •1. Поняття про стать та біологічне визначення статі в організмів
- •1. Сингамний тип
- •2. Прогамний тип
- •3. Епігамний тип
- •2. Статеві хромосоми і типи хромосомного визначення статі у тварин і людини.
- •2.1. Статеві хромосоми
- •2.2. Типи хромосомного визначення статі
- •3. Генетично обумовлене співвідношення статей у популяції
- •4. Успадкування генів, локалізованих у статевих хромосомах
- •Успадкування кольору очей у дрозофіли червоні (хw) і білі (Хw)
- •Успадкування черепахової масті у котів
- •Порівняльна характеристика успадкування генів, локалізованих у статевих хромосомах
- •Цитогенетика як наука
- •1. Цитогенетика як наука
- •2. Клітина як матеріальна основа спадковості
- •3. Хімічний склад і морфологічна будова хромосом
- •3.1. Докази ролі хромосом у спадковості
- •3.2. Хімічний склад і морфологічна будова хромосом
- •Типи метафазних хромосом:
- •Каріотипи соматичних клітин деяких тварин і рослин в метафазі:
- •4. Цитологічні основи нестатевого розмноження
- •5. Цитологічні основи статевого розмноження
- •6. Значення цитогенетики для тваринництва
- •Сучасне уявлення про будову гена.
- •Генетичний код та його властивості.
- •1. Докази зберігання і передачі генетичної інформації нуклеїновими кислотами
- •2. Види, структура, властивості, функції та біосинтез нуклеїнових кислот
- •2.1. Види нк
- •2.2. Структура нк
- •Хімічний склад вуглеводів
- •2.2.2. Вторинна структура нк
- •2.4. Властивості нк
- •2.5. Біосинтез нуклеїнових кислот
- •Біосинтез нуклеїнових кислот
- •3. Сучасне уявлення про будову гена
- •4. Генетичний код та його властивості
- •*Повний словник генетичного коду для амінокислот (наведено триплети іРнк)
- •5. Загальна характеристика білків та їх біосинтез
- •1) Залежно від продуктів розпаду:
- •6. Регуляція активності генів
- •Порівняння модифікаційної і мутаційної мінливості
- •2. Закон гомологічних рядів спадкової мінливості м.І.Вавилова та його практичне значення для селекції (1920 р.)
- •3. Біометричні методи вивчення мінливості.
- •3.1. Поняття про якісні і кількісні ознаки
- •3.2. Генеральна і вибіркова сукупності
- •3.3. Варіаційний ряд та варіаційна крива.
- •3.4. Середні величини
- •3.5. Показники мінливості (варіювання) ознаки
- •3.6. Показники зв’язку між ознаками
- •3.7. Статистичні помилки
- •3.8. Організація масового матеріалу для біометричної обробки
- •7. Дисперсійний аналіз
- •1. Мутації та їх класифікація
- •1. Класифікація мутацій за локалізацією у геномі
- •1.1. Генні мутації − спонтанні (довільні) або індуковані (штучні) спадкові зміни молекулярної структури гена з утворенням нових алелей.
- •1.2. Хромосомні мутації (аберації) − зміна не одного гена, а двох або декількох, що призводить до зміни форми хромосом.
- •1.3. Геномні (плоїдні) мутації − збільшення або зменшенням кількості хромосом у каріотипі організму. Бувають:
- •2) Залежно від типу хромосом:
- •2. Поняття про мутагенез
- •3. Мутагенні фактори та їх класифікація
- •4. Штучний мутагенез
- •1. Ветеринарна патогенетика як наука
- •2. Генетичні аномалії тварин та людини.
- •1) Пренатальний (внутрішньоутробний), який включає:
- •3. Спадкові хвороби тварин та їх успадкування
- •Типи х-зчепленого успадкування*
- •Типи z -зчепленого успадкування*
- •4. Летальні гени та їх практичне використання у тваринництві
- •5. Спадкові хвороби обміну речовин тварин та людини
- •Деякі хвороби обміну речовин тварин і людини
- •6. Клініко-генеалогічний метод дослідження
- •7. Хромосомні хвороби тварин і людини.
- •Хромосомні хвороби тварин і людини
- •8. Геномні хвороби людини
- •Хромосомні хвороби людини, обумовлені гоносомними анеуплодіями
- •9. Аномалії тварин і людини, обумовлені мозаїцизмом
- •10. Аномальний гермафродитизм тварин і людини
- •11. Поширення генетичних аномалій у популяціях свійських тварин та їх профілактика
- •Діагностика спадкових аномалій;
- •Виявлення та вибракування гетерозиготних носіїв аномалій;
- •Здійснення селекційних заходів.
- •Лекція 11. Спадково-середовищні хвороби та генетична стійкість до них тварин
- •1. Генетична резистентність у чутливість тварин до спадково-середовищних хвороб.
- •3. Методи та проблеми селекції на резистентність тварин до хвороб.
- •1. Генетична резистентність у чутливість тварин до спадково-середовищних хвороб
- •Худоба зебу відносно стійка проти піроплазмозу, червона степова – чутлива;
- •Гібриди від схрещування браманської і герефордської порід у два рази менше вражаються кліщами, ніж їх батьки;
- •2. Методи вивчення генетичної стійкості тварин до хвороб
- •3. Методи та проблеми селекції на резистентність тварин до хвороб
- •Імуногенетика як наука
- •2. Генетичні системи груп крові тварин і людини
- •3. Імуногенетична несумісність матері і плода
- •4. Біохімічний поліморфізм білків
- •5. Практичне використання досягнень імуногенетики у тваринництві
- •Методичні рекомендації до виконання індивідуального завдання з біометрії
- •Середні величини
- •Показники різноманітності ознак в сукупності
- •Оцінка достовірності одержаних даних
- •Оцінка достовірності різниці між середніми величинами двох вибірок
- •Показники зв‘язку між ознаками (коефіцієнт фенотипової кореляції)
- •Приклад розв’язку типового завдання №1:
- •Середнє квадратичне відхилення ():
- •Мінімальне (Min) і максимальне (Max) значення:
- •Приклад розв’язування типового завдання №2
- •Рекомендована література
- •10001, М. Житомир, вул. М. Бердичівська, 17
5. Загальна характеристика білків та їх біосинтез
5.1. Загальна характеристика білків
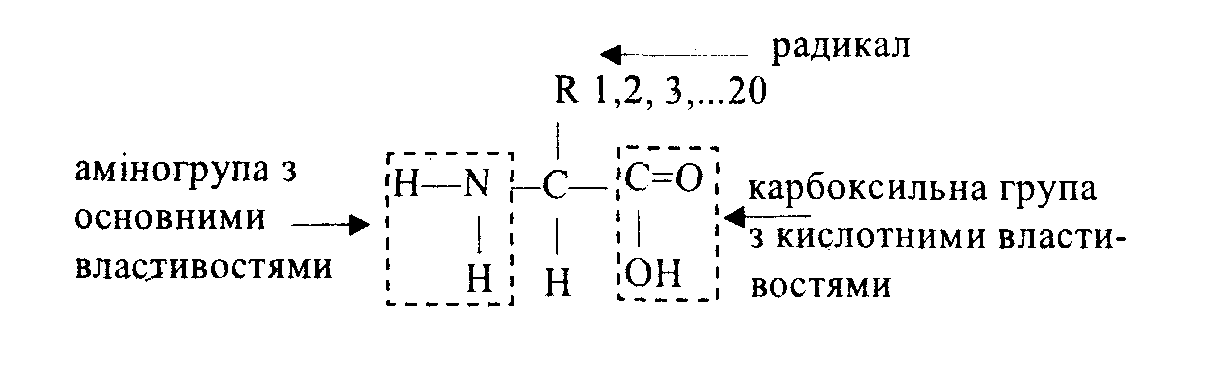
Білки – високомолекулярні біополімери, мономерами яких є амінокислоти. Мономери (20 амінокислот) мають загальну формулу (всі амінокислоти подібні карбоксильною (–СООН – кислотні властивості) та аміногрупою (–NH2 – лужні властивості), відмінні – бічними ланцюгами – радикалами (або R-групами).
|
Схема будови амінокислоти
|
Амінокислоти поділяються на:
незамінні* – не можуть синтезуватись тваринними організмами з інших сполук і тому обов'язково мають надходити ззовні (з їжею) (лізин, триптофан, фенілааанін, метіонін, треонін, лейцин, ізолейцин, валін).
замінні – синтезуються у тваринних організмах у достатній кількості з незамінних амінокислот або інших сполук.
Білки класифікують:
1) Залежно від продуктів розпаду:
прості (протеїни) – складаються лише з амінокислот (альбуміни, глобуліни – білки крові; склеропротеїни – кератин волосся, пір’я; колаген – сухожилля);
складні (протеїди) – мають у складі не лише амінокислоти, а і небілковий матеріал – простетичну групу (нуклеопротеїди (сполучення нуклеїнових кислот і простих білків) – хромосоми; хромопротеїди (забарвлені речовини небілкової природи і прості білки) гемоглобін, цитохром; фосфопротеїди – казеїн молока; глікопротеїди – плазма крові, муцин слини тощо).
2) залежно від вмісту амінокислот: повноцінні – містять усі незамінні амінокислоти; неповноцінні – не містять тих чи інших незамінних амінокислот.
Амінокислоти, які входять у склад білків і їх умовні позначення
Назва амінокислоти |
|||
Повна |
Скорочена |
Повна |
Скорочена |
Аланін |
ала |
Лейцин* |
лей |
Аргінін (незамінна для дітей) |
арг |
Лізин* |
ліз |
Аспарагін |
аспн |
Метіонін* |
мет |
Аспарагінова кислота |
асп |
Пролін |
про |
Валін* |
вал |
Серин |
сер |
Гістидин (незамінна для дітей) |
гіс |
Тирозин |
тир |
Гліцин |
глі |
Треонін* |
тре |
Глутамін |
глун |
Триптофан* |
три |
Глутамінова кислота |
глу |
Фенілаланін* |
фен |
Ізолейцин* |
ілей |
Цистеїн |
цис |
5.2. Біосинтез білка є результатом реалізації генетичної інформації у клітині, яка здійснюється за схемою:

Етапи біосинтезу білка
Етап |
Процес |
Де відбувається |
||||||||||||
1 |
Транскрипція (від лат. транскриптіо − переписування) – процес переписування інформації з ДНК на іРНК. Під час цього процесу відбувається синтез іРНК (мРНК) на ДНК за участю ферменту ДНК-залеженої-РНК-полімерази за принципом комплементарності:
Спочатку синтезується про-іРНК, яка знімає копію з усіх екзонних та інтронних ділянок ДНК, після чого за допомогою спеціальних ферментів з неї видаляються ділянки, які не несуть генетичної інформації (інторони) і вона перетворюється на активну форму. |
У ядрі на ДНК. (після синтезу іРНК мігрує до рибосом у цитоплазму). |
||||||||||||
2 |
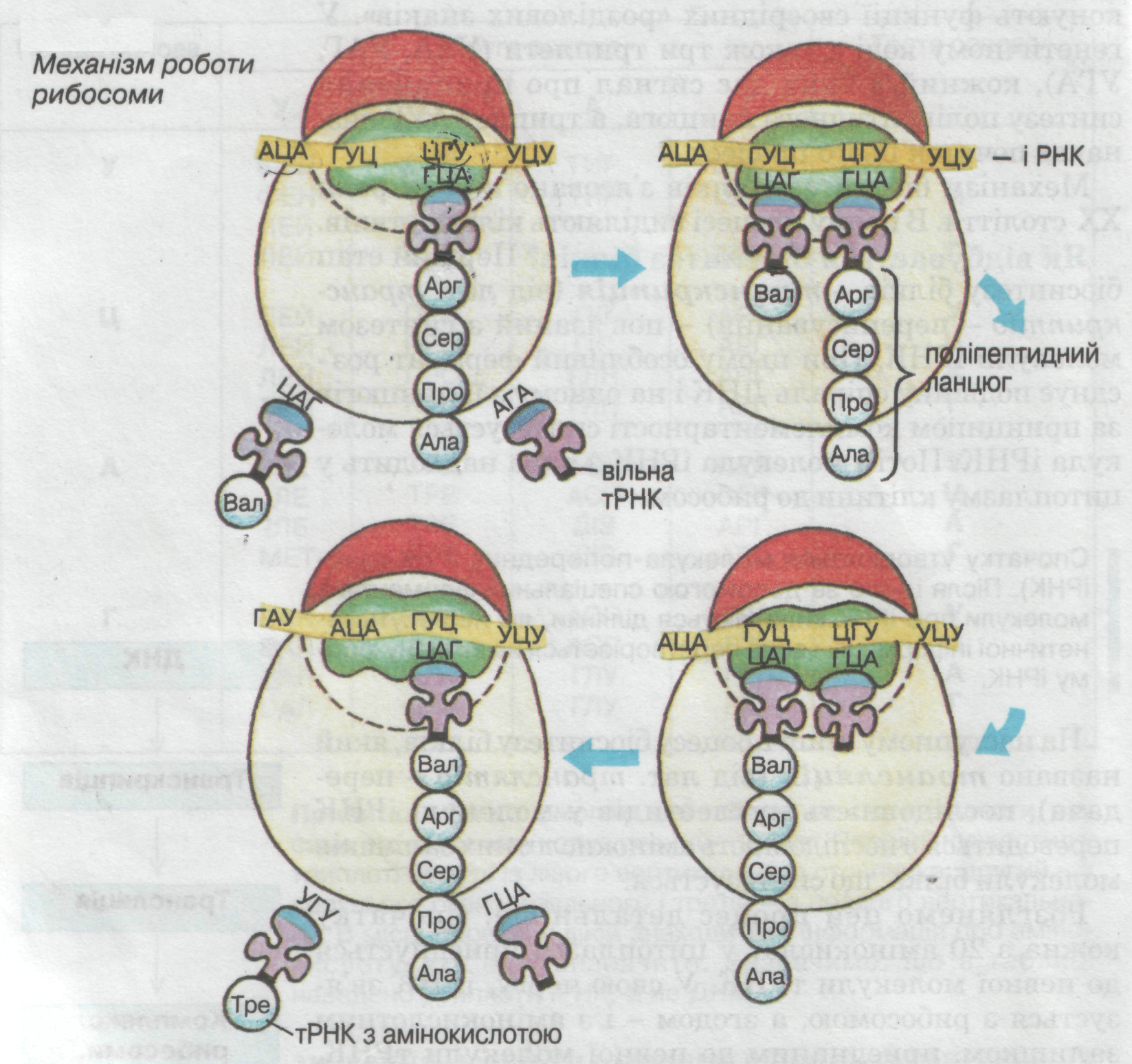
Трансляція (віл лат. транслятіо − передача) − перенесення інформації, записаної у послідовності нуклеотидів іРНК, у певну послідовність амінокислот називається (синтез білка на іРНК). У цьому процесі виділяють три стадії:
|
У цитоплазмі на рибосомах |
||||||||||||
Амінокислоти під впливом ферменту (аміноацил-тРНК-синтетаза), специфічного для кожної амінокислоти взаємодіють з АТФ у результаті чого утворюються аміноациладенилати (комплекс ферменту аміноацил-тРНК-синтетази та амінокислотного залишку). 2.2. Аміноацелювання тРНК Аміноациладенилати приєднуються до молекули специфічної тРНК і мігрують до рибосом. Певна амінокислота переносить певною тРНК, що визначається антикодоном. Антикодон − триплет на середній лопаті (верхівці) специфічної тРНК, комплементарний відповідному триплету (кодону) іРНК. |
У цитоплазмі. |
|||||||||||||
2.3. Власне трансляція Аміноациладенилати, згідно словника генетичного коду, полімеризуються у поліпептидний ланцюг.
У цьому процесі виділяють три стадії:
|
На рибосомах (шорсткій або гранулярній ЕПС). Синтезована молекула білка надходить у порожнину ендоплазматичної сітки, якою транспортується в певну ділянку клітини. |
|||||||||||||
|
Схема трансляції (механізм роботи рибосоми):
Процеси біосинтезу білка належать до реакцій матричного синтезу, тому що з ДНК, потім з іРНК знімається інформація як з матриці. |
|||||||||||||
2.4. Дозрівання білка Синтезований білок набуває своєї природної просторової (вторинної, третинної) структури і функціональної активності: за участю відповідних ферментів від нього відщеплюються зайві амінокислотні залишки, вводяться небілкові фосфатні, карбоксильні та інші групи, приєднуються вуглеводи, ліпіди тощо. |
У цитоплазмі |
|||||||||||||