
- •Р.Б. Николаева
- •Часть I Теоретические основы химии
- •Список принятых сокращений и условных обозначений1
- •Общие понятия химии
- •Химическая форма движения материи. Формула вещества
- •Вопросы к семинару
- •Эквивалент. Моль. Способы выражения состава раствора эквивалент
- •Количество вещества. Моль
- •Молярная масса
- •Способы выражения состава раствора
- •Парциальное давление газов в смеси
- •Вопросы к семинару
- •Основы химической термодинамики и кинетики
- •Термохимия. Энтропия. Энергия гиббса
- •Термохимия
- •Энтропия. Энергия гиббса
- •Вопросы к семинару
- •Равновесие. Принцип ле шателье
- •Движущая сила реакции. Константа равновесия
- •Сдвиг равновесия
- •Вопросы к семинару
- •Кинетика
- •Определение скорости реакции
- •Кинетическое уравнение
- •Влияние температуры и наличия катализатора на скорость процесса
- •Механизмы химических реакций
- •Равновесие с позиции кинетики
- •Вопросы к семинару
- •Электронное строение атома
- •Модели атомов
- •Характеристика квантовых чисел
- •Порядок заполнения орбиталей атомов электронами
- •Изменение основных характеристик атомов в периодах и подгруппах периодической таблицы.
- •Вопросы к семинару
- •Общая характеристика химической связи
- •Параметры химической связи
- •Типы химических связей и их свойства
- •Типы межмолекулярных связей
- •Вопросы к семинару
- •Метод валентных связей
- •Вопросы к семинару
- •Метод молекулярных орбиталей и метод гипервалентных связей
- •Метод молекулярных орбиталей
- •Метод гипервалентных связей
- •Вопросы к семинару
- •Растворимость. Пр. Тэд
- •Общая характеристика растворов
- •Растворимость
- •Теория электролитической диссоциации
- •Термодинамика растворения
- •Вопросы к семинару
- •Диссоциация, рн, буферные растворы. Теории кислот и оснований
- •Сильные и слабые электролиты. Степень и константа диссоциации
- •Ионное произведение воды. Водородный показатель. Индикаторы
- •Буферные растворы
- •Теории кислот и оснований
- •Вопросы к семинару
- •Гидролиз солей
- •Механизм гидролиза
- •Классификация солей по отношению к гидролизу
- •Степень и константа гидролиза
- •Влияние состава раствора на степень гидролиза
- •Гидролиз кислых и оснóвных солей
- •Особые случаи гидролиза
- •Вопросы к семинару
- •Овр. Электрохимия
- •Окислительно-восстановительные реакции
- •Степень окисления
- •Определение окислительно-восстановительных реакций
- •Двойной электрический слой
- •Стандартный окислительно-восстановительный потенциал
- •Формула нернста
- •Направление окислительно-восстановительных реакций
- •Потенциал разложения воды. Устойчивость ионов в водных растворах
- •Электрохимия
- •Гальванический элемент
- •Электролиз
- •Вопросы к семинару
- •Комплексные соединения. Химическая связь в комплексных соединениях
- •Определение комплексных соединений
- •Координационное число и координационная емкость
- •Химическая связь в комплексных соединениях
- •Основные положения мвс при рассмотрении комплексных соединений:
- •Теория кристаллического поля
- •Транс-влияние
- •Кинетическая устойчивость комплекса. Цис-эффект
- •Вопросы к семинару
- •Общие свойства растворов. Диаграммы состояния
- •Осмотическое давление
- •Давление пара над раствором
- •Диаграммы состояния общая характеристика
- •Однокомпонентная система
- •Двухкомпонентная бинарная система (жидкий раствор)
- •Изотонический коэффициент
- •Вопросы к семинару
- •Приложение. Связь констант скоростей и констант равновесия для многостадийных процессов
- •Список литературы
- •Содержание
Вопросы к семинару
Определяются ли общие свойства раствора природой растворенного вещества? природой растворителя?
Что общего между явлениями осмоса и диффузии? В чем принципиальное различие? Почему формула закона Вант-Гоффа для осмотического давления аналогична формуле Клапейрона-Менделеева?
Зависит ли осмотическое давление раствора от его объема? Что будет наблюдаться, если над раствором, находящимся в равновесии с чистым растворителем (как это организовать?), увеличить давление (как осуществить практически?)?
Не проводя расчетов, ответьте, каково осмотическое давление в 1М растворе сахара при 273К.
Длительное плавание в соленой воде приводит к сморщиванию кожи на пальцах. Почему?
Осмотическое давление какого раствора выше: 0,1М НСl или 0,05М H2SO4 , 0,1М HgCl2 или 0,1М K 2SO4 ; 0,1M KCN или 0,1M HCN?
Объяснить закон Рауля с точки зрения кинетики и исходя из принципа Ле Шателье. Как неидеальность раствора скажется на величине равновесного давления насыщенного пара?
Показать на диаграмме состояния воды и водных растворов (рис.8), почему с повышением концентрации раствора увеличивается температурный интервал существования его в виде жидкой фазы. Почему при посыпании льда солью он тает?
Чем объяснить, что в формулах расчета изменения температур фазовых переходов для растворов используется моляльность, а не молярная концентрация?
Почему для бензола значения крио- и эбулиоскопических констант выше, чем для воды? Каков физический смысл этих констант?
Могут ли самопроизвольно идти процессы кипения, кристаллизации, плавления, конденсации? Почему?
Каков физический смысл изотонического коэффициента? Вывести формулу связи его с кажущейся степенью диссоциации электролита.
Почему для одномоляльного водного раствора хлорида цинка понижение температуры кристаллизации воды не 1,860С и не 5,580С, а 4,670С?
Вычислить температуру кипения 27%-го(масс.) водного раствора хлорида кальция, если его кажущаяся степень диссоциации равна 0,68.
Расположите указанные вещества в порядке повышения температур кипения их водных растворов одинаковой молярной концентрации: K 3[Fe(CN) ]6 , BaCl2 ,
NH4 [Fe(CNS)4 ], KCN, HCN, C6H12O6 . Ответ мотивируйте!
Концентрация какого из изотонических водных растворов выше: HCl или HCN, KCl или K 2SO4 , сахара или уксусной кислоты?
Приложение. Связь констант скоростей и констант равновесия для многостадийных процессов
Многостадийным процессом является, например, реакция:
2NO + O2 = 2NO2 .
Она идет в 3 стадии, для каждой из которых при наступлении равновесия (в соответствии с материалом, изложенным в главах 2.2 и 2.3) можно записать:
a(NO ) k
O2 + NO = NO3 , K1 = 3 = 1 (1)

a(O2 ) ⋅ a(NO) k1 a(O) ⋅ a(NO ) k
NO3 = O + NO2 , K 2 = 2 = 2 (2)
a(NO3 ) k 2
a(NO ) k
O + NO = NO2 , K 3 = 2 = 3 (3)
a(O) ⋅ a(NO) k 3
Сложим левые и правые части данных уравнений (без сокращений и без суммирования):
O2 + NO + NO3 + O + NO = NO3 + O + NO2 + NO2 ,
и напишем развернутое выражение константы равновесия по данному уравнению суммарного процесса:
 a(NO3
) ⋅ a(O) ⋅
a(NO2 ) ⋅
a(NO2 ) a(NO3
) ⎡a(O) ⋅
a(NO2 )⎤ a(NO2
) (4)
a(NO3
) ⋅ a(O) ⋅
a(NO2 ) ⋅
a(NO2 ) a(NO3
) ⎡a(O) ⋅
a(NO2 )⎤ a(NO2
) (4)
K = = ⋅ ⎢ ⎥ ⋅
a(O2 ) ⋅ a(NO) ⋅ a(NO3 ) ⋅ a(O) ⋅ a(NO) a(O2 ) ⋅ a(NO) ⎣ a(NO3 ) ⎦ a(O) ⋅ a(NO)
Отношение, выделенное квадратными скобками, – это выражение K 2 ; то, что левее -
K1 , а правее - K ; 3 таким образом: K = K1 ⋅K 2 ⋅K 3 или (что следует из формул
(1)-(3)):
K
=
 (5)
(5)
Значит, константы скорости многостадийной реакции (прямой и обратной) равны произведениям соответствующих констант скоростей всех стадий этой реакции:

k = k1 ⋅k 2 ⋅k 3 и k = k1 ⋅k 2 ⋅k 3 .
После сокращения в формуле (4) получим:
a2 (NO2 )
K = 2 . (6) a(O2 ) ⋅ a (NO)
Следовательно, выражение константы равновесия даже для многостадийного процесса записывается в соответствии с его стехиометрией.
В соответствии со стехиометрией записываются и кинетические уравнения для отдельных стадий реакции:
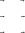
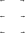
υ1 = k1 ⋅ a(O2 ) ⋅ a(NO) , υ1 = k1 ⋅ a(NO3 ), υ2 = k 2 ⋅ a(NO3 ), υ2 = k 2 ⋅ a(O) ⋅ a(NO2 ), υ3 = k 3 ⋅ a(O) ⋅ a(NO) , υ3 = k 3 ⋅ a(NO2 ).
Однако в кинетических уравнениях для суммарного многостадийного процесса (прямого и обратного) порядки реакции по реагентам и продуктам, как правило, не совпадает с соответствующими стехиометрическими коэффициентами. Это объясняется тем, что скорость многостадийной реакции в неравновесных условиях определяется скоростью лимитирующей стадии; в нашем примере при осуществлении процесса в прямом направлении– первой стадией, и значит:

υ = υ1 = υ1 − υ1 = k1 ⋅ a(O2 ) ⋅ a(NO) − k1 ⋅ a(NO3 ) (7)
При этом для нелимитирующих (а значит, более быстро протекающих) стадий (2) и (3) практически успевает установиться равновесие в каждый данный момент процесса (даже если суммарная реакция далека от равновесного состояния).
Поэтому, чтобы исключить из кинетического уравнения (7) активность промежуточных частиц, можно подставить в формулу (7) выражение a(NO )3 , полученное из формулы (2):
a(O) ⋅ a(NO2 )
a(NO3 ) = , (8)
K 2
а в формулу (8) – выражение a(O) из формулы (3):
a(NO2 ) a(O) = .
K 3 ⋅ a(NO)
Как результат, имеем следующее кинетическое уравнение:
2
 a
(NO2 )
a
(NO2 )
 υ
= k1 ⋅
a(O2 )
⋅ a(NO) −
k1 ⋅
(9)
υ
= k1 ⋅
a(O2 )
⋅ a(NO) −
k1 ⋅
(9)
K 2 ⋅K 3 ⋅ a(NO)
В отличие от формально-кинетического (глава 2.3), оно отражает реальное влияние активностей реагентов и продуктов (их текущих значений) на скорость суммарного процесса в данный момент времени (в неравновесных условиях).
При наступлении равновесия скорости всех стадий и всех направлений (прямых и обратных) становятся равными. И значит, скорость прямого многостадийного процесса и обратного равны соответствующим скоростям любой из его стадий. В частности, можно взять кинетические уравнения, которые не включают активности промежуточных частиц (это удобно для практической работы):

υ = υ1 = k1 ⋅ a(O2 ) ⋅ a(NO) , υ = υ3 = k 3 ⋅ a(NO2 ).
Поскольку при наступлении равновесия υ = 0 , то из формулы (9) следует:
a2 (NO2 )
 k1
⋅ a(O2
) ⋅ a(NO) =
k1 ⋅ .
k1
⋅ a(O2
) ⋅ a(NO) =
k1 ⋅ .
K 2 ⋅K 3 ⋅ a(NO)

Преобразуя данное равенство, и подставляя K1 вместо k1 /k1 , получим:
2
a (NO2 )
K1 ⋅K 2 ⋅K 3 = 2 = K .
a(O2 ) ⋅ a (NO)
Таким образом, даже исходя из кинетического уравнения, записанного не по стехиометрии многостадийного процесса, мы получаем выражение его константы равновесия в соответствии со стехиометрическими коэффициентами.
