
- •Глава 2. Экспериментальная часть
- •Методика синтеза фосфатов кальция из модельных растворов, приближенных по электролитному составу внеклеточной жидкости
- •2.1.1 Методика осаждения и получения покрытия фосфатов кальция на образцах титана.
- •2.2. Определение химического состава надосадочной жидкости
- •2.2.1. Методика определения фосфат-ионов по молибденовой сини [гост 18309–72.]
- •2.2.2. Методика фотометрического определения концентрации кремния в виде желтой формы молибдокремниевой кислоты [20]
- •2.2.3. Методика определения ионов кальция с помощью ионселективного электрода
- •2.2.4 Методика измерения поверхностного натяжения суспензии фосфата кальция сталагмометрически [гост 50097-92].
- •2.2.5 Методика измерения краевого угла смачивания фосфата кальция титанового образца [60].
- •2.2.6. Методика изучения растворимости ортофосфатов кальция
- •2.3 Определение состава образцов
- •2.3.1.Методика анализа методом ик-спектроскопии
- •2.3.2 Методика рентгенофазового анализа
- •2.3.3 Методика изучения морфологии частиц твердой фазы методом оптической микроскопии
- •2.4 Методика термогравиметрического анализа
2.2.4 Методика измерения поверхностного натяжения суспензии фосфата кальция сталагмометрически [гост 50097-92].
Определение поверхностного натяжения этим методом заключается в сравнении количества капель при истечении из сталагмометра исследуемой жидкости (nx) и жидкости (nст) с известным поверхностным натяжением (ст). Значение поверхностного натяжения исследуемой жидкости рассчитывают по формуле:
1=0 (12)
(12)
где х и ст – плотность исследуемой и стандартной жидкостей (воды=72,75 мДж/м2).
2.2.5 Методика измерения краевого угла смачивания фосфата кальция титанового образца [60].
Для измерения краевого угла смачивания был использован метод базирующийся на измерении геометрических параметров капли жидкости (высоты и диаметра), которая смачивает поверхность. Предварительно поверхность титанового образца обезжиривали раствором этилового спирта, затем при помощи стеклянного капилляра диаметром порядка 0,2 мм наносили каплю, исследуемой суспензии. Измерение геометрических параметров капли производилось на оптическом микроскопе NEOPHOT 2 (рис.2), с использованием микрометрического винта имеющегося на данном микроскопе
Рис.10
Оптический микроскоп NEOPHOT
2

Дальнейший расчет проводили по формуле:
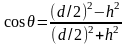 (13)
(13)
2.2.6. Методика изучения растворимости ортофосфатов кальция
Для изучения устойчивости образцов ортофосфатов кальция, синтезированных в различных условиях, проводят их растворение в кислых и слабокислых растворах при постоянном перемешивании, контроле рН системы, концентрации ионов кальция и фосфат-ионов, переходящих в жидкую фазу.
Изучение растворимости образцов кремний-замещенного гидроксилапатита проводят в растворе соляной кислоты, значения рН для которых составляет 2, NaCl 0.9 %, а также трис-HCl буфер.
На аналитических весах на сухом часовом стекле берут навеску образца кремний-замещенного гидроксилапатита массой 0.1000 г. Изучение процесса растворения кремний-замещенного гидроксилапатита проводят при постоянном перемешивании раствора. Через определенные промежутки времени (τ = 0 - 40 мин) отмечают величину кислотности среды, значение показателя концентрации ионов кальция в системе. Через 40 мин от начала эксперимента отбирают пробу раствора для анализа на фосфат-ионы. Концентрацию фосфат-ионов в жидкой фазе определяют по методу «фосфорномолибденовой сини».
Алгоритм обработки экспериментальных данных [60]:
Рассчитывали степень растворения синтезированного фосфата кальция
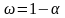 (14)
(14)
где
 - степень растворения вещества.
- степень растворения вещества.
Затем по полученным данным о растворимости фосфата кальция при одиннаковой степени растворения вещества, расчитывали энергию активациипо формуле:
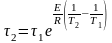 (15)
(15)
Необходимо
подчеркнуть, что
 и
и
 означают время, необходимое для
достижения одного и того же значения
степени растворения вещества
означают время, необходимое для
достижения одного и того же значения
степени растворения вещества
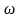 в первом и втором опытах. Уравнение (8)
показывает, что зависимость
от
выражается аппроксимирующей линией,
тангенс угла наклона которой к оси
абсцисс численно равен энергии активации
Е/R. Вместо определения углового
коэффициента прямой, энергию активации
можно вычислить по формуле:
в первом и втором опытах. Уравнение (8)
показывает, что зависимость
от
выражается аппроксимирующей линией,
тангенс угла наклона которой к оси
абсцисс численно равен энергии активации
Е/R. Вместо определения углового
коэффициента прямой, энергию активации
можно вычислить по формуле:
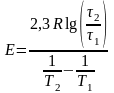 (16)
(16)
По экспериментальным данным строят зависимость от , где и отвечают равным значениям
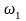 и
и
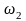 .
Из уравнений для скорости растворения
при равных значениях
следует соотношение:
.
Из уравнений для скорости растворения
при равных значениях
следует соотношение:
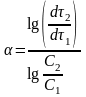 (17)
(17)
