
- •Оглавление
- •1. Амины
- •Классификация и номенклатура аминов
- •1.2. Изомерия аминов
- •Распространение в природе, биологическая роль
- •Физические и физиологические свойства
- •1.5. Способы получения
- •1.6. Химические свойства
- •2. Аминокислоты
- •2.1. Клакссификация и номенклатура аминокислот
- •2.2. Распространение в природе. Биологическая роль
- •Биологические функции протеиногенных аминокислот
- •2.3. Физические свойства аминокислот
- •2.4. Получение аминокислот
- •2.5. Химические свойства
- •2.6. Качественные реакции на аминокислоты
- •3. Пептиды и белки
- •3.3. Ферменты
- •3.4. Классификация белков
- •3.5. Пространственная структура белков
- •3.6. Химические свойства пептидов и белков
- •3.7. Цветные реакции белков
- •Цветные реакции на белки
- •4. Гетероциклические соединения
- •4.1. Пиррол и его производные
- •4.2. Пиридин и его производные
- •4.3. Пиримидин и его производные
- •4.4. Индол и его производные
- •4.5. Пурин и его производные
- •5. Нуклеиновые кислоты
- •5.1. Строение нуклеотидов
- •Гетероциклические нуклеиновые основания
- •5.2. Строение нуклеозидов
- •5.3. Фосфаты нуклеозидов и нуклеотидов
- •5.4. Строение полинуклеотидов (нуклеиновых кислот)
- •Виды и функции рнк
- •5.5. Биологические функции нуклеиновых кислот
- •5.6. Нарушение структуры нуклеиновых кислот
- •Литература
4.1. Пиррол и его производные
Пиррол – пятичленный гетероцикл с одним атомом азота – бесцветная жидкость с температурой кипения 130С, плохо растворимая в воде, окисляющаяся на воздухе.
Пиррол значительно активнее бензола в реакциях электрофильного замещения, т.к. атом азота повышает электронную плотность в цикле. Однако устойчивость пиррола как ароматической структуры значительно меньше, чем бензола. Например, под действием сильных минеральных кислот электронная пара азота используется для солеобразования и ароматичность молекулы исчезает. По сравнению с ароматическими аминами пиррол имеет слабо выраженные основные свойства, что обусловлено связыванием неподеленной электронной пары атома азота системой сопряжения. С другой стороны это приводит к проявлению кислотных свойств. Как слабая кислота пиррол вступает в реакцию с металлическим калием, образуя соль – пиррол-калий:

В свободном состоянии пиррол обнаружен в каменноугольной смоле и костном масле. Пиррольные циклы содержатся в гемоглобине, хлорофилле, витамине В12 и некоторых других биологически важных природных соединениях. В состав молекул этих сложных веществ входит тетрапиррольный фрагмент (порфин) в виде комплекса с металлом (Fe в гемоглобине, Mg в хлорофилле, Co в витамине В12, Zn в цинк-протопорфирине и т. д.):
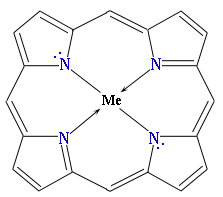
Многочисленные производные порфина – порфирины – являются азотосодержащими пигментами, входят в состав гемов белка гемоглобина, хлорофилла, ряда ферментов и относятся к высшим гетероциклам. Благодаря уникальному набору физических и химических свойств порфирины и их аналоги находят применение в области химии, биологии, медицины, оптики и материаловедения.
Гемы (от греч. «гемос» – кровь) комплексные соединения порфиринов с двухвалентным железом. Гемы выступают в роли простетических групп (небелковых частей) белков крови. Известен ряд различных гемов, отличающихся заместителями порфиринового цикла. Наиболее распространен в животных организмах гем В.
При дефиците железа в организме или при отравлении свинцом в красных кровяных клетках при синтезе гема вместо слияния порфиринового цикла с ионами железа(II) возможно образование цинк-протопорфирина. Его количество в крови определяют с помощью специальных скрининговых тестов, что позволяет выявлять различные заболевания.


Хлорофилл (от греч. «хлорос» – зеленый и «филлон» – лист).– зеленый пигмент, обуславливающий окраску хлоропластов растений в зеленый цвет. При его участии осуществляется процесс фотосинтеза. По химическому составу хлорофиллы являются магниевыми комплексами различных порфиринов. Хлорофилл присутствует во всех фотосинтезирующих организмах: высших растениях, водорослях, бактериях и некоторых простейших.
В природе встречаются шесть разновидностей хлорофилла, которые различаются углеводородными радикалами и функциональными группами, связанными с порфириновым циклом, а также по окраске и распространению среди живых организмов. Это хлорофиллы а, b, c1, c2, d и f. Хлорофилл а присутствует во всех фотосинтезирующих организмах. У всех высших расте ний содержится также хлорофилл b. Хлорофиллы с и d найдены в зеленых и бурых водорослях, в клетках цианобактерий. Хлорофилл f был открыт австралийскими учеными в 2010 году. Он был обнаружен в ископаемых остатках жизнедеятельности цианобактерий на дне мелководных водоемов. Установлено, что в отличие от других разновидностей хлорофилл f участвует в процессе фотосинтеза с использованием инфракрасного излучения. Распространенность хлорофилла f в экосистеме пока выяснена не полностью.

Витамин В12 группа биологически активных веществ имеющих тетрапиррольный цикл комплексно связанный с ионом кобальта. Четыре координационные связи кобальт образует с атомами азота, одну с нуклеотидом и одну с одной из группировок (CN, OH, CH3 или 5'-дезоксиаденозильный остаток) с образованием соответственно четырех вариантов витамина B12.
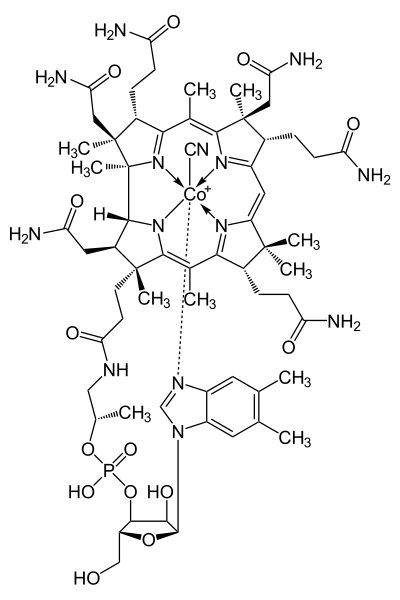
Ни животные, ни растения не способны синтезировать витамин В12. Это единственный витамин, синтезируемый почти исключительно микроорганизмами: бактериями и сине-зелеными водорослями. Из животных тканей наиболее богаты витамином В12 печень и почки. Этот витамин вырабатывается микроорганизмами в пищеварительном тракте любого животного, включая человека, как продукт деятельности микрофлоры, однако он не может усваиваться, так как образуется в толстой кишке и не может попасть в тонкую кишку. В пищевой промышленности многих стран витамин В12 искусственно добавляют в пищевые продукты.
