- •Вопрос 1.
- •Вопрос 2: Виды движений мт и атт: -поступательное; -вращательное вокруг неподвижной оси; - плоское; -движение вокруг неподвижной точки; -свободное движение.
- •Вопрос 3: движ под углом к горизонту
- •Вопрос 4: Траектория движения. Криволинейное движение. Нормальное и тангенциальное ускорения при криволинейном движении.
- •Вопрос 5: Вращательное движение. Угловая скорость и угловое ускорение. Кинематические уравнения для вращательного движения.
- •Вопрос 6: Связь между линейными и угловыми характеристиками мт и атт при их вращении вокруг точки или оси
- •Вопрос 7 Понятия динамики. Три закона Ньютона. Сила, импульс. Основное уравнение динамики поступательного движения. Силы в механике.
- •4)Гравитац. Сила
- •Вопрос 8: Инерциальные системы отсчета. Собственная и лабораторные исо. Механический принцип относительности Галилея. Преобразования Галилея.
- •Вопрос 9:Система материальных точек. Закон сохранения импульса. Абсолютно упругий и неупругие удары.
- •13. Силы упругости. Упругие деформации. Закон Гука. Потенциальная энергия в поле упругих сил
- •14. Силы трения. Уравнение динамики поступательного движения при наличии трения- на примере
- •15. Гравитационное взаимодействие. Сила всемирного тяготения. Сила тяжести и невесомостью. Фундаментальный физический закон Галилея
- •16.Работа гравитационных сил. Потенциал и напряженность гравитационного поля. Космические скорости.
- •17.Основные динамические характеристики движения
- •18.Вращательное движение. Момент импульса Lr и момент силы м мт относительно точки. Главный момент системы сил.
- •20. Уравнение моментов. Законы изменения и сохранения момента импульса при вращении мт вокруг точки и атт, закрепленного в одной точке
- •21. Пара сил. Центр тяжести (цт) механической системы
- •23. Закон изменения и сохранения момента импульса мт и атт. Скамья Жуковского.
- •24. Момент инерции мт и атт. Теорема Штейнера. Расчет момента инерции тонкого стержня.
- •Теорема Штейнера:
- •Вопрос 26 : Свободные гармонические механические колебания и их характеристики. Математический и физический маятники.
- •Вопрос 27: Векторная диаграмма и сложение одинаково направленных гармонических колебаний
- •28) Сложение взаимно перпендикулярных гармонических колебаний.
- •29) Дифференциальное уравнение свободных гармонических механических колебаний и его решение. Энергия колебаний. Физический маятник.
- •30) Затухающие гармонические колебания. Коэффициент затухания и логарифмический декремент затухания. Время релаксации.
- •31.Вынужденные колебания. Расчёт амплитуды и фазы
- •32. Резонанс механических колебаний
- •33. Уравнения упругих волн, плоской и сферической. Принцип суперпозиции волн. Фазовая и групповая скорости
- •34. Волновое уравнение и его решение. Физический смысл волнового уравнения. Скорость распространения волн в различных средах.
- •35. Звук. Распространение упругих волн в упругой среде. Характеристики упругих волн.
- •36. Волновой перенос энергии и его характеристики: поток, плотность потока, интенсивность. Вектор Пойтинга.
- •37. Границы применимости классической механики. Теория относительности. Постулаты Эйнштейна. Преобразования Лоренца.
- •39. Теорема сложения скоростей в сто.
- •40. Импульс в релятивистской механике.
- •41. Релятивистские законы Ньютона. Связь между энергией и импульсом частицы
- •43. Корпускулярно-волновой дуализм. Длина волны де Бройля. Квантование электронных орбит атома в модели де Бройля. Соотношения неопределенностей.
- •44. Предмет квантовой механики. Волновая функция, ее свойства и статистический смысл.
- •45. Временное и стационарное уравнение Шредингера. Решения.
- •46. Решение уравнения Шредингера для свободной частицы.
- •Вопрос 47: Уровни энергии и волновая функция частицы, находящейся в прямоугольной потенциальной яме.
- •48. Квантовый гармонический осциллятор.
- •50. Молекулярная физика, макросистемы и положения мкт. Идеальный газ. Эргодическая гипотеза. Постоянные в молекулярной физике. Основное уравнение молекулярно-кинетической теории – вывод.
- •51.Степени свободы молекул. Закон Больцмана о равномерном распределении энергии по степеням свободы. Внутренняя энергия идеального газа.
- •52. Эффективный диаметр, средние длина и время свободного пробега, число столкновений в единицу времени для молекул идеального газа.
- •53. Законы идеального газа, адиабатический процесс – вывод уравнения Пуассона.
- •54. Политропический процесс – вывод уравнения состояния.
- •55. Термодинамика. Термодинамические система и параметры, термодинамическое равновесие. Равновесный процесс. Внутренняя энергия – функция состояния.
- •56. Пути изменения внутренней энергии. Теплота и работа. Первое начало термодинамики. Работа расширяющегося газа.
- •58.Теплоёмкость идеального газа
- •Вопрос 59: Работа – функция процесса. Работа, совершаемая газом при изотермическом и изохорном процессах. Изохорический процесс
- •Вопрос 60:Работа – функция процесса. Работа, совершаемая газом при изобарическом процессе.
- •63. Второе начало термодинамики. Самопроизвольные и несамопроизвольные процессы. Равенство и неравенство Клаузиуса.
- •66. Третье начало термодинамики (теорема Нернста).
- •71.Эффект Джоуля- Томсона отрицательный
- •72. Эффект Джоуля-Томсона – положительный и интегральный.
- •75. Явления переноса: внутреннее трение.
- •76 Явления переноса: диффузия и теплопроводность
66. Третье начало термодинамики (теорема Нернста).
При
приближении к абсолютному нулю энтропия
системы также стремится к нулю независимо
от того, какие значения принимают все
остальные параметры состояния системы:
 -третье начало термодинамики. Поскольку
энтропия равна:
-третье начало термодинамики. Поскольку
энтропия равна:
 , а температура Т стремится к нулю,
теплоемкость вещества также должна
стремиться к нулю,причем быстрее,чем
Т. От следует сюда недостижимость
абсолютного нуля температуры при
конечной последовательности
термодинамических процессов, т. е.
конечного числа операций − циклов
работы холодильной машины.
, а температура Т стремится к нулю,
теплоемкость вещества также должна
стремиться к нулю,причем быстрее,чем
Т. От следует сюда недостижимость
абсолютного нуля температуры при
конечной последовательности
термодинамических процессов, т. е.
конечного числа операций − циклов
работы холодильной машины.
67 Термодинамические функции и потенциалы.
Характеристические функции в ТД, убыль которых в равновесных процессах, протекающих при постоянстве значений соответств. независимых параметров, равна полезной внешней работе.
Выделяют ТД потенциалы:
-внутр. энергия: U=Q-A
-энтальпия: H=E=U+PV
-свободная энергия Гельмгольца: F=U-TS
-потенциал Гиббса: G=U+PV-TS
-большой ТД потенциал: Ω=U-TS-μN=F-μN
68. Понятие статистического распределения, функция распределения. Распределение Максвелла молекул газа по вектору скорости.
Функция распределения молекул по скоростям – функция f, зависящая от модуля скорости v

Cтатистическое распределение – это описание (в виде ф., таблицы или текста) того, насколько вероятно то, что случайная величина примет то или иное значение.
Ф. распред. Максвелла молекул газа по скоростям:

69. Барометрическая формула. Понятие статистического распределения, функция распределения. Распределение Больцмана.
Барометрическая ф-ла
p )
)
Если частица идеального газа наход-ся в силовом поле,то реализ-ся оба распред-я частиц:Максвелла и Больцмана.

70. Реальный газ. Уравнение и изотермы Ван-дер-Ваальса. Критические температуры.
Реальный газ – газ, который не описывается уравнением состояния идеального газа Менделеева – Клапейрона. Модель идеального газа пригодна для реального только при высоких температурах и низких давлениях, когда можно пренебречь размерами молекул и их взаимодействием.
Термическим уравненим состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]() ,
,
Поправка ![]() учитывает
притяжение молекул, поправка
учитывает
притяжение молекул, поправка ![]() —
объём занимаемый молекулами.
—
объём занимаемый молекулами.
Для ![]() молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
![]() .
.
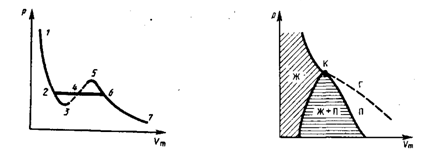
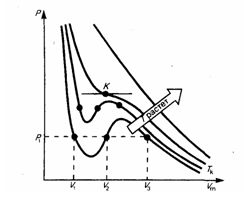
Изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса для моля газа. Эти кривые имеют довольно своеобразный характер. При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Tкна изотерме имеется лишь одна точка перегиба К.
Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк, и давление рк называются также критическими. Состояние с критическими параметрами (pк, Vк, Tк) называется критическим состоянием. При низких температурах (Т < Tк ) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Рассматривая различные участки изотермы при T<Тк (рис. внизу), видим, что на участках 1—3 и 5—7 при уменьшении объема Vm давление р возрастает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—1. Часть 6–7 отвечает газообразному состоянию, а часть 2–1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.