
- •Розділ 1. Вплив антропогенної діяльності на стан атмосферного повітря
- •1.1. Основні види забруднень атмосферного повітря
- •1.2. Джерела забруднення атмосферного повітря
- •1.3. Вплив забрудненого атмосферного повітря на живі організми
- •Розділ 2. Нормативно-правова база з охорони атмосферного повітря
- •2.1 Міжнародні угоди, що обмежують забруднення повітря середовища
- •2.2. Міжнародні організації, які контролюють стан атмосферного повітря
- •2.3. Основні законодавчі акти України присвоєнні охороні атмосферного повітря
- •2.4. Роль держави у охороні атмосферного повітря
- •2.5. Питання з охорони атмосферного повітря, що вирішуються на рівні органів місцевого самоврядування
- •Розділ 3. Заходи зменшення впливу викидів промислових підприємств на стан атмосферного повітря
- •3.1. Організаційні заходи
- •3.2. Архітектурно-будівельні заходи
- •3.3 Засоби очистки викидів виробництва
- •Розділ 4. Вплив сірчанокислотної промисловості на стан атмосферного повітря
- •4.1. Технологічна схема виробництва
- •4.3.Характеристика основних забруднюючих речовин та їх вплив на людину
- •4.4. Засоби очищення викидів, що можуть бути використані для забруднюючих речовин що викидаються сірчанокислотною промисловістю
- •5.1. Загальна характеристика, принцип роботи пінних пиловловлювачів
- •5.2. Переваги та недоліки пінних пиловловлювачів
- •5.3. Види пінних пиловловлювачів та їх застосування
- •5.4. Доцільність використання пінних пиловловлювачів у сірчанокислотній промисловості
- •Висновки
Розділ 4. Вплив сірчанокислотної промисловості на стан атмосферного повітря
4.1. Технологічна схема виробництва
Сірчанокислóтна промислóвість, одна з основних галузей хімічної промисловості, яка виробляє сірчану кислоту.
Виробництво сульфатної кислоти:
Сульфатну кислоту добувають двома різними методами: контактним і нітрозним. Незалежно від методу добування, завжди присутні три основні етапи:
— добування SO2;
— окиснення SO2 в SO3;
— добування сульфатної кислоти.
Сульфітний ангідрид SO2 зазвичай добувають випалом піриту (FeS2) як побічний продукт при виплавці заліза. Замість піриту використовують також деякі інші сульфіди (CdS, ZnS) або сірководень, виділений із природного газу та нафти чи отриманий при коксуванні вугілля. Іноді використовують просту речовину сірку.
Контактний метод добування сульфатної кислоти:
Перед випалом пірит подрібнюють для прискорення горіння. Для збільшення виходу сульфітного ангідриду в піч для випалу піриту додатково подають надлишок кисню. Проходить така реакція:
![]()
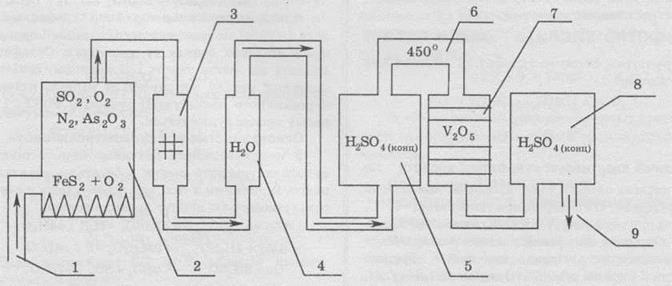
Схема промислової установки для виробництва сульфатної кислоти
Процес роботи цієї установки полягає ось у чому. У печі (2) відбувається спалювання піриту. Кисень для горіння подають через трубу (1). Оскільки в природному мінералі піриту міститься близько 20% домішок, то після випалу, звісно ж, у газах також будуть домішки. Однією з таких домішок є арсен(ІІІ) оксид. Ця сама по собі небезпечна для навколишнього середовища речовина є каталітичною отрутою, тобто вона порушує роботу каталізатора. Для вилучення цієї шкідливої домішки газову суміш пропускають через спеціальні електричні фільтри (3) та промивну башту з водою (4). Після промивання водою суміш стає вологою, і, задля вилучення домішок води, суміш пропускають через колонку з концентрованою сульфатною кислотою (5), яка ефективно поглинає вологу. Далі газову суміш нагрівають у теплообміннику (6) до температури 450°, і суміш потрапляє в контактний апарат (7), в якому перебуває каталізатор V2O5 (у ролі каталізатора іноді використовують також ванадил сульфат VOSO4, платину або срібло). Після цього утворений сульфур триоксид розчиняють у концентрованій сульфатній кислоті (8), внаслідок чого утворюється олеум, яким заповнюють цистерни за допомогою виводу готового продукту (9).
Нітрозний метод добування сульфатної кислоти:
Близько 20% сульфатної кислоти, яку виробляють у світі, добувають нітрозним, або баштовим, методом. У цьому методі окиснення SO2 в SO3 здійснюється нітроген діоксидом NO2:
![]()
Нітроген діоксид в цьому методі регенерується за допомогою кисню повітря й знову вступає в реакцію окиснення сульфур(ІV) оксиду:
![]()
4.2. Основні джерела утворення забруднюючих речовин
- Спеціальні печі, де відбувається випалювання сірчаного колчедану FeS2 та інших сульфідних руд. При випалюванні , що протікає в « киплячому шарі » , що виходить оксид металу , наприклад Fe2O3 , виділяється в атмосферу: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Це можна пояснити тим , що для апаратів випалу в « киплячому шарі » потрібно порошок руди , що піддався сильному подрібненню . В результаті випалення утворюється оксид заліза або іншого металу з дуже маленькими частинками. З уловлюванням цих частинок фільтри можуть не впоратися. Частинки оксиду можуть потрапити в атмосферу при вивантаженні з печі. Попадання в атмосферу подрібнених оксидів заліза або інших металів називають металізацією атмосфери.
При виробництві сірчаної кислоти в атмосферу потрапляє багато оксиду сірки ( IV) :
2SO2 + O2 = 2SO3
Це пов'язано з тим , що виробничі установки не завжди герметичні, а також з тим , що іноді автоматичні системи управління не справляються з роботою , що призводить до аварійних викидів.
- Для виробництва сірчаної кислоти нерідко використовується сірка , одержувана з сірководню (це речовина є відходом ряду виробництв) . Виробляється сірка за допомогою неповного окислення сірководню. Ця технологічна схема недосконала - близько 20 % сірки йде на утворення оксиду сірки ( IV) , який виділяється в атмосферу. У ході виробництва можливі викиди в атмосферу оксиду сірки ( VI) та сірчаної кислоти : SO 3 + H 2 O = H2SO4
Некомплексне використання сировини
Застаріле обладнання
