
- •Гипотеза Планка
- •Виды фотоэлектрического эффекта.Законы внешнего фотоэффекта
- •§ 203. Уравнение Эйнштейна для внешнего фотоэффекта. Экспериментальное подтверждение квантовых свойств света
- •История открытия
- •Внешний фотоэффект
- •Законы внешнего фотоэффекта
- •Теория Фаулера
- •Квантовый выход
- •Внутренний фотоэффект
- •Вентильный фотоэффект
- •Фотовольтаический эффект
- •Ядерный фотоэффект
- •Современные исследования
- •Коэффициент полезного действия
- •Другие похожие показатели
- •Кпд котлов
- •Тепловые насосы и холодильные машины
- •Формулировка
- •[Править] Следствия [править] Недостижимость абсолютного нуля температур
- •[Править] Поведение термодинамических коэффициентов
- •[Править] Нарушения третьего начала термодинамики в моделях
- •Принцип действия тепловой машины. Коэффициент полезного действия тепловых машин
- •[Править]Обратный эффект Комптона
- •Нульмерные дефекты
- •[Править]Термодинамика точечных дефектов
- •[Править]Миграция точечных дефектов
- •[Править]Источники и стоки точечных дефектов
- •Комплексы точечных дефектов
- •Одномерные дефекты
- •Двумерные дефекты]
- •Трёхмерные дефекты
- •Методы избавления от дефектов
- •Полезные дефекты
- •Постулаты Бора
- •§4 Опыты Франка и Герца
- •Спектр атома водорода по Бору
- •Собственная и примесная проводимость полупроводников
- •Физическая природа
- •Применение
- •Основное уравнение мкт
- •Вывод основного уравнения мкт
- •Уравнение среднеквадратичной скорости молекулы
- •Давление газа
- •Состояние физической системы
- •Примеры
- •Обобщённые координаты
- •Примеры
- •Степени свободы в статистической физике и термодинамике
- •Вымораживание степеней свободы
- •Степени свободы молекулы
- •Формулировка
- •Изобарный процесс
- •Изохорный процесс
- •Изотермический процесс
- •Изоэнтропийный процесс
- •1.Статистический и термодинамический методы
- •2.Молекулярно-кинетическая теория идеальных газов
- •2.1.Основные определения
- •2.2.Опытные законы идеального газа
- •2.3.Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
- •2.5.Распределение Максвелла
- •2.6.Распределение Больцмана
- •3.Термодинамика
- •3.1.Внутренняя энергия. Закон равномерного распределения энергии по степеням свободы
3.Термодинамика
3.1.Внутренняя энергия. Закон равномерного распределения энергии по степеням свободы
Внутренняя энергия U - энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц. К внутренней энергии не относится кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.Внутренняя энергия - однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенной (единственной) энергией. Внутренняя энергия не зависит от того, как система пришла в данное состояние: при переходе из состояния (1) в состояние (2) изменение внутренней энергии DU определяется только разностью значений внутренней энергии этих состояний DU = U1 - U2 и не зависит от пути перехода.
Число степеней свободы системы i - это число независимых переменных (координат), полностью определяющих положение системы в пространстве:
- Одноатомная молекула идеального газа имеет три степени свободы поступательного движения, т.е. i=3.
- Двухатомная молекула идеального газа имеет три степени поступательного движения и две степени свободы вращательного движения, т.е. i=5.
- Трехатомная молекула (и вообще нелинейная многоатомная молекула) идеального газа имеет три степени поступательного движения и три степени вращательного движения, т.е. i=6.
- Для реальных молекул следует учитывать также степени свободы колебательного движения.
- Независимо от числа степеней свободы молекул три степени свободы всегда поступательные; ни одна из поступательных степеней свободы не имеет преимущества перед остальными.
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул:
для системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень - в среднем энергия, равная kT (на колебательную степень свободы приходится не только кинетическая энергия, но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы). Таким образом, средняя энергия молекулы Е> = ikT/2, где i - сумма числа поступательных iпост, числа вращательных iвращ и удвоенного числа колебательных iколеб степеней свободы молекулы i = iпост + iвращ + 2iколеб. Для идеального газа i совпадает с числом степеней свободы молекулы.
Внутренняя энергия 1 моль идеального газа равна сумме кинетических энергий NA молекул
Um = ikTNA = iRT/2, (1a)
и изменение внутренней энергии 1 моль идеального газа dUm =(iR/2)dT (1b)
(молекулы между собой не взаимодействуют и поэтому взаимная потенциальная энергия молекул газа равна нулю).
Внутренняя энергия произвольной массы m идеального газа U = (m/M)(iRT/2)=n(iRT/2), где М - молярная масса (масса одного моля), n = m/M - количество вещества.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплотыδQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельная теплоёмкость
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая теплоёмкость (С) — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Теплоёмкость для различных состояний вещества
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме (для одного моля идеального газа) равна:
![]()
где R ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная.
А при постоянном давлении
![]()
Удельные теплоёмкости многих веществ приведены в справочниках обычно для процесса при постоянном давлении. К примеру, удельная теплоёмкость жидкой воды при нормальных условиях — 4200 Дж/(кг·К); льда — 2100 Дж/(кг·К).
Теория теплоёмкости
Сравнение моделей Дебая и Эйнштейна для теплоёмкости твёрдого тела
Существует несколько теорий теплоёмкости твердого тела:
Закон Дюлонга — Пти и закон Джоуля — Коппа. Оба закона выведены из классических представлений и с определенной точностью справедливы лишь для нормальных температур (примерно от 15 °C до 100 °C).
Квантовая теория теплоёмкостей Эйнштейна. Первое применение квантовых законов к описанию теплоёмкости.
Квантовая теория теплоёмкостей Дебая. Содержит наиболее полное описание и хорошо согласуется с экспериментом.
Теплоёмкость системы невзаимодействующих частиц (например, газа) определяется числом степеней свободы частиц.
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В
соответствии с сущностью понятия
теплоёмкости ![]() ,
предельными частными явлениями
политропного процесса являются изотермический
процесс (
,
предельными частными явлениями
политропного процесса являются изотермический
процесс (![]() )
и адиабатный
процесс (
)
и адиабатный
процесс (![]() ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными ?.
Показатель политропы
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:
![]()
где р — давление, V — объем газа, n — «показатель политропы».
![]() .
Здесь
—
теплоёмкость газа в данном процессе,
.
Здесь
—
теплоёмкость газа в данном процессе, ![]() и
и ![]() —
теплоемкости того же газа, соответственно,
при постоянном давлении и объеме.
—
теплоемкости того же газа, соответственно,
при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
Изотермический процесс:
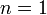 ,
так как
,
значит, по закону
Бойля — Мариотта
,
и уравнение политропы вынуждено
выглядеть так:
,
так как
,
значит, по закону
Бойля — Мариотта
,
и уравнение политропы вынуждено
выглядеть так: 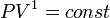 .
.
Изобарный процесс:
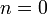 ,
так как
,
и уравнение политропы вынуждено
выглядеть так:
,
так как
,
и уравнение политропы вынуждено
выглядеть так: 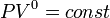 .
.
Адиабатный процесс:
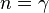 (здесь
— показатель
адиабаты),
это следует из уравнения
Пуассона.
(здесь
— показатель
адиабаты),
это следует из уравнения
Пуассона.
Изохорный процесс:
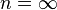 ,
так как
,
и в процессе
,
так как
,
и в процессе 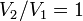 ,
а из уравнения политропы следует, что
,
а из уравнения политропы следует, что 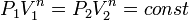 ,
то есть, что
,
то есть, что  ,
то есть
,
то есть 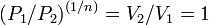 ,
а это возможно, только если
является
бесконечным.
,
а это возможно, только если
является
бесконечным.
Термодинами́ческие ци́клы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия), совпадают.
Термодинамические циклы являются моделями процессов, происходящих в реальных тепловых машинах для превращения тепла в механическую работу.
Компонентами любой тепловой машины являются рабочее тело, нагреватель и холодильник (с помощью которых меняется состояние рабочего тела).
Обратимым называют цикл, который можно провести как в прямом, так и в обратном направлении в замкнутой системе. Суммарная энтропиясистемы при прохождении такого цикла не меняется. Единственным обратимым циклом для машины, в которой передача тепла осуществляется только между рабочим телом, нагревателем и холодильником, является Цикл Карно. Существуют также другие циклы (например, цикл Стирлинга ицикл Эрикссона), в которых обратимость достигается путём введения дополнительного теплового резервуара — регенератора. Общим (т.е. указанные циклы частный случай) для всех этих циклов с регенерацией является Цикл Рейтлингера. Можно показать (см. статью Цикл Карно), что обратимые циклы обладают наибольшей эффективностью.
Основные принципы
Прямое преобразование тепловой энергии в работу запрещается постулатом Томсона (см. Второе начало термодинамики). Поэтому для этой цели используются термодинамические циклы.
Для того, чтобы управлять состоянием рабочего тела, в тепловую машину входят нагреватель и холодильник. В каждом цикле рабочее тело забирает некоторое количество теплоты ( ) у нагревателя и отдаёт количество теплоты холодильнику. Работа, совершённая тепловой машиной в цикле, равна, таким образом,
![]() ,
,
так
как изменение внутренней энергии ![]() в
круговом процессе равно нулю (это функция
состояния).
в
круговом процессе равно нулю (это функция
состояния).
Напомним, что работа не является функцией состояния, иначе суммарная работа за цикл также была бы равна нулю.
При этом нагреватель потратил энергию . Поэтому тепловой, или, как его ещё называют, термический или термодинамический коэффициент полезного действия тепловой машины (отношение полезной работы к затраченной тепловой энергии) равен
![]() .
.
Вычисление работы и КПД в термодинамическом цикле
Работа в термодинамическом цикле, по определению, равна
![]() ,
,
где ![]() —
контур цикла.
—
контур цикла.
C другой стороны, в соответствии с первым началом термодинамики, можно записать
![]() .
.
Аналогичным образом, количество теплоты, переданное нагревателем рабочему телу, равно
![]() .
.
Отсюда видно, что наиболее удобными параметрами для описания состояния рабочего тела в термодинамическом цикле служат температура и энтропия.
[править]Цикл Карно и максимальный КПД тепловой машины
Основная статья: Цикл Карно.
Цикл Карно в координатах T и S
Представим себе следующий цикл:
Фаза
А→Б.
Рабочее тело с температурой, равной
температуре нагревателя, приводится в
контакт с нагревателем. Нагреватель
сообщает рабочему телу ![]() тепла
в изотермическом процессе (при постоянной
температуре), при этом объём рабочего
тела увеличивается.
тепла
в изотермическом процессе (при постоянной
температуре), при этом объём рабочего
тела увеличивается.
Фаза Б→В. Рабочее тело отсоединяется от нагревателя и продолжает расширяться адиабатически (без теплообмена с окружающей средой). При этом его температура уменьшается до температуры холодильника.
Фаза
В→Г.
Рабочее тело приводится в контакт с
холодильником и передает ему ![]() тепла
в изотермическом процессе. При этом
объём рабочего тела уменьшается.
тепла
в изотермическом процессе. При этом
объём рабочего тела уменьшается.
Фаза Г→А. Рабочее тело адиабатически сжимается до исходного размера, и его температура увеличивается до температуры нагревателя.
Его КПД равен, таким образом,
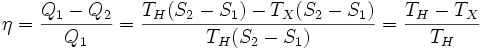 ,
,
то есть, зависит только от температур холодильника и нагревателя. Видно, что 100%-ный КПД можно получить только в том случае, если температура холодильника есть абсолютный нуль, что недостижимо.
Можно показать, что КПД тепловой машины Карно максимален в том смысле, что никакая тепловая машина с теми же температурами нагревателя и холодильника не может обладать бо́льшим КПД.
Заметим, что мощность тепловой машины Карно равна нулю, так как передача тепла в отсутствие разности температур идёт бесконечно медленно.
