
- •Аналитические возможности и области применения потенциометрического титрования
- •Причины ошибок в методе прямой потенциометрии:
- •Потенциометрическое титрование. Метод Грана.
- •Метод потенциометрического титрования.
- •Прямая потенциометрия в аналитической химии. Метод добавок.
- •11. Основные исэ на основе жидких мембран и их применение в анализе
- •12. Основные исэ на основе осадочных мембран и их применение
- •13. Основные исэ на основе стеклянных мембран и их применение
- •14. Механизм и движущие силы возникновения скачка потенциала на границе раздела фаз. Уравнение Нернста и отклонения от него
- •15. Электроды сравнения в потенциометрии. Диффузионный потенциал.
- •16. Уравнение Никольского и отклонения от него.
14. Механизм и движущие силы возникновения скачка потенциала на границе раздела фаз. Уравнение Нернста и отклонения от него
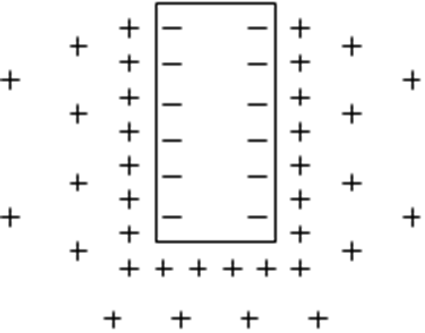
Металл начнет переходить в раствор в виде катионов. Вследствие этого на пластинке будет накапливаться отрицательный заряд, так как электроны не переходят в раствор. Отметим, что превалирующий переход катионов в другую фазу характерен только для полярных жидкостей и объясняется большей выгодностью сольватации катионов, чем электронов.
По мере протекания процесса заряд на пластинке увеличивается, и переход в раствор новых катионов становится все менее выгодным.
С другой стороны, раствор заряжается все более положительно и начинает выталкивать катионы на поверхность металлической пластинки. Установившееся равновесие характеризуется равенством скоростей перехода катионов из раствора на пластинку металла и перехода катионов из пластинки в раствор. При изменении условий нахождения металла в растворе равновесие будет нарушаться, а при возвращении в первоначальные условия равновесие будет возвращаться в исходное состояние. Данное равновесие называется обратимостью электрода.
Вблизи границы с металлической пластинкой концентрация катионов высока. Значительное количество катионов находится в первом ряду, непосредственно прилегающем к поверхности металла, образуя положительную обкладку двойного электрического слоя.
В результате такого процесса между
пластинкой и раствором возникает
разность потенциалов. Эта разность
является следствием протекания
электрохимической реакции:
результате такого процесса между
пластинкой и раствором возникает
разность потенциалов. Эта разность
является следствием протекания
электрохимической реакции:

Уравнение Нернста:
В области высоких концентраций, а иногда и в области низких концентраций практически всегда наблюдается потеря чувствительности к определяемому иону и отклонение от нернстовской зависимости.
15. Электроды сравнения в потенциометрии. Диффузионный потенциал.
Для применения потенциометрического метода кроме индикаторных электродов необходимы электроды сравнения, т.е. электроды, которые имеют определенный потенциал, не зависящий от концентрации анализируемого раствора. Наиболее распространены два типа электродов сравнения: 1) хлорсеребряный электрод сравнения, 2) каломельный электрод сравнения.
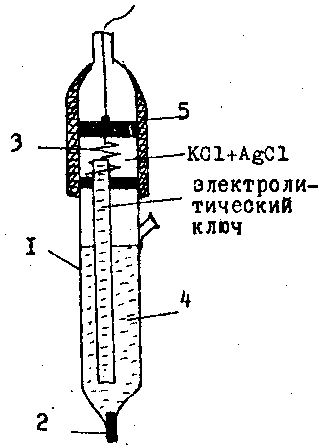 |Ag
, АgCl| KCl ¦
|Ag
, АgCl| KCl ¦
 Hg,
Hg2Cl2
KCl
¦ (NH4)2SO4
¦
Hg,
Hg2Cl2
KCl
¦ (NH4)2SO4
¦
Вообще механизм возникновения диффузионного потенциала вы знаете. Дело в том, что ионы внутреннего электролита движутся в анализируемый раствор, и катион может двигаться быстрее, чем анион или наоборот. Если катион движется быстрее, то раствор будет заряжаться положительно, а внутренний раствор – отрицательно.
Обратная ситуация: если, например, в анализируемом растворе будет НСl, то ионы Н+ будут быстрее проникать во внутренний раствор, поскольку обладают большей подвижностью, чем хлорид-ионы. В результате возникает диффузионный потенциал, при котором внутренний раствор заряжается положительно, а анализируемый – отрицательно.
Очевидно, что состав анализируемого раствора будет влиять на величину диффузионного потенциала, а это допустить нежелательно, поскольку диффузионный потенциал будет искажать картину. Нам необходимо точно измерить потенциал, чтобы определить концентрацию. А отягощение его нестабильным, плохо поддающимся предсказанию диффузионным потенциалом, крайне нежелательно.
