
- •Аналитические возможности и области применения потенциометрического титрования
- •Причины ошибок в методе прямой потенциометрии:
- •Потенциометрическое титрование. Метод Грана.
- •Метод потенциометрического титрования.
- •Прямая потенциометрия в аналитической химии. Метод добавок.
- •11. Основные исэ на основе жидких мембран и их применение в анализе
- •12. Основные исэ на основе осадочных мембран и их применение
- •13. Основные исэ на основе стеклянных мембран и их применение
- •14. Механизм и движущие силы возникновения скачка потенциала на границе раздела фаз. Уравнение Нернста и отклонения от него
- •15. Электроды сравнения в потенциометрии. Диффузионный потенциал.
- •16. Уравнение Никольского и отклонения от него.
Аналитические возможности и области применения потенциометрического титрования
Потенциометрическое титрование при прочих равных условиях имеет ряд преимуществ по сравнению с визуальными титриметрическими методами анализа. Метод потенциометрического титрования более чувствителен, при использовании его исключается субъективная ошибка, возникающая при визуальном нахождении момента завершения химической реакции, т. е. конечной точки титрования. Этот метод дает возможность определять вещества в мутных и сильно окрашенных растворах, дифференцированно (раздельно) титровать компоненты смеси веществ в одной и той же порции раствора и, наконец, автоматизировать процесс титрования, так как измеряемой величиной является электрический параметр.
Потенциометрическое титрование может быть с успехом применено не только для титрования растворов, к которым применим индикаторный метод, но и для титрования окрашенных и мутных растворов, когда индикаторные методы титрования применить нельзя. Потенциометрическое титрование широко применяют для определения слабых и очень слабых кислот и оснований, смесей кислот или оснований, смесей окислителей или восстановителей в неводных средах.
На практике потенциометрическое титрование широко применяют при определении серы и ее соединений в нефтепродуктах и горных породах, а также в анализе технологических растворов, объектов окружающей среды, лекарственных препаратов и биообъектов.
Ферментные и газовые ионоселективные электроды (ИСЭ), ионоселективные полевые транзисторы
Ферментные электроды (биосенсоры).
Группа электродов с двойной мембраной. Эти электроды используют чрезвычайно высокую избирательность сложных веществ биологического происхождения катализировать ту или иную реакцию.
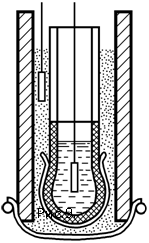
1 – стеклянный электрод; 2 – слой геля, содержащий фермент; 3 – анализируемый раствор; 4 – электрод сравнения.
Газовые электроды.
Электроды с двойной мембраной.
Газовые электроды – это электроды, как правило, на CO2, NO2, SO3 и NO3. Суть действия газовых электродов заключается в изменении рН при попадании газов в приэлектродное пространство.
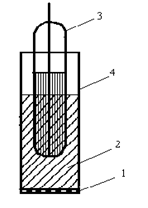
1 – газопроницаемая мембрана; 2 – внутренний буферный раствор с небольшой буферной емкостью; 3 – Н+ -электрод или NH4+-электрод; 4 – корпус.
Если пару электродов подключить к измерительному стрелочному прибору, то он покажет ноль, т.е. все напряжение будет падать внутри электрода, а чтобы его измерить, надо чтобы оно падало на стрелочном приборе. Поэтому был совмещен прибор, который обладает высоким входным сопротивлением, и усиливающее его устройство – кремниевый транзистор с электродом.
Между базой и эмиттером транзистора подключается пара электродов. Сигнал входит, подается на базу, а снимается усиленным в коллекторно-эмиттерной цепи. Тогда ток электрода, имеющего высокое входное сопротивление, включенного в цепь с высоким внутренним сопротивлением (базо-эмиттерная цепь полевого транзистора), может быть измерен в низкоомной цепи уже обычным стрелочным прибором.
Ошибки в потенциометрии и методы их снижения
Причины ошибок в методе прямой потенциометрии:
1) неточность измерения потенциала измерительной техникой.
2) температурный и концентрационный дрейф индикаторных электродов и электродов сравнения – постоянное изменение потенциала в ту или иную сторону (+ 5%).
3) эффект ионной силы раствора. Обязательный прием при точных измерениях – разбавление фоном градуировочных растворов и анализируемого раствора.
4) рН: стабилизируют буферными растворами, инертными к определяемому электроду, и в то же время создающими нужную ионную силу.
5) действие комплексообразования.
Аналитические возможности и области применения прямой потенциометрии
Прямая потенциометрия обладает важными достоинствами. В процессе измерений состав анализируемого раствора не меняется. При этом, как правило, не требуется предварительного отделения определяемого вещества. Метод можно легко автоматизировать, что позволяет использовать его для непрерывного контроля технологических процессов.
Прямую потенциометрию используют для определения растворенного в воде кислорода, фторидов и цианидов в сточных водах, нитратов в почвах и пищевых продуктах, а также для определения некоторых органических веществ. Важнейшим применением потенциометрии является измерение рН с использованием стеклянного электрода.
Классификация ИСЭ
Ионоселективные электроды преимущественно по агрегатному состоянию мембраны могут быть подразделены на следующие группы:
а) металлические электроды;
б) электроды с осадочной или стеклянной мембранами;
в) электроды с жидкой мембраной;
г) пленочные ионоселективные электроды;
д) газовые и ферментные электроды;
е) ионоселективные полевые транзисторы.
Методы измерения ЭДС в потенциометрии. Потенциометры, ионометры, pH-метры.
Как правило, ячейки с ионоселективными электродами имеют высокое сопротивление, порядка 108 Ом. Для измерения потенциала в таких случаях необходим электронный вольтметр с входным сопротивлением на несколько порядков выше сопротивления ячейки. В противном случае от ячейки будет отводиться заметный ток, и измеренное значение потенциала нельзя будет приравнять к значению равновесного потенциала.
В аналитических лабораториях используют серийно выпускаемые цифровые вольтметры или вольтметры со шкалой, калиброванной в мВ и единицах pH. Эти приборы, называемые иономерами или pH-метрами, имеют входное сопротивление до 1012 Ом.
Для более точных измерений потенциала применяют компенсационную схему Поггендорфа.
Идеальным способом измерения э. д. с. гальванического элемента (потенциометрической ячейки) является компенсационный метод Поггендорфа, в котором на электроды в потенциометрической ячейке с помощью делителя напряжения налагают напряжение (V) от внешнего источника постоянного тока, противоположно направленное э. д. с. ячейки. При этом в момент, когда ток в цепи отсутствует, градиенты э. д. с. и V равны между собой. Задача заключается, следовательно, в постепенном изменении напряжения до тех пор, пока через ячейку не перестанет проходить ток, что можно проследить каким-либо индикатором тока. Второй задачей является определение величины налагаемого напряжения, отвечающего данному моменту, что также можно осуществить с помощью измерителя напряжения (вольтметра). Таким образом, когда в цепи отсутствует ток , согласно уравнению (где разность представляет собой э. д. с. потенциометрической ячейки), напряжение V равно э. д. с.
