
- •Розділ 1. Загальні поняття і визначення фізико-хімічної механіки дисперсних систем
- •1.1 Предмет фізико-хімічної механіки
- •. Загальні поняття про дисперсні системи
- •За агрегатним станом фаз
- •II. За інтенсивністю молекулярних взаємодій на границі поділу фаз ( за концентрацією дисперсної фази )
- •III. За ознакою наявності або відсутності хаотичної просторової сітки (типом структури)
- •Дисперсні структури
- •Іv. За розміром частинок дф.
- •Властивості дисперсних і молекулярних систем
- •1.4. Загальні поняття про поверхневі явища в дисперсних системах
- •1.5. Стійкість дисперсних систем
- •1.6. Методи регулювання ліофільності дисперсних систем
Іv. За розміром частинок дф.
Діаметр частинок |
1 мкм |
0,1…1 мкм |
0,1 мкм |
система |
грубодисперсна |
з проміжною дисперсністю |
колоїдно- дисперсна |
Властивості дисперсних і молекулярних систем
Таблиця 2.3
Грубодисперсні |
Колоїдно-дисперсні |
Молекулярні та іонні розчини (істинні) |
Непрозорі, відбивають світло |
Прозорі, розсіюють світло |
Прозорі, не розсіюють світло |
Частинки не проходять через паперовий фільтр |
Частинки проходять через паперовий фільтр |
Частинки проходять через паперовий фільтр |
Гетерогенні |
Гетерогенні |
Гомогенні |
Нестійки |
Відносно стійки |
Цілком стійки |
Частинки видимі в оптичний мікроскоп |
Частинки видимі в електронний мікроскоп |
Частинки невидимі у сучасні мікроскопи |
Властивості дисперсних систем істотно відрізняються саме завдяки розмірам їх складових частинок. До грубодисперсних систем відносяться цементобетони, асфальтобетони, пластмаси та інші. До колоїдно-дисперсних систем відносяться глини, цементи в стадії гідратації, нафтові бітуми та інші.
Гетерогенність – це неоднорідність походження та властивостей компонентів, що складають дисперсні системи. Не зважаючи на достатньо малі розміри дисперсних колоїдних частинок для них характерна агрегативна нестійкість. Завдання технології полягає або у забезпеченні стійкості (емульсії, однорідні вапняні та цементні розчини, зв’язні бетонні суміші) або у її руйнуванні, тобто забезпеченні коагуляції частинок (одержання керамічної цегли, цементного клінкера спіканням, розпад емульсій, коагуляція асфальтенових комплексів, міцел).
Багато природних і штучних "напівтвердих" або "напіврідких" гетерогенних систем є періодичними колоїдними системами (ПКС). ПКС –системи, які складаються з мікрооб’єктів, що взаємодіють на відстані, значно більшій, ніж розміри атомів Наприклад: глини, грунти, керамічна маса, цементні пасти, бітуми тощо. Залежно від величини прикладеного навантаження і часу його дії ПКС здатні поводитись, як пружні тверді тіла або як легкотекучі рідини, після зняття навантаження їх міцність відновлюється.
Особливістю ПКС є певний ступінь впорядкування розташованості їх структурних елементів. Просторова сітка багатьох ПКС є правильна квазікристалічна гратка, у якій, подібно до граток реальних кристалів є спотворення.
Отже, ПКС – це пластичні або квазіпластичні тверді тіла із характерним для них сполученням міцності, пружності, пластичності і в’язкості. Міцність системи залежить від енергії зв’яку між частинками, обумовленою їх формою, природою, розміром, а також властивостями адсорбційних шарів.
1.4. Загальні поняття про поверхневі явища в дисперсних системах
Явища, що відбуваються на поверхні поділу фаз у ДС, називаються поверхневими. Це концентрація енергії, адсорбція, змочуваність, адгезія тощо.
Концентрація енергії. Молекули поверхневого шару будь-якої рідини володіють вільною надлишковою енергією порівняно з молекулами, що є в об’ємі системи. Її співвідносять до 1 см2 поверхні рідини і називають питомою поверхневою енергією. Ця енергія називається вільною, тому що її можна використати для здійсненя механічної роботи. Крім того, її можна розглядати як енергію активації всіх молекул в 1 см2 поверхневого шару.
Питома поверхнева енергія (f) розраховується на одиницю площі поверхневого шару:
|
(1.2) |
де Е – енергія всієї системи;
Е1,
Е
2
– енергія фаз 1 і 2 без врахування
поверхневих явищ, тобто за умови, що
обидві фази однорідні до геометричної
поверхні поділу
![]() .
.
Е
1
Е
2
Фаза 1
Фаза 2











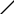














![]() може бути названа згущенням енергії в
поверхневому шарі (заштрихована площа
на рис 1.2). Виникнення такого згущення
зумовлено тим, що енергія молекул
поверхневого шару не скомпенсована
сусідніми молекулами як в об’ємах фаз,
дає рівнодійну, відмінну від нуля і
направлену в глиб полярної фази.
може бути названа згущенням енергії в
поверхневому шарі (заштрихована площа
на рис 1.2). Виникнення такого згущення
зумовлено тим, що енергія молекул
поверхневого шару не скомпенсована
сусідніми молекулами як в об’ємах фаз,
дає рівнодійну, відмінну від нуля і
направлену в глиб полярної фази.


Р
 ис.2
Схема визначення поверхневої енергії.
ис.2
Схема визначення поверхневої енергії.
E
= f 


h-товщина шару
Р
Робота, яку необхідно виконати для подолання відповідного внутрішнього тиску при збільшенні поверхні поділу на одиницю площі, тобто робота перенесення в поверхневий шар необхідної кількості молекул із двох фаз, визначає величину поверхневої енергії. Вільна поверхнева енергія, що вимірюється роботою оборотнього ізотермічного утворення поверхневого шару, дорівнює f . При цьому f=σ, оскільки питома вільна поверхнева енергія називається також поверхневим натягом:
|
(1.3) |
де
![]() -
вільна енергія молекул в поверхневому
шарі;
-
вільна енергія молекул в поверхневому
шарі;
![]() -
енергія тих самих молекул у відповідних
об’ємних частинах системи. Змочуваність.
Поверхневі
процеси в ДС супроводжуються змочуванням,
яке спостерігається на границі поділу
фаз, одна з яких, переважно, представлена
твердим тілом, друга – рідиною, третя
– газом. Здатність рідини змочувати
тверді тіла зростає із зменшенням
інтенсивносі міжмолекулярних сил
взаємодії. Тверді тіла, всі без винятку,
змочуються багатьма органічними рідинами
– вуглеводнями, ефірами тощо. Вода
змочує всі тіла, крім "масних"
органічних, таких як парафін.
-
енергія тих самих молекул у відповідних
об’ємних частинах системи. Змочуваність.
Поверхневі
процеси в ДС супроводжуються змочуванням,
яке спостерігається на границі поділу
фаз, одна з яких, переважно, представлена
твердим тілом, друга – рідиною, третя
– газом. Здатність рідини змочувати
тверді тіла зростає із зменшенням
інтенсивносі міжмолекулярних сил
взаємодії. Тверді тіла, всі без винятку,
змочуються багатьма органічними рідинами
– вуглеводнями, ефірами тощо. Вода
змочує всі тіла, крім "масних"
органічних, таких як парафін.
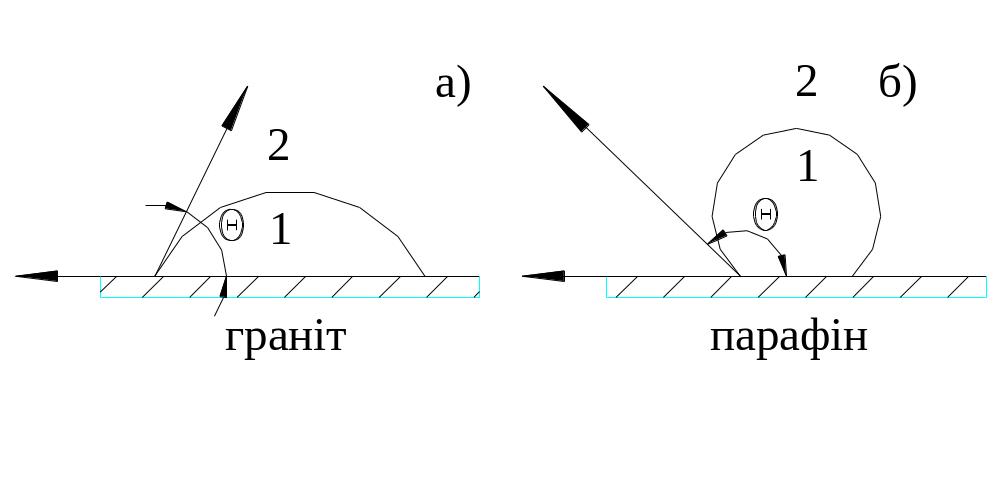
Рис 1.4. Змочування тіл бітумом
а – тверде гідрофільне тіло; б – тверде гідрофобне тіло; 1 – бітум; 2 – повітря.
Якщо на таке тверде тіло, як граніт, помістити краплю води, то сили взаємодії між частинками твердої поверхні і частинками води будуть більшими, ніж між частинками води; крапля розтікатиметься по поверхні і змочуватиме її (рис 1.3,а). Такі тіла наз. гідрофільними.
Якщо краплю води помістити на поверхню парафіну, то сили взаємодії між частинками води виявляються більшими, ніж між парафіном і водою. Як наслідок, крапля не розтікатиметься на поверхні і не буде змочувати її (рис 1.3,б). Такі тіла наз. гідрофобними.
Кут між
поверхнею твердого тіла і дотичною до
поверхні краплі в точці стику всіх трьох
фаз наз. крайовим
(![]() )
і характеризує ступінь гідрофільності
тіла. Чим менший кут
,
тим гідрофільніша поверхня, тим краще
її змочують полярні рідини (вода, спирти,
кислоти). Чим тупіший кут
,
тим слабше дана рідина взаємодіє з
тілом, тим гірше змочує його.
)
і характеризує ступінь гідрофільності
тіла. Чим менший кут
,
тим гідрофільніша поверхня, тим краще
її змочують полярні рідини (вода, спирти,
кислоти). Чим тупіший кут
,
тим слабше дана рідина взаємодіє з
тілом, тим гірше змочує його.
На рис 1.4 показано, як поводять себе неполярні рідини (бітуми, бензин, толуол та ін.) при нанесенні їх на гідрофільні і гідрофобні тіла. Отже, органічний в’яжучий матеріал погано змочує гідрофільні поверхні більшості мінеральних матеріалів, тобто дуже слабо взаємодіє з ними (рис 1.4,а), з гідрофобними тілами неполярні рідини взаємодіють енергійно, добре їх змочують (рис. 1. 4,б).
Набрякання. Цей процес полягає в тому, що в ДФ проникає Дсер. із подальшим зростанням об’єму системи в цілому. В основі явища набрякання лежить дія адсорбційних, осмотичних і капілярних сил, що визначають напруження, з якими вода утримується в структурованій ДС.
Адсорбція. Адсорбцією наз. концентрація газоподібної або розчиненої речовини на поверхні поділу фаз – на твердому тілі або рідині. У такому випадку газ або розчинена речовина наз. адсорбтивом, а речовина, що адсорбує – адсорбентом.
Взаємодія між адсорбентом і адсорбтивом зумовлена силами Ван-дер-Ваальса, що мають хімічну природу (йонні, ковалентні, координаційні зв’язки).
Фізична адсорбція – оборотна, хімічна (хемосорбція) – необоротна. Найбільш важливою у ф/х механіці є адсорбція із розчинів на твердій поверхні, оскільки саме вона лежить в основі утворення багатьох модифікованих дисперсних структур.
Розрізняють адсорбцію неелектролітів, коли на поверхні адсорбуються молекули адсорбтива та адсорбцію електролітів, коли на поверхні переважно адсорбується один із йонів електроліту, який містить розчин.
Адсорбційний шар із орієнтованих молекул варто розглядати як речовину в особливому двомірному "поверхневому" стані, у якому такі властивості як міцність, щільність, діелектрична проникність та інші принципово відрізняються від властивостей цього ж компонента в об’ємному стані.
Крім того, адсорбційні шари орієтованих молекул характеризуються іншими властивостями, що особливо ефективно проявляється при їх утворенні на твердих поверхнях: якщо така поверхня спочатку була сильно полярною (гідрофільною), то утворення орієнтованого шару призводить до інверсії (зміни) її молекулярної природи. Після адсорбції поверхня із гідрофільної стає більш-менш гідрофобною: її ф/х спорідненість до води (змочуваність) зменшується, а до малополярних органічних рідин (н-д, бітумів, масел) – збільшується.
Подібна зміна молекулярної природи твердої поверхні шляхом адсорбції дозволяє суттєво регулювати всі процеси взаємодії твердих тіл між собою і рідинами.
Капілярні явища. Капілярні явища зумовлені дією молекулярних сил, головним чином у рідині, але також і в твердих тілах. Як і в поверхневих явищах, капілярні ефекти пов’язані з нескомпенсованістю молекул граничних поверхневих шарів на міжфазних поверхнях поділу (наприклад: "рідина - пара", "рідина - тверда фаза" тощо).
Капілярні сили – це сили, зумовлені молекулярним тиском і залежністю його від кривизни поверхні і реалізуються як капілярний тиск або тиск Лапласа:
|
1.4) |
де
![]() –
середій радіус кривизни
–
середій радіус кривизни
За своєю фізичною сутністю капілярний тиск – це стрибок тиску Р1 або різниця тисків у двох фазах, що контактують через викривлену поверхню.
Роль капілярних явищ у будівельних дисперсних системах надзвичайно велика. Саме капілярні сили визначають здатність свіжовідформованих виробів зберігати форму, дія капілярних ефектів зумовлює розвиток деформацій усідання тощо.
Когезія та адгезія – фундаментальні властивості рідин, які дозволяють прогнозувати поведінку багатьох будівельних матеріалів. Можна говорити про адгезію цементного тіста, бітуму, полімеру, дьогтя до твердої поверхні, а також про когезію бітумів, полімерів.
Когезія – це зчеплення однорідних молекул, атомів або йонів всередені однієї фази (тіла), яке включає всі види міжмолекулярного та міжатомного притягання. Іншими словами когезія – це міцність речовин. Робота когезії дорівнює енергії, яку треба витратити для розриву сил зчеплення між молекулами даної фази – Wk (Дж/м2). Чисельно робота когезії дорівнює подвоєному значенню поверхневого натягу речовини, що розривається на границі з повітрям.
Адгезія (прилипання) – це молекулярне притягання між поверхнями двох різнорідних тіл (крім газів). Робора адгезії дорівнює енергії, що витрачається на відрив молекул однієї фази від молекул іншої фази – Wa (Дж/м2). За значенням роботи адгезії можна прогнозувати міцність склеювання, прилипання двох тіл.
