
- •Розділ 2 поверхнево-активні речовини в технології дорожньо–будівельних матеріалів
- •2.1. Загальні поняття про поверхнево-активні речовини
- •Будова пар
- •Властивості пар
- •Класифікація пар
- •Сфера застосування пар
- •2.2. Пар в технології цементного бетону
- •2.3. Роль пар у покращенні властивостей нафтових бітумів. Сучасні уявлення про склад і структуру бітумів
- •Властивості дорожніх бітумів
- •Механізми впливу пар на структуру і властивості бітумів
- •Деструктивна (стабілізуюча) дія.
- •Структуруюча дія.
- •Пластифікуючи дія.
- •2.4. Полімерна модифікація – ефективний засіб покращення властивостей нафтових бітумів.
- •Реагенти для модифікації
- •Аналіз досліджень полімерної модифікації бітумів
- •2.7. Схема змішувача планетарного типу
- •2.5. Пар в технології дорожнього асфальтобетону і бітумомінеральних матеріалів Загальні відомості
- •Структура асфальтобетону
- •Підбір складу асфальтобетону
- •Модифікація сумішей добавками пар
- •2.7. Роль пар у приготуванні бітумних емульсій.
- •Класифікація емульсій
- •Фізико-хімічні процеси, на яких грунтується виробництво і застосування бітумних емульсій
- •Переваги застосування бітуму в емульсійному вигляді
- •Недоліки застосування
- •Сфера застосування бітумних емульсій
- •Властивості емульсій
- •Технологія виробництва емульсій
- •Зберігання емульсій
- •Транспортування емульсій
Розділ 2 поверхнево-активні речовини в технології дорожньо–будівельних матеріалів
2.1. Загальні поняття про поверхнево-активні речовини
Поверхнево-активними речовинами (ПАР) називаються такі хімічні сполуки, які адсорбуються на поверхні поділу фаз і впливають на фізико-хімічні та хімічні властивості ДС. ПАР при розчиненні навіть у дуже малих концентраціях здатні істотно зменшувати поверхневий натяг розчинника, тобто проявляти поверхневу активність. Утворення мономолекулярного насиченого адсорбційного шару ПАР спричиняє рікі зміни інтенсивності молекулярної взаємодії тіл, що межують, а також швидкості обміну речовин між цими тілами.
Будова пар
ПАР, переважно, представлені сполуками, молекули яких складаються із двох головних частин – неполярного вуглеводневого ланцюга (радикалу) і полярної групи.
Радикал – це група атомів, яка при ряді хімічних перетвореннях лишається незмінною і переходить з молекули однієї сполуки в молекулу другої. Радикали утворюються, наприклад, при відокремленні в молекулах вуглеводнів органічних сполук атому водню і позначаються літерою R:
|
|
H |
|
H |
|
H |
|
H |
|
H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
C |
|
C |
|
C |
|
C |
|
… |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
H |
|
H |
|
H |
|
|
|
H |
|
|
|
|
1 |
|
2 |
|
3 |
|
4 |
|
5 |
|
… |
|
n |
|
|
Місце атому водню в молекулі може зайняти інший атом або група атомів з певними властивостями, які пов’язані із стаціонарним зміщенням електронів на їх атомних орбітах, що обумовлює наявність певного електричного диполю і дипольного моменту всієї молекули. Такі групи атомів наз. функціональниим групами (ФГ).
Найбільш поширені в складі ПАР такі ФГ:
(- ОН) – гідроксильна (- NO2) – нітрогрупа (- SO3H) – cульфогрупа
|
|
|
O |
|
|
|
|
|
|
H |
|
|
|
||
|
|
/ |
|
|
|
|
|
|
/ |
|
|
|
|
||
( |
|
C |
|
) |
-карбоксильна |
|
( |
|
N |
|
H |
) |
-аміногрупа |
||
|
|
\ |
|
|
|
|
|
|
\ |
|
|
|
|
||
|
|
|
O H |
|
|
|
|
|
|
H |
|
|
|
||
Від того, яка з функціональних груп приєднана до радикала, залежать фізичні, хімічні та інші властивості ПАР. Якщо до аліфатичного радикала С10Н2n+1 приєднати гідроксильну групу (–ОН) утворюється спирт С10Н2n+1ОН, при приєднанні карбоксильної групи СООН утворюється карбонова кbслота СООН, приєднання аміногрупи – аліфатичний амін С10Н2n+1NН3. За кількістю ФГ у молекулі ПАР можуть бути одно-, дво- і багатоосновні. Наприклад, RСООН – одноосновна карбонова кислота, СООНRСООН – двоосновна карбонова кислота.
Отже, поверхнево-активні властивості сполук, що утворюються таким чином, залежать від властивостей і хімічної структури радикалів і функціональних груп.
Поверхнево-активних властивостей сполуки набувають, переважно, при вмісті в радикалі більше 10 атомів вуглецю і називаються вищими жирними ПАР (вищі жирні кислоти, вищі жирні спирти, вищі жирні аміни тощо). Активність ПАР підвищується при подовженні вуглеводневого ланцюга.
Найпростіші поверхнево-активні молекули відповідно до їх будови представляють у вигляді своєрідних "пуголовків" (рис.2.1): голівкою слугує полярна група, з якою хімічно пов’язаний достатньо довгий "хвостик" – вуглеводневий радикал.
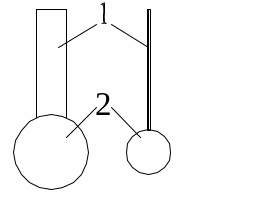
1 – вуглеводневий радикал; 2 – функціональна група
Рис. 2.1. Умовні позначення молекули ПАР
Характерною рисою будови молекул більшості ПАР є їх дифільність – наявність неполярного вуглеводневого радикала і полярної групи, що має значний дипольний момент і здатна до гідратації. ФГ обумовлює спорідненість ПАР з водою, радикал є причиною пониженої розчинності цих сполук у воді.
Скупчення йонів ПАР, які виникають в об’ємі розчинів внаслідок адсорбції, наз. міцелами. Встановлено, що міцели існують тільки тоді, коли концентрація ПАР в розчині перевищує деяке критичне значення – критичну концентрацію міцелоутворення (ККМ).
