
- •2) Основные направления создания новых лекарственных средств. Доклинические и клинические исследования (фаза I–IV). Функции Государственного експертного (фармакологического) центра мз Украины.
- •3) Определение понятий фармакокинетика, фармакодинамика, фармакотоксикодинамика. Номенклатура и принципы классификации лекарственных средств. Виды фармакотерапии.
- •Воздействие на тело человека
- •4.) Пути введения и их значение для эффективной и безопасной фармакотерапии. Преимущества и недостатки каждого пути введения
- •7. Понятие об элиминации и экскреции лекарств. Пути выведения лекарств из организма. Факторы, определяющие выведение. Основные фармакокинетические параметры.
- •8. Виды действия лекарственных средств.
- •9. Типы механизмов действия лекарственных средств.
- •10. 3Ависимость фармакологического эффекта от свойств лекарственных средств (химическая структура и физико-химические свойства) и лекарственной формы. Значение для клинической практики.
- •11.Зависимость фармакологического эффекта от дозы действующего вещества. Виды доз. Широта терапевтического действия лекарств. Биологическая стандартизация.
- •14. Комбинированное действие лекарств – синергизм, антагонизм и их виды. Примеры. Понятие о полипрагмазии.
- •15 Несовместимость лекарственных средств – фармацевтическая, фармакологическая, физиологическая. Примеры. Использование в медицинской практике.
- •16 Рецепт как медицинский и юридический документ. Структура рецепта, правила его оформления. Особенности хранения и отпуска ядовитых, наркотических и сильнодействующих средств.
- •17 Лекарственные формы. Классификации. Правила выписывания магистральных и официнальных форм. Государственная фармакопея.
- •По разделению на дозы
- •18 Классификация средств, влияющих на передачу возбуждения в холинергических синапсах.
- •24.Классификация средств, влияющих на передачу возбуждения в адренергических синапсах. Симпатолитические средства. Фармакодинамика. Показания к назначению. Нежелательные эффекты.
- •25 Альфа-, бета-адреномиметики. Классификация. Фармакокинетика. Фармакодинамика. Применение в клинике. Нежелательные эффекты.
- •26. Альфа-адреномиметики. Классификация. Фармакокинетика. Фармакодинамика. Показания к назначению. Нежелательные эффекты.
- •27. Бета-адреномиметики. Классификация. Фармакокинетика. Фармакодинамика. Показания к назначению. Нежелательные эффекты.
- •28. Альфа-адреноблокаторы. Классификация. Фармакодинамика. Показания к назначению. Нежелательные эффекты. Понятие о симпатолитиках.
- •29. Бета-адреноблокаторы. Классифкация. Фармакокинетика. Фармакодинамика. Показания к назначению. Нежелательные эффекты.
- •30. Средства, раздражающие рецепторы. Классификация. Механизмы действия и показания к применению собственно раздражающих и отхаркивающих средств.
- •31. Слабительные и желчегонные средства.
- •33.Местноанестезирующие средства.Классификация по хим.Структуре и продолжительности действия.Механизм действия.Применение в клин.Практике.
- •34.Особенности назначения местных анестетиков при различных видах местной анестезии. Нежелательные эффекты.
- •35. Нейротропные средства. Психотропные средства. Классификация.
- •36.Средства для наркоза
- •37. Средства для ингаляционного и неингаляционного наркоза. Фармакодинамика, кинетика. Показания. Осложнения. Меры помощи.
- •39. Снотворные средства. Классификация, Недостатки снотворных и требования, предъявляемые к ним.Общии принципы фармакотерапии инсомнии.
- •40. Снотворные – производные барбитуровой кислоты. Фармакокинетика. Фармакодинамика. Нежелательные эффекты. Острое отравление и принципы его лечения.
- •42. Противосудорожные средства. Симптоматическая терапия судорог
- •43. Противоэпилептические и противопаркинсонические средства. Механизмы действия. Принципы применения.
- •44Нпвс. Классификация. Показания к применению в клинике. Селективные ингибиторы циклооксигеназы (цог). Их преимущества и недостатки.
- •45Нпвс. Механизмы противовоспалительного, болеутоляющего и жаропонижающего действия. Дополнительные фармакологические эффекты.
- •46.Нпвс - производные салициловой кислоты. Фармакокинетика. Фармакодинамика. Нежелательные эффекты. Применение в клинике.
- •47.Нпвс – производные пиразолона и анилина. Фармакокинетика. Фармакодинамика. Нежелательные эффекты. Применение в клинике.
- •48.Нпвс – производные фенилпропионовой, фенилуксусной, антраниловой, индолуксусной кислот и оксикамов. Механизмы действия. Нежелательные эффекты. Применение в клинике.
- •49.Алкалоиды. Физико-химические свойства. Классификация алкалоидов опия. Классификация наркотических аналгетиков по химической структуре.
- •50.Наркотические анальгетики. Опиатные рецепторы и их эндогенные лиганды. Классификация по сродству к опиатным рецепторам. Механизмы болеутоляющего действия.
- •51.Фармакодинамика и фармакокинетика опиоидов. Показания к применению.
- •52.Острое отравление опиоидами. Принципы лечения. Толерантность и лекарственная зависимость. Медико-социальные аспекты наркоманий. Профилактика и лечение.
- •53.Нейролептики. Классификация. Фармакокинетика. Фармакодинамика. Показания к назначению. Нежелательные эффекты. Понятие о нейролептаналгезии.
- •54.Транквилизаторы
- •55.Психоседативные.
- •57.Психостимулирующие
- •58.Кофеин
- •59.Ноотропы,актопротекторы,адаптогены,
- •60. Аналептики
- •61. Вещества,вызывающие зависимость
- •62. Кардиотонические средства
- •63. Фармакокинетика сердечных гликогидов
- •64. Фармакодинамика
- •65.Нежелательные эффекты сердечных гликозидов
- •67.)Противоаритмические средства при тахиаритмиях.Механизми и особенности данных групп.Нежелательные эффекты
- •68)Антиангинальные средства.Классификация.
- •69)Нитровазодилататоры.Фармакодинамика и фармакокинетика нитратов.Нежелательные эффекты .Применение в клиннике.
- •70)Бета-адреноблокаторы и блокаторы кальциевых каналов,как антиангинальные,механизм действий.Нежелательные эффекты.
- •Папаверин- Фармакологическое действие
- •72)Принципы комплексной терапии инфаркта миокарда.
- •73)Диуретики. Классификация по химической структуре и механизмам действия. Точки приложения основных групп.
- •74) Классификация мочегонных по скорости и продолжительности действия. Ксантиновые диуретики. Ингибиторы карбоангридразы. Механизмы действия. Показания к применению.Нежелательные эффекты.
- •75)Петлевые и осмотические диуретики. Механизмы действия. Показания к применению. Нежелательные эффекты. Понятие о форсированном диурезе
- •76)Тиазидные и тиазидоподобные диуретики. Механизмы действия. Показания к применению. Нежелательные эффекты
- •77) Калийсберегающие диуретики. Механизмы действия. Показания к применению. Нежелательные эффекты. Основные принципы назначения диуретиков
- •78) Противоподагрические средства. Применение.
- •79.Комплексная терапия хронической сердечной недостаточности.
- •80.Гипотензивные средства. Классификация.
- •82. Миотропные гипотензивные средства. Классификация. Механизмы действия. Нежелательные эффекты. Особенности клинического применения.
- •83. Гипотензивные средства, влияющие на водно-солевой обмен. Диуретики и вещества, влияющие на ренин-ангиотензиновую систему. Нежелательные эффекты. Особенности клинического применеия.
- •84.Принципы лечения артериальной гипертензии
- •85.Гипертензивные средства.Классиф.Показания.Нежелат.Эф.
- •86.Комплексная терапия нарушений мозгового кровообращения
- •87.Противомигренозные средства. Классиф.,механизм, нежел.Эф.
- •88.Ангиопротекторы.
- •89.Гиполипидемические средства
- •94. Препараты гормонов паращитовидных желез. Фармакодинамика. Применение в клинической практике.
- •Препараты гормонов поджелудочной железы. Инсулины. Классификации. Фармакокинетика, фармакодинамика. Нежелательные эффекты.
- •96. Показания к применению препаратов инсулина. Принципы инсулинотерапии. Неотложная помощь при гипо- и гипергликемической комах.
- •Синтетические антидиабетические средства. Классификация. Механизмы действия. Показания к применению.
- •Гормоны коры надпочечников. Препараты минералокортикоидов. Механизм действия. Показания к применению. Нежелательные эффекты.
- •99 Препараты глюкокортикоидов. Фармакодинамика. Показания к применению.
- •100 Фармакокинетика препаратов глюкокортикоидов. Их сравнительная характеристика. Нежелательные эффекты. Правила назначения.
- •101Препараты женских половых гормонов. Классификация. Фармакологические эффекты. Показания к применению. Нежелательные эффекты. Ингибиторы и антагонисты эстрогенов и гестагенов. Применение.
- •103. Анаболические средства стероидной и нестероидной структуры. Механизмы действия. Показания к применению. Нежелательные эффекты.
- •104.Классификации витаминов. Виды витаминотерапии. Препараты витаминов в1, в2, в6. Фармакодинамика. Фармакокинетика. Показания к применению. Нежелательные эффекты.
- •105) Препараты витаминов рр, с, р. Фармакодинамика. Фармакокинетика. Показания к применению. Нежелательные эффекты.
- •106) Препараты витаминов а, е, д. Фармакодинамика. Фармакокинетика. Показания к назначению. Нежелательные эффекты.
- •107) Средства, влияющие на фосфорно-кальциевый обмен. Классификация. Препараты кальция, фтора, фосфора и бифосфонатов. Показания к назначению. Нежелательные эффекты.
- •108.Ферментные препараты и ингибиторы ферментов. Классификации. Общая характеристика. Применение.
- •110.Средства, применяемые для лечения гипохромных анемий. Классификация препаратов железа. Фармакокинетика и фармакодинамика. Применение. Нежелательные эффекты. Острое отравление, лечение.
- •112. Кровезаменяющие жидкости
- •114. Роль ионов натрия, магния и калия в регуляции функций организма. Применение их препаратов в медицинской практике.
- •115. Средства, стимулирующие лейкопоэз. Основные группы. Фармакодинамика. Нежелательные эффекты.
- •116. Противоопухолевые средства. Классификация. Механизмы действия основных групп. Общие принципы назначения. Нежелательные эффекты. Понятие о радиопротекторах.
- •116) Противоопухолевые средства. Классификация. Механизмы действия основных групп. Общие принципы назначения. Нежелательные эффекты. Понятие о радиопротекторах.
- •117) Средства, понижающие свертывание крови и повышающие фибринолиз. Классификация.
- •118) Антикоагулянты прямого действия. Фармакодинамика. Фармакокинетика. Показания к применению. Нежелательные эффекты. Принципы назначения.
- •119) Антикоагулянты непрямого действия. Фармакодинамика. Фармакокинетика. Показания к применению. Нежелательные эффекты. Принципы назначения.
- •120) Фибринолитические средства и антиагреганты. Фармакодинамика. Фармакокинетика. Показания к применению. Нежелательные эффекты. Принципы назначения.
- •121) Средства, повышающие свертывание крови и угнетающие фибринолиз. Классификация. Прокоагулянты. Механизмы действия отдельных групп. Показания и противопоказания к применению.
- •122 Ингибиторы фибринолиза. Классификация. Фармакодинамика. Фармакокинетика. Показания к применению. Нежелательные эффекты. Проагреганты. Применение.
- •123) Иммунотропные вещества. Понятие об иммуномодуляторах, иммуносупрессантах, иммуностимуляторах. Виды иммунокоррекции. Общие принципы назначения иммунотропных средств.
- •124) Иммуносупрессанты. Классификация. Применение. Нежелательные эффекты и контроль иммуносупрессивной терапии.
- •125) Иммуностимуляторы. Классификации по происхождению и механизму действия. Общие принципы назначения.
- •126) Противоаллергические средства. Классификация. Общие принципы терапии аллергических реакций немедленного и замедленного типа.
- •128Анафилактический шок. Принципы лечения. Типы. Понятие о лекарственной болезни.
- •131 Галогеносодержащие вещества. Окислители. Кислоты и щелочи. Меха- низмы антимикробного действия. Применение в медицине.
- •132Антисептические средства алифатического, ароматического ряда и группы красителей. Детергенты. Применение в медицине.
- •Симптомы Отравления солями тяжелых металлов:
- •135.Антибиотики.История открытия.Классификация антибиотиков по антибактериальному спектру и механизмам действия.
- •136.Принципы рациональной и безопасной антибиотикотерапии.
- •137.Основные осложнения антибиотикотерапии.Меры их профилактики и лечения.
- •138.Пенициллины.Классификация.Механизм действия.Характеристика отдельных групп.Фармакокинетика.Нежелательные эффекты.
- •139.Цефалоспорины.
- •140.Антибиотики - макролиды и азалиды.
- •141.Аминогликозиды.
- •142.Антибиотики группы тетрациклина и левомицетина.
- •143.Антибиотики для наружного применения.
- •144,145.Сульфаниламидные препараты.
- •146.Противомикробные препараты разной химической структуры.
- •147 Хинолоны и фторхинолоны. Классификация. Механизм действия. Антибактериальный и химиотерапевтический спектры отдельных поколений. Нежелательные эффекты
- •Противомикозные средства. Классификация. Механизмы действия противомикозных азолов и антибиотиков (полиенов). Показания к назначению. Нежелательные эффекты.
- •149 Противотуберкулезные средства. Классификация. Основные принципы лечения туберкулеза. Нежелательные эффекты отдельных групп.
- •150 Противоспирохетозные средства. Механизмы действия отдельных групп препаратов. Применение. Нежелательные эффекты.
- •151. Противогельминтозные средства. Классификация. Механизмы действия отдельных групп. Нежелательные эффекты.
- •152. Противомалярийные средства. Классификация. Характеристика препаратов. Нежелательные эффекты.
- •153. Противоамебиазные средства. Классификация. Характеристика препаратов. Нежелательные эффекты.
- •154. Средства для лечения токсоплазмоза, лямблиоза, трихомониаза. Характеристика препаратов. Нежелательные эффекты.
- •155. Противовирусные средства. Классификация. Механизмы действия отдельных групп. Применение. Нежелательные эффек-ты.
- •156. Классификация лекарственных средств, влияющих на функции желудочно-кишечного тракта. Фармакологическая регуляция аппетита, секреции слюнных желез. Показания к назначению.
- •157. Средства, повышающие и понижающие секреторную функцию желудка. Классификации. Фармакодинамика. Фармакокинетика. Показания к назначению. Понятие о гастропротекторах.
- •158. Рвотные и противорвотные средства. Средства, усиливающие и уменьшающие моторную функцию жкт. Классификация. Механизмы действия. Показания к назначению. Нежелательные эффекты.
- •160. Средства, регулирующие функцию поджелудочной железы. Механизмы действия и показания к применению отдельных групп препаратов.
- •161. Средства, влияющие на функции органов дыхания. Классификация. Применение отдельных групп препаратов. Нежела-тельные эффекты.
- •162. Средства, влияющие на тонус и сократительную активность миометрия. Классификация. Применение отдельных групп препаратов. Нежелательные эффекты.
- •166. Симптоматическая терапия судорожного синдрома,психомоторного возбуждения,болевого синдрома,гипо- и гипертермий.При метаболических нарушениях и дегидратации
- •167. Средства неотложной помощи при острой сердечной недостаточности.
- •168. Средства неотложной помощи при острой сосудистой недостаточности,гипертоническом кризе.
- •170. Фармакотоксикодинамика.Понятие о безопасности, побочном действии,реакции,явлении.
- •171. Классификация побочных реакций. Примеры
- •173 . Понятия о доказательной медицине. Принципы рациональной фармакотерапии. Требования, предъявляемые к современным лс.
173 . Понятия о доказательной медицине. Принципы рациональной фармакотерапии. Требования, предъявляемые к современным лс.
Ответ:
Доказа́тельная медици́на — подход к медицинской практике, при котором решения о применении профилактических, диагностических и лечебных мероприятий принимаются исходя из имеющихся доказательств их эффективности и безопасности, а такие доказательства подвергаются поиску, сравнению, обобщению и широкому распространению для использования в интересах больных
Принципы доказательной медицины
В основе доказательной медицины лежит проверка эффективности и безопасности методик диагностики, профилактики и лечения в клинических исследованиях. Под практикой доказательной медицины понимают использование данных, полученных из клинических исследований в повседневной клинической работе врача.
Ни один практический врач не обладает достаточным опытом, позволяющим свободно ориентироваться во всем многообразии клинических ситуаций. Можно полагаться на мнения экспертов, авторитетные руководства и справочники, однако это не всегда надежно из-за так называемого эффекта запаздывания — перспективные терапевтические методы внедряются в практику спустя значительное время после получения доказательств их эффективности .
Основные тенденции развития биомедицинских наук определяют следующие факторы:
глобализация информационных процессов;
большое количество проводимых биомедицинских исследований;
широкий спектр лекарственных средств (ЛС) на фармацевтических рынках;
увеличение потока медицинской информации (издается около 40 000 биомедицинских журналов, публикующих примерно 2 млн статей ежегодно) (Oxman A., Guyall G., 1988);
остро стоит проблема рационального расходования средств в системе здравоохранения.
Эти основные тенденции определяют следующие потребности практической медицины:
необходимость критической оценки информации, предназначенной для практических врачей и руководителей здравоохранения;
выбор системных подходов для принятия решений в медицине (лечебных, диагностических, управленческих и др.).
Следовательно, существует необходимость обобщения биомедицинских знаний и широкого информирования медицинской общественности о результатах новейших исследований.
Уровни доказательности
В начале 1990-х годов предложена рейтинговая система оценки клинических исследований, где с возрастанием порядкового номера доказательности, качество клинических исследовний снижается. Уровни принято обозначать римскими цифрами (I, IIA,IIB,III) или буквами латинского алфавита (А,В,С).
Класс (уровень) I (A) большие двойные слепые плацебоконтролируемые исследования, а также данные, полученные при мета-анализе нескольких рандомизированных контролируемых исследований.
Класс (уровень) II (B) небольшие рандомизированные и контролируемые исследования, при которых статистические данные построены на небольшом числе больных.
Класс (уровень) III (C) нерандомизированные клинические исследования на ограниченном количестве пациентов.
Класс (уровень) IV (D) выработка группой экспертов консенсуса по определённой проблеме
Требования, предъявляемые к лекарственным средствам
1) требования к качеству и безопасности лекарственных средств;
2) требования к упаковке и маркировке лекарственных средств.
Требования к маркировке и упаковке лекарственных средств.
1. Упаковка лекарственных средств должна обеспечивать их безопасность и неизменность ее идентификационных признаков при обращении лекарственных средств в течение срока годности.
2. Лекарственные препараты, за исключением изготавливаемых в аптечных организациях, поступают в обращение, если на первичной и вторичной (потребительской) упаковках хорошо читаемым шрифтом на русском языке указаны:
На первичной упаковке:
1) торговое наименование лекарственного средства и международное непатентованное наименование;
3) дозировка и количество в первичной упаковке;
3) номер серии;
4) срок годности;
На вторичной (потребительской) упаковке:
1) торговое наименование лекарственного средства и международное непатентованное наименование;
2) название организации - производителя лекарственных средств;
3) номер серии;
4) способ применения;
5) дозировка и количество доз в упаковке;
6) срок годности;
7) условия отпуска;
8) условия хранения;
9) меры предосторожности при применении лекарственных средств.
3. Фармацевтические субстанции поступают в обращение, если на вторичной (потребительской) упаковке хорошо читаемым шрифтом на русском языке указаны:
1) торговое наименование лекарственного средства и международное непатентованное наименование;
2) название организации - производителя лекарственных средств;
3) номер серии и дата изготовления;
4) количество в упаковке и единицы измерения количества;
5) срок годности;
6) условия хранения.
4. Сыворотки поступают в обращение с указанием, из крови, плазмы крови, органов, тканей какого животного они получены; вакцины - с указанием питательной среды, использованной для размножения вирусов и бактерий.
5. Лекарственные средства, зарегистрированные как гомеопатические, имеют надпись: «Гомеопатические».
6. Лекарственные средства, предназначенные для лечения животных, имеют надпись: «Для животных».
7. Лекарственные средства, полученные из растительного сырья, имеют надпись: «Продукция прошла радиационный контроль».
8. Лекарственные средства, предназначенные для клинических исследований, имеют надпись: «Для клинических исследований».
9. Лекарственные средства, предназначенные исключительно для экспорта, маркируются в соответствии с требованиями страны-импортера.
10. Лекарственные препараты должны поступать в обращение только с инструкцией по применению лекарственного препарата, содержащей следующие данные на русском языке:
торговое наименование, международное непатентованное, химическое или иное наименование лекарственного средства;
лекарственная форма с указанием количественного содержания (активности) действующих веществ и наименований вспомогательных веществ;
фармакотерапевтическая группа лекарственного препарата;
название, юридический и фактический адреса организации-производителя лекарственного препарата;
показания к медицинскому применению;
противопоказания к медицинскому применению;
режим дозирования и путь введения, длительность лечения, если её следует ограничить;
возможные побочные действия, нежелательные явления и серьёзные нежелательные явления при медицинском применении лекарственного препарата;
взаимодействие с другими лекарственными препаратами и (или) пищевыми продуктами;
указание о возможности медицинского применения у беременных, женщин, кормящих грудью, несовершеннолетних;
срок годности, а также указание, что лекарственный препарат по истечении срока годности не должно применяться;
условия хранения;
указание, что лекарственный препарат следует хранить в местах, не доступных для детей;
174.Основные пути решения безопасности лечения. Система фармакологического надзора в мире и Украине. Формулярная система. Медико-юридические и организационные аспекты. роль врача в выявлении побочных реакций лс
внешние относительно больного факторы (врач, который проводит фармакотерапию, экология, условия работы и др.).
Факторы, связанные с побочным действием препаратов:
особенности клинико-фармакологической характеристики ЛС;
адекватность выбора препарата;
метод применения препарата;
взаимодействие ЛС при полипрагмазии.
факторы связанные с качеством лс
Контролируемые клинические исследования (при изучении новых ЛС).
![]()
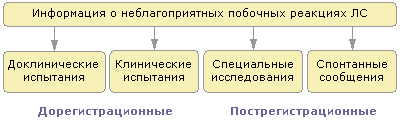 Рис.
2.
Основные
источники информации о ПР/ПД ЛС
Рис.
2.
Основные
источники информации о ПР/ПД ЛС
Все вышеуказанные направления сбора информации имеют свою специфику при непосредственном получении сообщений, исходя из целей исследования, рекомендованных ВОЗ
Сейчас в мире, благодаря усилиям ВОЗ, сформировалась и продолжает развиваться система обмена информацией о нежелательных ПД ЛС
Тщательный анализ причин, которые привели к прекращению испытаний, и причин летальности, ставших причиной ограничения или запрещения медицинского применения ЛС.
В Украине после провозглашения независимости впервые в истории системы здравоохранения официальным изучением ПД ЛС начало заниматься с 1995 г. подразделение Фармакологического комитета МЗ Украины — Центр побочного действия лекарственных препаратов. Деятельность его была направлена на сбор и анализ, в первую очередь, собственной информации о ПР, которые регистрировалось при проведении официальных клинических испытаний ЛС. Одновременно Центр начал создавать базу спонтанных сообщений о ПД. В 1999 г. Центр был переименован в Отдел фармакологического надзора в составе Государственного фармакологического центра МЗ Украины (правопреемник Фармакологического комитета). В части контроля за ПР/ПД ЛС отдел руководствуется Законом Украины о лекарственных средствах, порядке государственной регистрации/перерегистрации ЛС с учетом норм, которые применяются в международной практике (GCP, ІСН, директив Совета ЕЭС), и т. п. До 2000 г. в ГФЦ МЗ Украины накоплено около 700 спонтанных сообщений о ПР/ПД ЛС, которые поступили от врачей из лечебно-профилактических учреждений и учреждений разных регионов Украины, а также данные, полученные во время клинических испытаний, проводимых под контролем ГФЦ МЗ Украины.
Информация о ПР/ПД ЛС поступает в ГФЦ МЗ Украины от:
врачей, фармацевтов и медицинских работников независимо от ведомственного подчинения и форм собственности (форма 1,2);
производителей/собственников регистрационного удостоверения или их уполномоченных представителей (форма 3);
уполномоченных международных организаций (Всемирная организация здравоохранения, Европейское сообщество и т. п.),
медицинских источников информации и научных изданий;
общественных организаций, которые представляют интересы потребителей лекарственных средств, а также граждан;
комиссии по вопросам этики (во время клинических испытаний лекарственных средств);
региональных отделений.
Центр получает информацию о ПР/ПД ЛС, систематизирует, анализирует в сроки, и готовит информационные сообщения, аналитические обзоры, экспресс-информацию, методические рекомендации, предложения МЗ Украины по изменению инструкции по медицинскому применению и обращению лекарственных средств и т. п.
Отчеты о подозреваемых серьезных побочных реакциях ГФЦ МЗ Украины направляет в ВОЗ через бюро ВОЗ в Украине, а копии — в Агентство ЕС.
