
- •Вопросы к экзамену для бакалавров
- •Раздел 1. Механика и молекулярная физика
- •1.2. Скорость
- •1.3. Ускорение и его составляющие
- •1.4 Угловая скорость и угловое ускорение
- •2.2. Второй закон Ньютона
- •2.3. Третий закон Ньютона
- •2.4. Силы трения
- •Сила тяжести и вес. Невесомость
- •Сила всемирного тяготения
- •2.5. Закон сохранения импульса. Центр масс
- •3.1. Энергия, работа, мощность
- •3.2. Кинетическая и потенциальная энергии
- •3.3. Закон сохранения энергии
- •4.1. Момент инерции
- •4.4. Момент импульса и закон его сохранения
- •7. Момент силы. Основной закон динамики вращательного движения. Кинетическая энергия вращательного движения.
- •4.3. Момент силы. Уравнение динамики вращательного движения твердого тела
- •4.2. Кинетическая энергия вращения
- •5.1. Гармонические колебания и их характеристики
- •5.2. Механические гармонические колебания
- •5.4. Сложение гармонических колебаний одного направления и одинаковой частоты. Биения
- •5.5. Сложение взаимно перпендикулярных колебаний
- •Основы молекулярной физики и термодинамики
- •1. Молекулярно-кинетическая теория идеального газа
- •1.1. Опытные законы идеального газа
- •1.2. Уравнение Клапейрона-Менделеев
- •1.3. Основное уравнение молекулярно-кинетической теории идеальных газов
- •Тогда давление газа, оказываемое им на стенку сосуда
- •Уравнение (1.11) с учетом (1.12) примет
- •1.4. Закон Максвелла для распределениямолекул идеального газа по скоростям
- •2.1. Число степеней свободы молекулы. Закон равномерного распределения энергиипо степеням свободы молекул
- •2.2. Первое начало термодинамики
- •2.3. Работа газа при изменении его объема
- •2.4. Теплоемкость
- •2.5. Применение первого начала термодинамики к изопроцессам
- •Тогда для произвольной массы газа получим
- •Раздел 2. Электричество. Постоянный ток. Магнетизм
- •1.2. Закон Кулона
- •1.3. Электростатическое ноле. Напряженность электростатического поля
- •1.4. Теорема Гаусса для электростатического поля
- •1.5. Применение теоремы Гаусса к расчету некоторых электростатических полей в вакууме
- •1.6. Циркуляция вектора напряженности электростатического поля
- •1.7. Потенциал электростатического поля
- •1.9. Вычисление разности потенциалов по напряженности поля
- •2.1. Электрический ток. Сила и плотность тока
- •2.3. Закон Ома. Сопротивление проводников
- •Действие магнитного поля на движущийся заряд
- •3.7. Движение заряженных частиц в магнитном поле
- •Работа по перемещению проводника и контура с током в магнитном поле
- •3.14. Закон Фарадой и его вывод из закона сохранения энергии
- •Раздел 3. Оптика и атомная физика
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Расчет интерференционной картины от двух источников
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Интерференция света в тонких пленках
- •Применение интерференции света
- •4.1. Принцип Гюйгенса-Френеля
- •4.2. Метод зон Френеля. Прямолинейное распространение света
- •Дифракция Фраунгофера на одной щели
- •Дифракция Фраунгофера на дифракционной решетке
- •Поляризация света при отражении и преломлениина границе двух диэлектриков
- •Закон Стефана-Больцмана и смещение Вина
- •Планк вывел для универсальной функции Кирхгофа формулу
- •Модели атома Томсона и Резерфорда
- •Постулаты Бора
- •7.4. Спектр атома водорода по Бору
- •Линейчатый спектр атома водорода
- •Корпускулярно-волновой дуализм свойств вещества
- •Спин электрона. Спиновое число
- •Согласно общим выводам квантовой механики, спин квантуется по закону
- •11.2. Дефект массы и энергия связи ядра
Спин электрона. Спиновое число
В 1922 г. О. Штерн и В. Герлах, проводя прямые измерения магнитных моментов, обнаружили, что узкий пучок атомов водорода, заведомо находящихся в s – состоянии, в неоднородном магнитном поле расщепляется на два пучка.
В этом состоянии момент импульса электрона равен нулю. Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту. Поэтому он равен нулю, и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т.е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные линии атома водорода обнаруживают тонкую структуру (являются дублетами) даже в отсутствие магнитного поля.
Для объяснения тонкой структуры спектральных линий, а также ряда других явлений в атомной физике американские ученые Д. Уленбек и С. Гаудмист предположили, что электрон обладает собственным неуничтожимым моментом импульса, не связанным движением электрона в пространстве, - спином.
Спин электрона (и всех других микрочастиц) - квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) LS, то ему соответствует собственный магнитный момент PMS.
Согласно общим выводам квантовой механики, спин квантуется по закону
 ,
,
где s - спиновое квантовое число.
По аналогии с орбитальным моментом импульса проекция SLz может принимать 2s + 1 = 2 , откуда s = 1/2. Проекция спина на направление внешнего магнитного поля, являясь квантовой величиной, определяется выражением

где
mS-
магнитное
спиновое квантовое число;
оно может иметь только два значения:

Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами, задавать еще магнитное спиновое квантовое число.
58. Состав атомных ядер. Дефект масс. Энергия связи.
Размер, состав и заряд атомного ядра.
Массовое и зарядовое число
По Э. Резерфорду, атом состоит из положительно заряженного ядра и окружающих его электронов, причем ядра имеют размеры примерно 10-14 -10-15 м (линейные размеры атома примерно 10-10м). Атомное ядро состоит из элементарных частиц - протонов и нейтронов. Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоя mp=1,672610-27кг1836mе, где me-масса электрона. Нейтрон (n) - нейтральная частица с массой покоя m=1,674910 -27кг 1838me. Протоны и нейтроны называются нуклонами. Общее число нуклонов в атомном ядре называется массовым числом А.
Атомное ядро характеризуется зарядом Zе, где Z -зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в периодической системе Менделеева, e - заряд протона. Известные в настоящее время 107 элементов таблицы Менделеева имеют зарядовые числа ядер от Z=1 до Z=107.
Ядро
обозначается тем же символом, что и
нейтральный атом: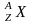 ,
где А
– массовое число (число нуклонов в
ядре); Z
- атомный номер (число протонов в ядре),
Х
-
символ химического элемента,
,
где А
– массовое число (число нуклонов в
ядре); Z
- атомный номер (число протонов в ядре),
Х
-
символ химического элемента,
Так
как атом нейтрален, то заряд ядра
определяет и число электронов в атоме.
От числа электронов зависит их
распределение по состояниям в атоме,
от которого, в свою очередь, зависят
химические свойства атома. Следовательно,
заряд ядра определяет специфику данного
химического элемента, т.е. определяет
число электронов в атоме, конфигурацию
их электронных оболочек, величину и
характер внутриатомного электрического
поля. Ядра с одинаковыми Z,
но разными А
(то есть с разными числами нейтронов
N=A-Z)
называются изотопами,
а ядра с одинаковыми А,
но разными Z
– изобарами.
Например, водород (Z=1) имеет три изотопа: -
протий (Z=1, N=0),
-
протий (Z=1, N=0),
 - дейтерий (Z=1, N=1),
- дейтерий (Z=1, N=1),
 - тритий (Z=1, N=2). В подавляющем большинстве
случаев изотопы одного и того же
химического элемента обладают одинаковыми
химическими и почти одинаковыми
физическими свойствами (исключение
составляют, например, изотопы водорода),
определяющимися в основном структурой
электронных оболочек, которая является
одинаковой для изотопов данного
элемента.
- тритий (Z=1, N=2). В подавляющем большинстве
случаев изотопы одного и того же
химического элемента обладают одинаковыми
химическими и почти одинаковыми
физическими свойствами (исключение
составляют, например, изотопы водорода),
определяющимися в основном структурой
электронных оболочек, которая является
одинаковой для изотопов данного
элемента.
