
- •Вопросы к экзамену для бакалавров
- •Раздел 1. Механика и молекулярная физика
- •1.2. Скорость
- •1.3. Ускорение и его составляющие
- •1.4 Угловая скорость и угловое ускорение
- •2.2. Второй закон Ньютона
- •2.3. Третий закон Ньютона
- •2.4. Силы трения
- •Сила тяжести и вес. Невесомость
- •Сила всемирного тяготения
- •2.5. Закон сохранения импульса. Центр масс
- •3.1. Энергия, работа, мощность
- •3.2. Кинетическая и потенциальная энергии
- •3.3. Закон сохранения энергии
- •4.1. Момент инерции
- •4.4. Момент импульса и закон его сохранения
- •7. Момент силы. Основной закон динамики вращательного движения. Кинетическая энергия вращательного движения.
- •4.3. Момент силы. Уравнение динамики вращательного движения твердого тела
- •4.2. Кинетическая энергия вращения
- •5.1. Гармонические колебания и их характеристики
- •5.2. Механические гармонические колебания
- •5.4. Сложение гармонических колебаний одного направления и одинаковой частоты. Биения
- •5.5. Сложение взаимно перпендикулярных колебаний
- •Основы молекулярной физики и термодинамики
- •1. Молекулярно-кинетическая теория идеального газа
- •1.1. Опытные законы идеального газа
- •1.2. Уравнение Клапейрона-Менделеев
- •1.3. Основное уравнение молекулярно-кинетической теории идеальных газов
- •Тогда давление газа, оказываемое им на стенку сосуда
- •Уравнение (1.11) с учетом (1.12) примет
- •1.4. Закон Максвелла для распределениямолекул идеального газа по скоростям
- •2.1. Число степеней свободы молекулы. Закон равномерного распределения энергиипо степеням свободы молекул
- •2.2. Первое начало термодинамики
- •2.3. Работа газа при изменении его объема
- •2.4. Теплоемкость
- •2.5. Применение первого начала термодинамики к изопроцессам
- •Тогда для произвольной массы газа получим
- •Раздел 2. Электричество. Постоянный ток. Магнетизм
- •1.2. Закон Кулона
- •1.3. Электростатическое ноле. Напряженность электростатического поля
- •1.4. Теорема Гаусса для электростатического поля
- •1.5. Применение теоремы Гаусса к расчету некоторых электростатических полей в вакууме
- •1.6. Циркуляция вектора напряженности электростатического поля
- •1.7. Потенциал электростатического поля
- •1.9. Вычисление разности потенциалов по напряженности поля
- •2.1. Электрический ток. Сила и плотность тока
- •2.3. Закон Ома. Сопротивление проводников
- •Действие магнитного поля на движущийся заряд
- •3.7. Движение заряженных частиц в магнитном поле
- •Работа по перемещению проводника и контура с током в магнитном поле
- •3.14. Закон Фарадой и его вывод из закона сохранения энергии
- •Раздел 3. Оптика и атомная физика
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Расчет интерференционной картины от двух источников
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Интерференция света в тонких пленках
- •Применение интерференции света
- •4.1. Принцип Гюйгенса-Френеля
- •4.2. Метод зон Френеля. Прямолинейное распространение света
- •Дифракция Фраунгофера на одной щели
- •Дифракция Фраунгофера на дифракционной решетке
- •Поляризация света при отражении и преломлениина границе двух диэлектриков
- •Закон Стефана-Больцмана и смещение Вина
- •Планк вывел для универсальной функции Кирхгофа формулу
- •Модели атома Томсона и Резерфорда
- •Постулаты Бора
- •7.4. Спектр атома водорода по Бору
- •Линейчатый спектр атома водорода
- •Корпускулярно-волновой дуализм свойств вещества
- •Спин электрона. Спиновое число
- •Согласно общим выводам квантовой механики, спин квантуется по закону
- •11.2. Дефект массы и энергия связи ядра
2.3. Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 56).
Если
газ, расширяясь, передвигает поршень
на бесконечно малое расстояние d ,
то производит над ним работу
А=Fd
=pSd
=pdV,
где S
- площадь поршня, Sd
=dV
- изменение объема системы. Таким
образом,
,
то производит над ним работу
А=Fd
=pSd
=pdV,
где S
- площадь поршня, Sd
=dV
- изменение объема системы. Таким
образом,
А = рdV.
Рис. 56
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (2.4):
 .
(2.5)
.
(2.5)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (2.5) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
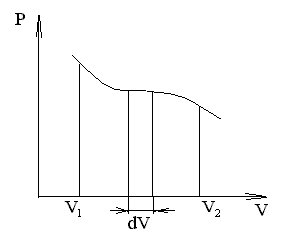
Рис. 57
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Например, изменение давления газа при его расширении изобразится кривой на рис. 57 .
При увеличении объема на dV совершаемая газом работа равна pdV, т.е. определяется площадью полоски с основанием dV на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до объема V2 определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2.
Графически можно изображать только равновесные процессы, процессы состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за короткий промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными
18. Теплоемкость газа. Молярная и удельная теплоемкости. Уравнение Майера.
2.4. Теплоемкость
Удельная теплоемкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1кг вещества на 1 К:
 .
.
Единица
удельной теплоемкости - джоуль на
килограмм-кельвин
 .
.
Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания одного моля вещества на 1 К:
 ,
(2.6)
где
,
(2.6)
где
 - количество вещества, выражающее число
молей.
- количество вещества, выражающее число
молей.
Единица молярной теплоемкости - джоуль на моль – кельвин .
Удельная теплоемкость с связана с молярной Сm соотношением
Cm=cM, (2.7) где М - молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики (2.3) для 1 моля газа с учетом формул (2.4) и (2.6):
 .
(2.8)
.
(2.8)
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (2.4) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
 ,
(2.9)
,
(2.9)
т.е. молярная теплоемкость газа при постоянном объеме Сv равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К. Согласно формуле (2.1),
 ,
,
тогда
 .
(2.10)
.
(2.10)
Если газ нагревается при постоянном давлении, то выражение (2.8) можно записать в виде
 .
.
Учитывая,
что
 не зависит от вида процесса и всегда
равна Cv
(2.9);
не зависит от вида процесса и всегда
равна Cv
(2.9);
продифференцировав уравнение Клапейрона–Менделеева pVm=RT по Т (p=const), получим
 .
(2.11)
Выражение (2.11) называется
уравнением
Майера;
оно показывает, что Cp
всегда больше Cv
на величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при постоянном давлении требуется
еще дополнительное количество теплоты
на совершение работы расширения газа,
т.к. постоянство давления обеспечивается
увеличением объема газа.
.
(2.11)
Выражение (2.11) называется
уравнением
Майера;
оно показывает, что Cp
всегда больше Cv
на величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при постоянном давлении требуется
еще дополнительное количество теплоты
на совершение работы расширения газа,
т.к. постоянство давления обеспечивается
увеличением объема газа.
Использовав (2.10), выражение (2.11) можно записать в виде
 .
(2.11)
При рассмотрении термодинамических
процессов важно знать характер-
ное
для каждого газа отношение Сp
к Сv
.
(2.11)
При рассмотрении термодинамических
процессов важно знать характер-
ное
для каждого газа отношение Сp
к Сv
 .
(2.12)
.
(2.12)
Из формул (2.10) и (2.11) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющихся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными а с повышение температуры добавляются одна колебательная степень свободы.
По
закону равномерного распределения
энергии по степеням свободы, для
комнатных температур
 .
.
Из
качественной экспериментальной
зависимости молярной теплоемкости Сv
водорода (рис. 58) следует, что Сv
зависит от температуры; при
низкой
температуре (50K)
 ,
при комнатной -
,
при комнатной -
 (вместо расчетных
(вместо расчетных
 )
и очень высокой -
.
)
и очень высокой -
.
Рис. 58 |
Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных - добавляется их вращение, а при высоких - к этим двум видам движения прибавляется еще и колебание молекул. |
Расхождение
теории и эксперимента нетрудно объяснить.
Дело в том, что при вычислении теплоемкости
надо учитывать квантование энергии
вращения и колебаний молекул (возможны
не любые вращательные и колебательные
энергии, а лишь определенный дискретный
ряд значений энергий). Если энергия
теплового движения недостаточна,
например, для возбуждения колебаний,
то эти колебания не вносят своего вклада
в теплоемкость (соответствующая степень
свободы "замораживается" – к ней
неприменим закон равнораспределения
энергии). Этим объясняется, что
теплоемкость моля двухатомного газа
- водорода - при комнатной температуре
равна
 вместо
.
Аналогично можно объяснить уменьшение
теплоемкости при низкой температуре
("замораживаются вращательные степени
свободы) и увеличение при высокой
("возбуждаются" колебательные
степени свободы).
вместо
.
Аналогично можно объяснить уменьшение
теплоемкости при низкой температуре
("замораживаются вращательные степени
свободы) и увеличение при высокой
("возбуждаются" колебательные
степени свободы).
19. Применение первого начала термодинамики к изопроцессам.

