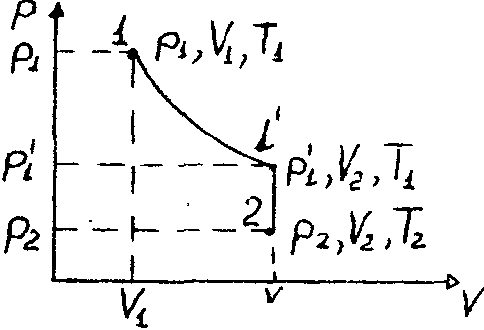- •Вопросы к экзамену для бакалавров
- •Раздел 1. Механика и молекулярная физика
- •1.2. Скорость
- •1.3. Ускорение и его составляющие
- •1.4 Угловая скорость и угловое ускорение
- •2.2. Второй закон Ньютона
- •2.3. Третий закон Ньютона
- •2.4. Силы трения
- •Сила тяжести и вес. Невесомость
- •Сила всемирного тяготения
- •2.5. Закон сохранения импульса. Центр масс
- •3.1. Энергия, работа, мощность
- •3.2. Кинетическая и потенциальная энергии
- •3.3. Закон сохранения энергии
- •4.1. Момент инерции
- •4.4. Момент импульса и закон его сохранения
- •7. Момент силы. Основной закон динамики вращательного движения. Кинетическая энергия вращательного движения.
- •4.3. Момент силы. Уравнение динамики вращательного движения твердого тела
- •4.2. Кинетическая энергия вращения
- •5.1. Гармонические колебания и их характеристики
- •5.2. Механические гармонические колебания
- •5.4. Сложение гармонических колебаний одного направления и одинаковой частоты. Биения
- •5.5. Сложение взаимно перпендикулярных колебаний
- •Основы молекулярной физики и термодинамики
- •1. Молекулярно-кинетическая теория идеального газа
- •1.1. Опытные законы идеального газа
- •1.2. Уравнение Клапейрона-Менделеев
- •1.3. Основное уравнение молекулярно-кинетической теории идеальных газов
- •Тогда давление газа, оказываемое им на стенку сосуда
- •Уравнение (1.11) с учетом (1.12) примет
- •1.4. Закон Максвелла для распределениямолекул идеального газа по скоростям
- •2.1. Число степеней свободы молекулы. Закон равномерного распределения энергиипо степеням свободы молекул
- •2.2. Первое начало термодинамики
- •2.3. Работа газа при изменении его объема
- •2.4. Теплоемкость
- •2.5. Применение первого начала термодинамики к изопроцессам
- •Тогда для произвольной массы газа получим
- •Раздел 2. Электричество. Постоянный ток. Магнетизм
- •1.2. Закон Кулона
- •1.3. Электростатическое ноле. Напряженность электростатического поля
- •1.4. Теорема Гаусса для электростатического поля
- •1.5. Применение теоремы Гаусса к расчету некоторых электростатических полей в вакууме
- •1.6. Циркуляция вектора напряженности электростатического поля
- •1.7. Потенциал электростатического поля
- •1.9. Вычисление разности потенциалов по напряженности поля
- •2.1. Электрический ток. Сила и плотность тока
- •2.3. Закон Ома. Сопротивление проводников
- •Действие магнитного поля на движущийся заряд
- •3.7. Движение заряженных частиц в магнитном поле
- •Работа по перемещению проводника и контура с током в магнитном поле
- •3.14. Закон Фарадой и его вывод из закона сохранения энергии
- •Раздел 3. Оптика и атомная физика
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Расчет интерференционной картины от двух источников
- •Если оптическая разность хода равна целому числу волн в вакууме
- •Интерференция света в тонких пленках
- •Применение интерференции света
- •4.1. Принцип Гюйгенса-Френеля
- •4.2. Метод зон Френеля. Прямолинейное распространение света
- •Дифракция Фраунгофера на одной щели
- •Дифракция Фраунгофера на дифракционной решетке
- •Поляризация света при отражении и преломлениина границе двух диэлектриков
- •Закон Стефана-Больцмана и смещение Вина
- •Планк вывел для универсальной функции Кирхгофа формулу
- •Модели атома Томсона и Резерфорда
- •Постулаты Бора
- •7.4. Спектр атома водорода по Бору
- •Линейчатый спектр атома водорода
- •Корпускулярно-волновой дуализм свойств вещества
- •Спин электрона. Спиновое число
- •Согласно общим выводам квантовой механики, спин квантуется по закону
- •11.2. Дефект массы и энергия связи ядра
1.2. Уравнение Клапейрона-Менделеев
Как уже указывалось, состояние некоторой массы определяется тремя термодинамическими параметрами: давлением р , объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния.
Французский физик Б.Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля-Мариотта и Гей-Люссака.
Рис. 49 |
Пусть некоторая масса газа занимает объем V1, имеет давление p1 и находится при температуре T1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами р2, V2, T2 (рис. 49). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: |
1) изотермического (изотерма 1-1),
2) изохорного (изохора 1-2).
В соответствии с законами Бойля-Мариотта (1.1) и Гей-Люссака (1.4) запишем:
 (1.5)
(1.5)
 .
(1.6)
.
(1.6)
Исключив из уравнений (1.5) и (1.6) p1' , получим

Так
как состояния 1 и 2 были выбраны
произвольно, то для данной массы газа
величина
 остается постоянной, т.е.
остается постоянной, т.е.
 .
(1.7)
Выражение (1.7) является
уравнением Клапейрона, в котором В -
газовая постоянная, различная для
разных газов.
.
(1.7)
Выражение (1.7) является
уравнением Клапейрона, в котором В -
газовая постоянная, различная для
разных газов.
Русский ученый Д.И.Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (1.7) к одному молю, использовав молярный объем Vm. Согласно закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет одинакова для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной. Уравнению
PVm=RT (1.8)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Менделеева-Клапейрона.
Числовое значение молярной газовой постоянной определим из формулы (1.8), полагая, что моль газа находится при нормальных условиях (р0=1,013105 Па, Т0=273,15 К, Vm=22,4110-3 м3 /моль): R=8,31 Дж/(моль К).
От
уравнения (1.8) для моля газа можно перейти
к уравнению Клапейрона-Менделеева для
произвольной массы газа. Если при
некотором заданном давлении и температуре
один моль газа занимает объем Vm,
то при тех же условиях масса m
газа займет объем
 ,
где М - молярная
масса
(масса одного моля вещества). Единица
молярной массы - килограмм на моль
(кг/моль). Уравнение Клапейрона-Менделеева
для массы m газа
,
где М - молярная
масса
(масса одного моля вещества). Единица
молярной массы - килограмм на моль
(кг/моль). Уравнение Клапейрона-Менделеева
для массы m газа
 ,
(1.9)
,
(1.9)
где
![]() - количество вещества.
- количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
 .
.
Исходя из этого, уравнение состояния (1.8) запишем в виде
 ,
,
где
 -
концентрация молекул (число молекул в
единице объема). Таким образом, из
уравнения
-
концентрация молекул (число молекул в
единице объема). Таким образом, из
уравнения
р=nkT (1.10) следует, что давление идеального газа при данной температуре прямо пропор-ционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1 м3 газа при нормальных условиях, называется числом Лошмидта:
 .
.
14. Основное уравнение молекулярно-кинетической теории идеальных газов.