
- •Оглавление
- •Введение
- •Дедактическая единица 1 общая и неорганическая химия
- •1. Моль. Эквивалент. Закон эквивалентов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •2. Строение атома и периодическая система элементов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •3. Классы неорганических соединений
- •Химические свойства оксидов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •4. Способы выражения состава растворов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •5. Окислительно-восстановительные реакции
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Дедактическая единица 2 физическая химия
- •6. Основы химической термодинамики. Термохимия
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •7. Основы химической термодинамики. Энтропия. Энергия Гиббса
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •8. Химическая кинетика и равновесие
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •9. Общие свойства растворов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •10. Электрохимические процессы. Гальванические элементы
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •11. Электрохимические процессы. Коррозия металлов
- •Классификация металлов по термодинамической неустойчивости
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •12. Электрохимические процессы. Электролиз
- •3. Электролиз раствора хлорида натрия с нерастворимым анодом.
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Библиографический список
- •Значения некоторых фундаментальных постоянных
- •Принятые сокращения и величины
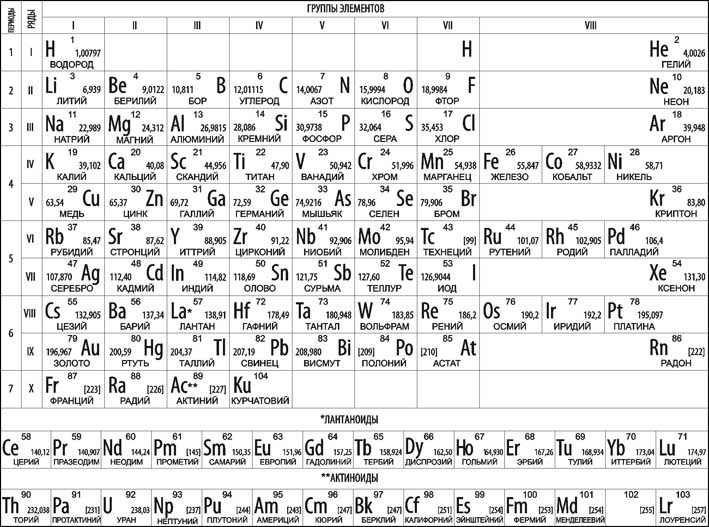
- •Периодическая таблица Менделеева
- •Потенциал ионизации атомов, сродство атомов к электрону и электроотрицательность элементов
- •Термодинамические константы некоторых веществ
- •Стандартные электродные потенциалы φ° некоторых металлов (ряд напряжений)
- •Варианты контрольных заданий
- •644099, Г. Омск, ул. П. Некрасова, 10
- •644099, Г. Омск, ул. П. Некрасова, 10
- •Сборник задач по химии
Периодическая таблица Менделеева

ПРИЛОЖЕНИЕ 4
Таблица П.3
Потенциал ионизации атомов, сродство атомов к электрону и электроотрицательность элементов
Элемент |
Энергия ионизации, I, эВ |
Сродство, Е, эВ |
Электроотрицательность, χ |
1 |
2 |
3 |
4 |
Al |
5,99 |
–0,46 |
1,47 |
Ar |
15,76 |
(0,37) |
– |
As |
9,82 |
–1,07 |
2,20 |
Ba |
5,21 |
(0,48) |
0,97 |
Br |
11,84 |
–3,37 |
2,74 |
C |
11,26 |
–1,27 |
2,50 |
Ca |
6,11 |
(1,93) |
1,04 |
Cd |
8,99 |
(0,27) |
1,46 |
Cl |
12,97 |
–3,61 |
2,83 |
Co |
7,87 |
–0,94 |
1,70 |
Cr |
6,77 |
–0,98 |
1,56 |
Cs |
3,89 |
–0,39 |
0,86 |
F |
17,42 |
–3,49 |
4,10 |
Fe |
7,89 |
–0,58 |
1,64 |
Ge |
7,90 |
–1,74 |
2,02 |
H |
13,60 |
–0,75 |
2,10 |
I |
10,45 |
–3,08 |
2,21 |
K |
4,34 |
–0,47 |
0,91 |
Li |
5,39 |
–0,59 |
0,97 |
Mg |
7,65 |
(0,22) |
1,23 |
Mn |
7,44 |
(0,97) |
1,60 |
Mo |
7,10 |
–1,18 |
1,30 |
N |
14,53 |
(0,21) |
3,07 |
Na |
5,14 |
–0,34 |
1,01 |
Nb |
6,88 |
–1,13 |
1,23 |
Ni |
7,63 |
-1,28 |
1,91 |
O |
13,62 |
–1,47 |
3,50 |
P |
10,49 |
–0,80 |
2,10 |
Pa |
5,89 |
– |
1,14 |
Re |
7,88 |
–0,15 |
1,46 |
S |
10,36 |
–2,08 |
2,60 |
Sb |
8,64 |
–1,05 |
1,82 |
Se |
9,75 |
–2,02 |
2,48 |
Окончание табл. П.3 |
|||
1 |
2 |
3 |
4 |
Si |
8,15 |
–1,38 |
1,74 |
Sr |
5,69 |
(1,51) |
0,99 |
Tc |
7,28 |
–0,73 |
1,36 |
Te |
9,01 |
–1,96 |
2,01 |
Th |
6,08 |
– |
1,11 |
V |
6,74 |
–0,64 |
1,45 |
Xe |
12,13 |
(0,45) |
– |
ПРИЛОЖЕНИЕ 5
Таблица П.4
Таблица кислот
№ п/п |
Название кислоты |
Химическая формула кислоты |
Формула кислотного остатка |
Название кислотного остатка |
1 |
2 |
3 |
4 |
5 |
Бескислородные кислоты |
||||
1 |
Азотоводородная (мышьяк) |
H3N |
N3– |
Нитрид |
2 |
Бромоводородная |
HBr |
Br– |
Бромид |
3 |
Йодоводородная |
HJ |
J– |
Иодид |
4 |
Мышьяководородная |
H3As |
As3– |
Арсенид |
5 |
Родановодородная |
HCNS |
CNS– |
Роданид |
6 |
Селеноводородная |
H2Se |
Se2– |
Селенид |
7 |
Сероводородная |
H2S |
S2– |
Сульфид |
8 |
Теллуроводородная |
H2Te |
Te2– |
Теллурид |
9 |
Фосфороводородная |
H3P |
P3– |
Фосфид |
10 |
Фтороводородная (плавиковая) |
HF |
F– |
Фторид |
11 |
Хлороводородная (соляная) |
HCl |
Cl– |
Хлорид |
12 |
Циановодородная (синильная) |
HCN |
CN– |
Цианид |
Кислородсодержащие кислоты |
||||
13 |
Алюминиевая |
HAlO2 |
AlO2– |
Алюминат |
14 |
Азотная |
HNO3 |
NO3– |
Нитрат |
15 |
Азотистая |
HNO2 |
NO2– |
Нитрит |
16 |
Бериллевая |
H2BeO2 |
BeO22– |
Бериллат |
Окончание табл. П.4 |
||||
1 |
2 |
3 |
4 |
5 |
17 |
Борная |
H3BO3 |
BO33– |
Борат |
18 |
Ванадиевая |
HVO3 |
VO3– |
Ванадат |
19 |
Висмутовая |
HBiO3 |
BiO3– |
Висмутат |
20 |
Вольфрамовая |
H2WO4 |
WO42– |
Вольфрамат |
21 |
Двухромовая |
H2Cr2O7 |
Cr2O72– |
Бихромат |
22 |
Кремниевая |
H2SiO3 |
SiO32– |
Силикат |
23 |
Марганцовая |
HMnO4 |
MnO4– |
Перманганат |
24 |
Молибденовая |
H2MoO4 |
MoO42– |
Молибдат |
25 |
Мышьяковая |
H3AsO4 |
AsO43– |
Арсенат |
26 |
Мышьяковистая |
H3AsO3 |
AsO33– |
Арсенит |
27 |
Оловянная |
H2SnO3 |
SnO32– |
Станнат |
28 |
Рениевая |
HReO4 |
ReO4– |
Перренат (ренат) |
29 |
Селеновая |
H2SeO4 |
SeO42– |
Селенат |
30 |
Селенистая |
H2SeO3 |
SeO32– |
Селенит |
31 |
Серная |
H2SO4 |
SO42– |
Сульфат |
32 |
Сернистая |
H2SO3 |
SO32– |
Сульфит |
33 |
Теллуровая |
H2TeO4 |
TeO42– |
Теллурат |
34 |
Титановая |
H2TiO4 |
TiO42– |
Титанат |
35 |
Угольная |
H2CO3 |
CO32– |
Карбонат |
36 |
Уксусная |
CH3COOH |
CH3COO– |
Ацетат |
37 |
Фосфорная |
H3PO4 |
PO43– |
Фосфат |
38 |
Хлорная |
HClO4 |
ClO4– |
Перхлорат |
39 |
Хромовая |
H2CrO4 |
CrO42– |
Хромат |
40 |
Цинковая |
H2ZnO2 |
ZnO22– |
Цинкат |
ПРИЛОЖЕНИЕ 6
Таблица П.5
Таблица растворимости
Катион анион |
H+ |
NH4+ |
K+ |
Na+ |
Ag+ |
Ba2+ |
Ca2+ |
Mg2+ |
Zn2+ |
Cu2+ |
Hg2+ |
Pb2+ |
Fe2+ |
Fe3+ |
Al3+ |
OH- |
|
P |
P |
P |
– |
P |
M |
M |
H |
H |
– |
H |
H |
H |
H |
NO3- |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
Cl- |
P |
P |
P |
P |
H |
P |
P |
P |
P |
P |
P |
M |
P |
P |
P |
S2- |
P |
P |
P |
P |
H |
P |
– |
– |
H |
H |
H |
H |
H |
H |
– |
SO32- |
P |
P |
P |
P |
M |
M |
M |
P |
M |
– |
– |
H |
M |
– |
– |
SO42- |
P |
P |
P |
P |
M |
H |
M |
P |
P |
P |
– |
M |
P |
P |
P |
CO32- |
P |
P |
P |
P |
H |
H |
H |
H |
H |
– |
H |
H |
H |
– |
– |
SiO32- |
H |
– |
P |
P |
H |
H |
H |
H |
H |
– |
– |
H |
H |
– |
– |
PO43- |
P |
P |
P |
P |
H |
H |
H |
H |
H |
H |
H |
H |
H |
H |
H |
CH3COO- |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P - растворимое ( >1 г в 100 г воды); M - малорастворимое (0,001 г - 1г в 100 г воды); H - нерастворимое (< 0,001 г в 100 г воды); – - разлагается водой или не существует. |
|||||||||||||||
ПРИЛОЖЕНИЕ 7
Таблица П.6
