
- •Оглавление
- •Введение
- •Дедактическая единица 1 общая и неорганическая химия
- •1. Моль. Эквивалент. Закон эквивалентов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •2. Строение атома и периодическая система элементов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •3. Классы неорганических соединений
- •Химические свойства оксидов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •4. Способы выражения состава растворов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •5. Окислительно-восстановительные реакции
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Дедактическая единица 2 физическая химия
- •6. Основы химической термодинамики. Термохимия
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •7. Основы химической термодинамики. Энтропия. Энергия Гиббса
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •8. Химическая кинетика и равновесие
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •9. Общие свойства растворов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •10. Электрохимические процессы. Гальванические элементы
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •11. Электрохимические процессы. Коррозия металлов
- •Классификация металлов по термодинамической неустойчивости
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •12. Электрохимические процессы. Электролиз
- •3. Электролиз раствора хлорида натрия с нерастворимым анодом.
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Библиографический список
- •Значения некоторых фундаментальных постоянных
- •Принятые сокращения и величины
- •Периодическая таблица Менделеева
- •Потенциал ионизации атомов, сродство атомов к электрону и электроотрицательность элементов
- •Термодинамические константы некоторых веществ
- •Стандартные электродные потенциалы φ° некоторых металлов (ряд напряжений)
- •Варианты контрольных заданий
- •644099, Г. Омск, ул. П. Некрасова, 10
- •644099, Г. Омск, ул. П. Некрасова, 10
- •Сборник задач по химии
Примеры решения типовых задач
Пример 1. Написать выражения закона действия масс для реакций:
а) 2NO(г) + О2(г) = 2NО2(г);
б) FeO(к) + CO(г) = Fe(к) +CО2(г).
Решение. а) V = k·[NO]2·[О2] (реакция гомогенная); б) поскольку оксид железа (II) находится в твердом состоянии, его концентрация в ходе реакции не меняется и выражение для скорости данной гетерогенной реакции будет следующим: V = k·[CO].
Пример 2. Как изменяется скорость реакции образования аммиака N2(г) + 3Н2(г) 2NН3(г) при уменьшении объема реакционного сосуда в 5 раз?
Решение. До изменения объема системы скорость реакции выражалась уравнением V = k·[N2]·[Н2]3. При уменьшении объема системы концентрация каждого компонента возрастает в 5 раз
V′ = k·5[N2]·(5[Н2])3 = 625·k·[N2]·[Н2]3.
Сравнивая выражения для v и v′, находим, что скорость реакции
возрастёт в 625 раз.
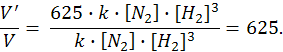
Пример 3. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г) + О2(г) 2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ
[SO2] = а; [О2] = b; [SO3] = с.
Согласно
закону действия масс скорости прямой
и обратной
![]() реакций до изменения объема
реакций до изменения объема
= K a2b, = K1 c2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а; [O2] = 3б; [SO3] = 3с. При новых концентрациях скорости V' прямой и обратной реакций:
![]() = K
(3a)2(3b);
= K
(3a)2(3b); ![]() = K1
(3c)2
= 9K1
c2.
= K1
(3c)2
= 9K1
c2.
Отсюда
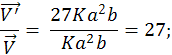

Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз. Равновесие системы сместилось в сторону образования серного ангидрида.
Пример 4. Температурный коэффициент реакции равен 3. Найдите, во сколько раз увеличится скорость этой реакции при увеличении температуры на 30 градусов.
Решение. По правилу Вант-Гоффа
![]()
![]()
Таким образом, при повышении температуры на 30 градусов скорость реакции возросла в 27 раз.
Пример 5. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 °С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
![]()
Следовательно,
скорость реакции ![]() ,
протекающей при температуре
70 °С, увеличилась по сравнению со
скоростью
реакции
,
протекающей при температуре
70 °С, увеличилась по сравнению со
скоростью
реакции
![]() ,
протекающей
при температуре 30 °С, в 16 раз.
,
протекающей
при температуре 30 °С, в 16 раз.
Пример 6. В момент установления равновесия в системе
N2(г) + 3Н2(г) 2NН3(г)
равновесные концентрации азота, водорода и аммиака соответственно равны 2,5; 1,8 и 3,6 моль/дм3. Вычислите константу химического равновесия этой реакции (K) и начальные концентрации азота и водорода.
Решение. Вычислим константу равновесия
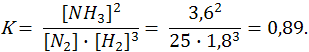
Из уравнения реакции следует, что на образование двух молей NH3 расходуется 1 моль N2. Следовательно, на образование 3,6 моль NH3 необходимо 3,6/2 = 1,8 моль N2 (убыль N2 в ходе реакции). Отсюда
[N2]исх = 2,5 + 1,8 = 4,3 моль/дм3.
Аналогично рассматриваем начальную концентрацию Н2: на образование 2 моль NH3 расходуется 3 моль Н2, а для получения 3,6 моль NH3 требуется 3,6·3/2 = 5,4 молей Н2 (убыль Н2 в ходе реакции).
[Н2]исх = 1,8 + 5,4 = 7,2 моль/дм3.
Таким образом, реакция начиналась при исходных концентрациях азота и водорода: 4,3 моль/дм3 и 7,2 моль/дм3 соответственно.
Пример 7. Константа равновесия гомогенной системы
СО(г) + Н2O(г) СO2(г) + Н2(г)
при 850 °С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/дм3, [Н2О]исх = 2 моль/дм3.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей есть величина постоянная и называется константой, равновесия данной системы K:
![]() =
k1
[СО] [Н2O];
= k2
[СО2]
[Н2];
=
k1
[СО] [Н2O];
= k2
[СО2]
[Н2];
![]()
В условии задачи даны исходные концентрации, тогда как в выражение константы равновесия входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]равн = х моль/дм3. Согласно уравнению реакции число молей образовавшегося водорода при этом будет также равно х моль/дм3. По столько же молей (х моль/дм3) СО и Н2О расходуется для образования х молей как СО2 так и Н2. Следовательно, равновесные концентрации всех четырех веществ будут равны
[СО2]равн = [Н2]равн = х моль/дм3;
[СО]равн = (3 – х) моль/дм3;
[Н2О]равн = (2 – х) моль/дм3.
Зная константу равновесия, находим значение х, а затем и исходные концентрации всех веществ

х2 = 6 – 2х – 3х + х2; 5х = 6; х = 1,2 моль/дм3.
Таким образом, искомые равновесные концентрации:
[СО2]равн = 1,2 моль/дм3;
[Н2]равн = 1,2 моль/дм3;
[СО]равн = 3 – 1,2 = 1,8 моль/дм3;
[Н2О]равн = 2 – 1,2 = 0,8 моль/дм3.
Пример 8. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РСl5(г) РСl3(г) + Сl2(г); H = + 129,7 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции разложения РСl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: а) так как реакция разложения РСl5 эндотермическая (H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РСl3 или Сl2.
Пример 9. Как повлияет повышение концентраций исходных веществ и понижение температуры и давления на равновесие реакции
СО(г) + Н2О(г) ↔ СО2(г) + Н2(г); ΔН = –41,2 кДж?
Решение. Согласно принципу Ле-Шателье увеличение концентрации СО и Н2О приведет к смещению равновесия в сторону реакции, т.е. равновесие смещается вправо, в сторону прямой реакции. Из выражения термохимического уравнения реакции следует, что прямая реакция является экзотермической (ΔН < 0), тогда понижение температуры реакции сместит равновесие в сторону нагрева системы, т.е. в сторону экзотермической реакции, вправо.
Из уравнения реакции видно, что реакция проходит в газовой фазе без изменения числа молей газообразных веществ (вступает в реакцию 2 моль и образуется 2 моль). Поэтому понижение давления не приведет к смещению химического равновесия данной реакции.
Пример 10. Вычислить, при какой температуре реакция закончится в течение 20 мин., если при 20 ºС на это требуется 3 ч. Температурный коэффициент равен 3.
Решение. Определим, во сколько раз сократится время протекания реакции 3·60/20 = 9 раз. Следовательно, скорость реакции возрастет в 9 раз. Тогда на основании уравнения Вант-Гоффа найдем температуру, при которой реакция закончится за 20 мин.
![]()
Т2 = 40 ºС.
