
- •Оглавление
- •Введение
- •Дедактическая единица 1 общая и неорганическая химия
- •1. Моль. Эквивалент. Закон эквивалентов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •2. Строение атома и периодическая система элементов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •3. Классы неорганических соединений
- •Химические свойства оксидов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •4. Способы выражения состава растворов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •5. Окислительно-восстановительные реакции
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Дедактическая единица 2 физическая химия
- •6. Основы химической термодинамики. Термохимия
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •7. Основы химической термодинамики. Энтропия. Энергия Гиббса
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •8. Химическая кинетика и равновесие
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •9. Общие свойства растворов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •10. Электрохимические процессы. Гальванические элементы
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •11. Электрохимические процессы. Коррозия металлов
- •Классификация металлов по термодинамической неустойчивости
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •12. Электрохимические процессы. Электролиз
- •3. Электролиз раствора хлорида натрия с нерастворимым анодом.
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Библиографический список
- •Значения некоторых фундаментальных постоянных
- •Принятые сокращения и величины
- •Периодическая таблица Менделеева
- •Потенциал ионизации атомов, сродство атомов к электрону и электроотрицательность элементов
- •Термодинамические константы некоторых веществ
- •Стандартные электродные потенциалы φ° некоторых металлов (ряд напряжений)
- •Варианты контрольных заданий
- •644099, Г. Омск, ул. П. Некрасова, 10
- •644099, Г. Омск, ул. П. Некрасова, 10
- •Сборник задач по химии
Тестовые задания
Т7-1. Термодинамической функцией, которая характеризует степень неупорядоченности состояния системы, является
а) энтальпия;
б) внутренняя энергия;
в) энтропия;
г) теплоемкость.
Т7-2. Если для реакции NH4NO3(т) = N2O(г) + 2 H2O(г),
ΔН = 124,2 кДж; Δ G = 186,7 кДж, то она является
а) экзотермической и при стандартных условиях протекает в обратном направлении;
б) эндотермической и при стандартных условиях протекает в обратном направлении;
в) экзотермической и при стандартных условиях протекает в прямом направлении;
г) эндотермической и при стандартных условиях протекает в прямом направлении.
Т7-3. Уравнение реакции, происходящей с увеличением энтропии, имеет вид
а) N2(г) + O2(г) = 2NO(г);
б) 2H2S(г) + 3О2(г) = 2Н2О(г) + 2SО2(г);
в) СаО(т) + СО2(г) = СаСО3(т);
г) NH4NO2(т) = N2(г) + 2 H2O(г)
Т7-4. Термическое разложение нитрата калия по реакции
2KNO3(к) = 2 KNO2(к) + O2(г)
а) сопровождается увеличением энтропии;
б) сопровождается уменьшением энтропии;
в) не приводит к изменению энтропии;
г) по уравнению реакции невозможно сделать вывод о характере изменения энтропии.
Т7-5. Не производя вычислений, указать, для каких процессов ΔS > 0
а) MgO(к) + H2(г) = Mg(к) + H2O(ж);
б) С(к) + СО2(г) = 2СО(г);
в) 4HCl(г) + O2(г) = 2Сl2(г) + 2H2O(г);
г) NH4NO3(к) = N2O(г) + 2H2O(г).
Т7-6. Если ΔH < 0 и ΔS < 0, то в каком случае реакция может протекать самопроизвольно?
а) |ΔH| > |ТΔS|;
б) |ΔH| < |ТΔS|;
в) |ΔH| = |ТΔS|;
г) |ΔH| >> |ТΔS|.
Т7-7. Изменение энтропии ΔS реакции
C4H8(г) + 6O2(г) = 4CO2(г) + 4H2O(ж)
а) ΔS > 0;
б) ΔS < 0;
в) ΔS ≈ 0;
г) по уравнению реакции невозможно оценить знак изменении энтропии.
Т7-8. Знак ΔG таяния льда при 263 К
а) ΔG > 0;
б) ΔG = 0;
в) ΔG < 0;
г) ΔG >> 0.
Т7-9. Случай, при котором реакция неосуществима при любых температурах:
а) ΔH < 0, ΔS > 0;
б) ΔH < 0, ΔS < 0;
в) ΔH > 0, ΔS > 0;
г) ΔH > 0, ΔS < 0.
Т7-10. Термическое разложение карбоната кальция по реакции
CaCO3(к) = CaO(к) + CO2(г)
а) сопровождается увеличением энтропии;
б) сопровождается уменьшением энтропии;
в) не приводит к изменению энтропии;
г) по уравнению реакции невозможно сделать вывод о характере изменения энтропии.
Т7-11. Согласно постулату Планка
а) энтропия идеального кристалла при 0 К равна нулю;
б) энтропия повышается при превращении жидкости в газ;
в) энтропия повышается при плавлении кристаллов;
г) энтропия возрастает при увеличении массы вещества.
8. Химическая кинетика и равновесие
Кинетика - учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакции является неравенство G < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Например, реакции
V2O2(г) + Н2(г) = Н2O(г);
2А1(к) + 3I2(к) = 2АlI3(к);
характеризуются отрицательными значениями ΔG при Т = 298 К и р = 101325 Па и, следовательно, возможны. Однако скорость их протекания настолько мала, что заметить их протекание практически невозможно. В стандартных условиях такие реакции идут только в присутствии катализатора.
Химические
реакции протекают с различными скоростями.
О скорости химических реакций судят по
изменению концентрации реагирующих
веществ в единицу времени. Среднюю
скорость химической реакции
![]() в данном промежутке времени находят по
формуле
в данном промежутке времени находят по
формуле
![]()
где C1 концентрация одного из реагирующих веществ в момент времени t1;
C2 концентрация этого же вещества к моменту времени t2.
Истинная скорость V, т.е. скорость реакции в данный момент времени, выражается первой производной по времени
![]()
Основными факторами, влияющими на скорость реакции, являются концентрации реагирующих веществ и температура. Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс:
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Для реакции вида aA + bB + cC → dD + fF + … закон действующих масс можно математически записать так
![]()
где CA, CB, CC концентрации веществ А, В, С (моль/дм3) в данный момент времени;
k коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости представляет собой скорость реакции, когда концентрации всех исходных веществ равны 1 моль/ дм3. По характеру протекания реакции подразделяются на три группы: одномолекулярные, двухмолекулярные и трехмолекулярные. В одномолекулярных реакциях в отдельном акте изменение претерпевает одна молекула вещества. Схематично эти реакции можно записать так
А → В + С + …
По закону одномолекулярных реакций протекают многие химические реакции разложения, изомеризации, реакция инверсии тростникового сахара, радиоактивный распад, диффузия газов.
В двухмолекулярных реакциях в отдельном акте изменение претерпевают две одинаковые или две различные молекулы веществ
2А → В + С + D + …;
A + B → C + E + F + …
Трехмолекулярные реакции, т.е. реакции, в отдельном акте которых участвуют три одинаковые или три различные молекулы, наблюдаются сравнительно редко.
3A → B + E + F + …;
A + 2B → R + N + …;
A + B + C → M + P + …
Реакции, в которых участвуют более трех молекул, протекают ступенчато, по стадиям. Общая скорость таких сложных реакций определяется скоростью наиболее медленной из стадий.
Порядок реакции не всегда совпадает с молекулярностью. Его определяют опытным путем. Особенно это важно для сложных ступенчатых реакций, когда по суммарному уравнению химической реакции совершенно невозможно судить о механизме протекания процесса.
При решении задач следует считать, что порядок реакции по определенному веществу совпадает с его стехиометрическим коэффициентом в уравнении химической реакции.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые десять градусов скорость реакции увеличивается в 2…4 раза.
![]()
где γ температурный коэффициент скорости реакции, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов.
Х имическое
равновесие
присуще обратимым химическим реакциям,
протекающим как в прямом, так и в обратном
направлениях. Химическое равновесие
наступает, когда скорость прямой реакции
имическое
равновесие
присуще обратимым химическим реакциям,
протекающим как в прямом, так и в обратном
направлениях. Химическое равновесие
наступает, когда скорость прямой реакции
![]() станет равна скорости обратной реакции
станет равна скорости обратной реакции
![]() . Т.е.
условием химического равновесия является
равенство
. Т.е.
условием химического равновесия является
равенство
![]()
Химическое равновесие имеет следующие характеристики.
1. Равновесное состояние наиболее устойчиво (наиболее вероятно), а переход к любому другому состоянию требует затраты работы.
2. Возможность подхода к состоянию равновесия с двух сторон.
3. Динамический характер равновесия: процессы при равновесии не прекращаются, а протекают в прямом и обратном направлении с одинаковой скоростью.
4. Подвижность равновесия: если на систему оказывается бесконечно малое воздействие, то система выходит из состояния равновесия. При устранении воздействия система возвращается в состояние равновесия.
5. Экстремальное значение соответствующих функций: Smax, Gmin, Fmin.
Пусть в химической реакции
aA + bB ↔ cC + dD,
участвуют идеальные газы: A, B, C, D. Тогда рA, рB, рC, рD парциальные давления газов в равновесной смеси.
Математическое выражение для константы равновесия Кр будет являться также математическим выражением закона действующих масс:
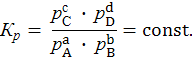
Закон действующих масс показывает, что отношение произведений парциальных давлений продуктов реакций к произведению парциальных давлений исходных веществ есть величина постоянная при данной температуре.
Константа равновесия может быть выражена через концентрацию веществ:

Т.к. давление и концентрация твёрдых веществ являются величинами постоянными при данной температуре, то они не зависят от количества вещества, и поэтому не входят в константу равновесия. Например, для реакции
C(графит) + 2 Н2(г) ↔ СН4(г);

Смещение химического равновесия описывает принцип Ле-Шателье: если на систему, находящуюся в состоянии устойчивого равновесия, оказывается внешнее воздействие, изменяющее одно из условий определяющих положение равновесия, то равновесие смещается в ту сторону уменьшения внешнего воздействия.
1) Влияние температуры: повышение температуры означает, что к системе подводится тепло, равновесие при этом смещается в сторону процесса, идущего с поглощением тепла, то есть в сторону эндотермической реакции.
2) Влияние давления: увеличение давления смещает равновесие в сторону меньших объёмов, то есть меньшего числа молей газообразных веществ. Давление оказывает влияние только на реакции, в которых участвуют вещества в газообразном состоянии.
3) Разбавление смеси индеферентным газом, т.е. газом не участвующим в данной реакции (например, азотом), действует также как уменьшение давления.
