
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
(1 – [I]=0, 2 – [I]>0, 3
– [I]>[I]2)Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
Безконкурентне інгібування
При безконкурентному інгібуванні інгібітор зв'язується лише з фермент-субстратним комплексом, але не з вільним ферментом. Субстрат, зв'язуючись з ферментом, змінює його конформацію, що робить можливим з’єднання з інгібітором. Інгібітор, у свою чергу, так міняє конформацію ферменту, що каталіз стає неможливим.
С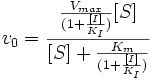 хема
і рівняння Міхаеліса-Мментен в разі
безконкурентного інгібування:
хема
і рівняння Міхаеліса-Мментен в разі
безконкурентного інгібування:
![]()
Максимальна швидкість реакції і уявна константа Міхаеліса зменшуються в однакове число раз. Тому в подвійних обернених координатах для різних концентрацій інгібітору отримуємо сімейство паралельних прямих.
Інгібування субстратом
Інгібування субстратом — окремий випадок безконкурентного інгібування, коли дві молекули субстрату зв'язуються з ферментом, що перешкоджає утворенню продукту.
Схема і рівняння Міхаеліса-Ментен в разі інгібування субстратом:
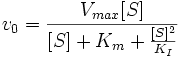
![]()
![]()
Класифікація і номенклатура ферментів Номенклатура ферментів
Ферменти мають тривіальні назви та систематичні. Назви багатьох ферментів утворюються шляхом додавання суфіксу -аза до назви субстрату. Так, фермент, що каталізує гідроліз сечовини називається уреазою (від англ. urea), фермент, що гідролізує аргінін - аргіназою. Але, багато ферментів мають назви, не пов’язані з назвами їх субстратів (пепсин, трипсин). Багато ферментів мали 2 та більше назв, що привносило плутанину в номенклатуру. Це, а також швидке зростанням кількості нових ферментів, які дослідники називали за своїм бажанням, привело до необхідності систематики номенклатури.
Пропонувалось називати ферменти в залежності від хімічної природи субстрату, на який вони діють. Але, за цим принципом важко класифікувати фермент, оскільки субстратом можуть бути різноманітні сполуки в певному класі речовин та величезна кількість проміжних продуктів обміну.
Тому, в 1961 році на V Міжнародному біохімічному конгресі в Москві Комісією по ферментам Міжнародної біохімічної спілки була розроблена сучасна класифікація та номенклатура ферментів. В основу прийнятої класифікації був покладений тип каталізованої реакції, який є специфічним для дії будь-якого ферменту. Таким чином, тип реакції разом з назвою субстрату і є основою для систематичної назви ферментів.
У відповідності з цим ферменти поділяються на шість основних класів. Кожен фермент має чотиризначний кодовий номер (шифр), кожна цифра якого позначає номер ферменту в класі (6 класів), підкласі (характеризує основні види субстратів, що беруть участь в даному типі хімічних перетворень), підпідкласі (характеризує хімічну природу сполук - донорів чи акцепторів, що приймають участь в даній підгрупі реакцій), порядковий номер ферменту у підпідкласі (згідно алфавітному порядку) і систематичну назву, яка дозволяє ідентифікувати каталізовану цим ферментом реакцію.
АТФ+D-глюкоза = АДФ+D-глюкозо-6-фосфат
Так, систематична назва фермента - АТФ: гексоза 6-фосфотрансфераза, з якої слідує, що цей фермент каталізує перенесення фосфатної групи з АТФ на гексозу. Цей фермент має шифр КФ 2.7.1.1. Де КФ – класифікація ферментів, 2 - це клас трансфераз, 7 - підклас фосфотрасферази, 1 - підпідклас фосфотрансферази з гідроксильною групою в якості акцептора, 1 - номер у підпідкласі, показує, що акцептором фосфатної групи є D-гексоза.
Якщо фермент має довгу назву, або таку, що важко вимовляється, допустимим є використання його тривіальної назви. Так, тривіальна назва вищенаведеного ферменту - гексокіназа.
