- •7. Ферменти
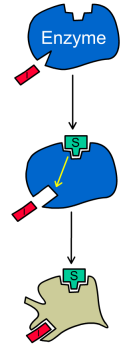
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
Оборотне інгібування
Оборотні інгібітори поділяють на конкурентні, неконкурентні, бесконкурентні.
Конкурентне інгібування
При конкурентному інгібуванні інгібітор зв'язується з активним центром ферменту і конкурує за нього з субстратом. Таким чином, конкурентний інгібітор не зв'язується з фермент-субстратным комплексом (ES на рис.1), тобто константа дисоціації фермент-інгібіторного комплексу Ki'>>1.
Конкурентний інгібітор зазвичай структурно схожий з субстратом, проте фермент не здатний каталізувати реакцію у присутності інгібітору через відсутність в останнього необхідних функціональних груп.
Оскільки при цьому субстрат та інгібітор конкурують за місце в активному центрі, цю форму інгібування назвали конкурентною.
Цей метод широко використовується в медицині. Так, для лікування інфекційних захворювань. що викликаються бактеріями, використовують сульфаніламідні препарати. Вони мають структурну схожість з параамінобензойною кислотою, яку бактерія використовує для синтезу фолієвої кислоти, що є складовою частиною ферментів бактерій. Завдяки структурній схожості сульфаніламід блокує дію ферменту шляхом витіснення параамінобензойної кислоти із комплексу з ферментом, що синтезує фолієву кислоту, що гальмує ріст бактерій. Це ж явище використовується в хіміотерапії, при якій знищуються хімічними препаратами збудники хвороби, і не пошкоджуються тканини організму-господаря.
Схема конкурентного інгібування і рівняння Міхаеліса-Ментен для нього виглядають таким чином:
![]()
![]()
![]()
![]()
Видно,
що при конкурентному інгібуванні
максимальна швидкість реакції Vmax
не змінюється,
а уявна константа
Міхаеліса збільшується
в
![]() разів.
разів.
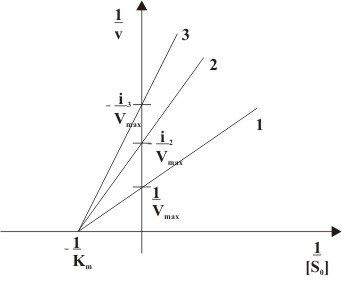
Тому в подвійних обернених координатах Лайнуївера-Берка (залежність 1/v0 від 1/[S]) при різних концентраціях інгібітору отримують сімейство прямих з різним нахилом, що перетинаються в одній точці на осі ординат.
К
 онстанту
інгібування Ki зазвичай визначають так:
проводять ряд вимірів уявної константи
Міхаеліса при різних концентраціях
інгібітору, потім будують залежність
цієї величини від концентрації інгібітору.
Тангенс кута нахилу отриманої прямої
рівний Km/Ki.
онстанту
інгібування Ki зазвичай визначають так:
проводять ряд вимірів уявної константи
Міхаеліса при різних концентраціях
інгібітору, потім будують залежність
цієї величини від концентрації інгібітору.
Тангенс кута нахилу отриманої прямої
рівний Km/Ki.
(1 – [I]=0, 2 – [I]>0,
3 – [I]>[I]2)Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
Неконкурентне інгібування
Неконкурентний інгібітор не заважає з’єднанню субстрату з ферментом. Він здатний приєднуватися як до вільного ферменту, так і до фермент-субстратного комплексу з однаковою ефективністю.
Неконкурентний інгібітор викликає такі конформаційні зміни, які не дозволяють ферменту перетворювати субстрат на продукт, але не впливає на спорідненість ферменту до субстрату.
Наприклад, цианід зв’язується з іонами металів, що виконують у ферментів роль простетичної групи, і пригнічує активність цих ферментів. Такий тип гальмування каталітичної активності називається ще алостеричним інгібуванням.
Алостеричні інгібітори зв'язуються з окремими ділянками ферменту поза активним центром, викликаючи конформаційні зміни в молекулі ферменту, а саме оборотні зміни в структурі його активно центру. Таке з’єднання призводить до зменшення активності ферменту в результаті зменшення спорідненість ферменту до субстрату. Алостеричні ефекти зустрічаються практично тільки у олігомерних ферментів.
Схема і рівняння Міхаеліса-Ментен в разі неконкурентного інгібування:
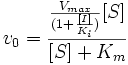
![]()
![]()
П
 ри
неконкурентному інгібуванні константа
Міхаеліса не змінюється,
а максимальна
швидкість
реакції зменшується
в
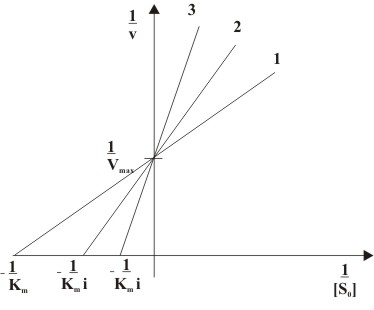
разів. Тому в подвійних обернених
координатах сімейство прямих, що
відповідають різним концентраціям
інгібітору, перетинаються в одній точці
на осі абсцис.
ри
неконкурентному інгібуванні константа
Міхаеліса не змінюється,
а максимальна
швидкість
реакції зменшується
в
разів. Тому в подвійних обернених
координатах сімейство прямих, що
відповідають різним концентраціям
інгібітору, перетинаються в одній точці
на осі абсцис.