
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
Кінетика ферментативних реакцій
В
k+1
k+2 E
+ S <=> ES –> E + P
k–1
де k+1 - константа швидкості прямої реакції, k-1 - константа швидкості зворотної реакції, k+2 - константа швидкості розпаду фермент-субстратного комплексу на фермент і продукт.
Міхаеліс та Ментен розробили загальну теорію ферментативної кінетики. Математична обробка на основі закону діючих мас дала можливість вивести рівняння, назване на честь авторів рівнянням Міхаеліса-Ментен, яке виражає кількісне співвідношення між концентрацією субстрату та швидкістю ферментативної реакції:
v=vmax[S] /(Ks + [S]),
де v - швидкість реакції при даній концентрації субстрату[S],
vmax - максимальна швидкість реакції при повному насиченні ферменту субстратом;
Ks - константа дисоціації фермент-субстратного комплексу (субстрат на константа), моль/л:
![]()
З рівняння Міхаеліса–Ментен витікає, що:
при високій концентрації субстрату та низькому значенні Ks швидкість реакції є максимальною (v=vmax), тобто весь фермент знаходиться у вигляді фермент-субстратного комплексу;
при низькій концентрації субстрату, навпаки, швидкість реакції виявляється пропорційною концентрації субстрату в кожний даний момент.
Рівняння Міхаеліса - Ментен в його класичному вигляді не враховує впливу на швидкість ферментативного процесу продуктів реакції, тому Бріггс та Холдейн вдосконалили це рівняння:
v=vmax[S] /( Кm + [S]),
де Km - константа Міхаеліса, моль/л.
Константа Міхаеліса (Km) представляє відношення констант швидкостей всіх трьох реакцій, що здійснюються в процесі ферментативного каталізу:
![]() або
або
![]() .
.
![]() завжди
дещо вища за числовим значенням, ніж
Ks.
Так, Ks для комплексу сахарази і сахарози
дорівнює 0,0167М, а
складає 0,0280М.
завжди
дещо вища за числовим значенням, ніж
Ks.
Так, Ks для комплексу сахарази і сахарози
дорівнює 0,0167М, а
складає 0,0280М.
Швидкість хімічної реакції, що прискорюється ферментом (як і швидкість звичайної хімічної реакції), вимірюють кількістю молей субстрату, що перетворюється на одиницю часу. Проте принципово поважно, аби при цьому підтримувалися стандартні умови для прояву активності ферменту: температура 25° С, оптимальне значення рН і, що особливо важливо, повне насичення ферменту субстратом.
Швидкість
ферментативної реакції, виміряної при
дотриманні перерахованих умов, позначають
V
і називають максимальною швидкістю
ферментативної реакції. Вона
визначається концентрацією ферменту
і константою швидкості розпаду комплексу
фермент-продукт:
![]() .
.
Таким чином, константа Міхаеліса – це така концентрація субстрату, при якій швидкість даної ферментативної реакції представляє половину максимальної.
Ця константа є важливою характеристикою ферментативної реакції і характеризує спорідненість ферменту до субстрату і здатність ферменту утворювати продукти реакції. Якщо константа Міхаеліса велика, то ЕS легко розпадається на похідні речовини і реакція протікає повільно. Якщо низьке значення константи Міхаеліса, реакція протікає швидко. Km та vmax для даного ферменту і субстрату при певних умовах зовнішнього середовища (рН, t0, р) величини сталі.
Чим менша константа Міхаеліса, тим більша спорідненість ферменту до субстрату і реакція протікає швидко; якщо константа Міхаеліса велика, то спорідненість ферменту до субстрату низька і реакція протікає повільно, оскільки фермент-субстратний комплекс легко розпадається на складові.
Km визначають графічно за результатами вимірювань швидкості реакції при різних концентраціях субстрату. Згідно рівняння Холдейна і Бріггса, залежність швидкості ферментативної реакції від концентрації субстрату при незмінній концентрації ферменту графічно виражається наступним чином:
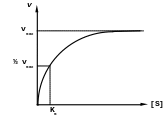
При досягненні деякої концентрації субстрату, швидкість ферментативної реакції повинна досягати максимального значення і при подальшому збільшенні концентрації субстрату вже не змінюється.
Виходячи з рівняння та цього графіка можливо графічно визначити константу Міхаеліса, яка буде відповідати відрізку на осі абсцис, що відповідає швидкості, рівній половині максимальній. Але користуватись таким графіком, побудованим у прямих координатах незручно, тому що максимальна швидкість є асимптотичною величиною та визначається недостатньо точно.
Для визначення константи Міхаеліса та максимальної швидкості ферментативної реакції використовують метод подвійних обернених величин Лайнуївера–Берка (якщо є рівність між двома величинами, то повинна бути рівність і між оберненими величинами):
![]()
Рівняння Лайнуївера–Берка – рівняння прямої лінії. Якщо побудуємо графік в координатах 1/v (Y) від 1/[S] (Х), то матимемо пряму лінію, тангенс кута нахилу якої буде рівний величині Кm /vmax, відрізок, що відсікається прямою від осі ординат, представляє собою 1/vmax, якщо продовжити пряму лінію за вісь ординат, тоді на осі абсцис відсікається відрізок, що відповідає зворотній величині -1/Кm.

