
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
Теорія ферментативного каталізу
Уявімо собі суміш бензину та кисню. Реакція між ними з термодинамічної точки зору можлива, але вона не піде без витрати деякої кількості енергії, що поступить, наприклад, у вигляді іскри. Енергія, необхідна для того, щоб примусити субстрати вступити в реакцію, тобто необхідна для переведення молекул в активований стан, називається енергією активації. Чим більша необхідна енергія активації, тим нижче швидкість реакції при даній температурі.
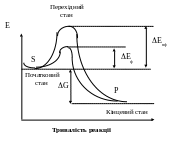
де: S -
початковий субстрат;
Р - продукт;
Енф
- енергія активації неферментативної
реакції;
Еф
- енергія активації ферментативної
реакції;
G -
стандартна зміна вільної енергії.
Ферменти, діючи як каталізатори, знижують енергію активації, яка потрібна для того, щоб могла пройти реакція, шляхом збільшення числа активованих молекул, які стають реакційноздатними на більш низькому енергетичному рівні. Вони підвищують загальну швидкість реакції, не змінюючи в значній мірі температуру, при якій ця реакція протікає.
П
I II III E
+ S <=> ES –> ES* –> E + P
В утворенні фермент-субстратних комплексів беруть участь водневі зв’язки, електростатичні та гідрофобні взаємодії, а також в ряді випадків ковалентні зв’язки.
І етап: утворення фермент-субстратного комплексу через активний центр;
ІІ етап: активація фермент-субстратного комплексу – зв’язування субстрату відбувається в декількох точках активного центру, що призводить до зміни структури субстрату, його деформації за рахунок послаблення енергії зв’язків в молекулі. При цьому відбувається хімічна модифікація субстрату і перетворення його у певний продукт;
ІІІ етап: в результаті перетворення субстрату у продукт він втрачає здатність утримуватися в активному центрі ферменту і фермент-продуктний комплекс дисоціює на складові.
Найшвидше реакція відбувається на першому етапі. Низька енергія активації свідчить про те, що в первинному комплексі фермент і субстрат зв’язуються за рахунок слабких типів зв’язку. На другому етапі перетворення молекули субстрату відбувається з розривом і утворенням ковалентних зв’язків. На цьому етапі фермент змінює молекулу субстрату так, що міцність окремих хімічних зв’язків зменшується. В результаті чого знижується енергія активації і реакція відбувається з великою швидкістю.
Отже, фермент знижує бар’єр активації реакції, ділячи її на ряд проміжних етапів, кожний з яких не зустрічає енергетичних перешкод. Основна роль у механізмі ферментативного каталізу належить фермент-субстратним комплексам.
Фішер в 1890 р. запропонував теорію, згідно якої для того, щоб відбулась ферментативна реакція, необхідно, щоб мала місце відповідність форми молекули ферменту формі молекули субстрату. Цю гіпотезу називають гіпотезою “ключа і замка”: субстрат порівнюється в ній з ключем, який повинен точно підходити по формі до “замку”, тобто до ферменту.
Нову інтерпретацію цієї гіпотези запропонував у 1959 р. Кошланд. На основі даних, що дозволяють вважати активні центри фізично більш пластичними, він вважав, що можлива динамічна взаємодія між ферментом і субстратом. Згідно цьому уявленню, субстрат, з’єднуючись з ферментом, викликає і якістну зміну в структурі останнього. Амінокислотні залишки, що складають активний центр, приймають певну форму, яка дає можливість ферменту найбільш ефективно виконати свою функцію. Цю гіпотезу називають гіпотезою індукованої відповідності або “руки і перчатки”. Аналогією може слугувати перчатка, яка при одяганні на руку змінює свою форму.
Вчення про швидкість ферментативних реакцій та її залежність від різних факторів вивчає ферментативна кінетика.
