
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
Всі ізомерази відіграють важливу роль в обміні речовин.
– тріозофосфат-ізомераза бере участь у процесі бродіння, каталізує перетворення 3-фосфогліцеринового альдегіду в фосфодіоксіацетон:

- глюкозофосфат-ізмераза каталізує взаємне перетворення глюкопіранозо-6-фосфату та фруктофуранозо-6-фосфату.
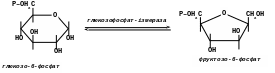
6. Лігази
Лігази (синтетази), клас ферментів, що каталізують з’єднання двох молекул, що супроводжується розщепленням пірофосфатного зв’язку в молекулі нуклеозидтрифосфату (НТФ) - зазвичай АТФ, рідше гуанозин- або цитозинтрифосфату.
Підкласи лігаз (їх п'ять) сформовані за типом зв'язків, які утворюються в результаті реакції, а підпідкласи - за типом субстратів.
До лігаз, що каталізують реакції, в яких утворюються зв'язки С-О, відносять аміноацил-тРНК-синтетази, що каталізують ацилювання транспортних РНК відповідними амінокислотами (відіграють віжливу роль в біосинтезі білка).
- аланіл-тРНК-синтетаза

Утворення зв'язку С-S каталізують ферменти, що беруть участь в синтезі ацильних похідних коферменту А (див. пантотенова кислота).
Ці ферменти утворюють C–S-зв’язок між залишком карбонової кислоти та КоА.
- ацетилкоензим А -синтетаза – каталізує приєднання залишків різних органічних кислот до коензиму А.

До ферментів, що беруть участь в утворенні зв'язку С-N, відносять амідсинтетази (каталізують утворення амідов з кислот і NH3 або амінів, напр. глутамінсинтетаза), пептидсинтетази (каталізують утворення пептидного зв'язку, напр. L-глутамілцистеїнсинтетаза), цикло-лігази (каталізують утворення гетероциклів, що містять в кільці атом N, наприклад фосфорибозиламіноімідазол–синтетаза) і деякі інші.
– пептидсинтетази – каталізують утворення пептидних зв’язків
- глютамінсинтетаза – каталізує реакцію синтезу глютаміну з глютамінової кислоти та аміаку.

- аспарагінсинтетаза – каталізує реакцію синтезу аспарагіну з аспарагінової кислоти та аміаку.
Реакції, в результаті яких утворюється зв'язок С-С, каталізують карбоксилюючі ферменти (карбоксилази), що містять як кофактор біотин, наприклад піруваткарбоксилаза.
Карбоксилази при участі АТФ каталізують приєднання діоксиду вуглецю до різних органічних кислот, тобто реакцію подовження вуглецевого ланцюгу.
- піруваткарбоксилаза каталізує синтез щавелевооцтової кислоти з піровиноградної:
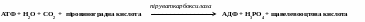
Ряд лігаз (наприклад, полідезоксирибонуклеотид-синтетаза) каталізує утворення фосфодіефірних зв'язків в нуклеїнових кислотах (так звані репаруючі ферменти). У зв'язаній реакції гідроліз пірофосфатного зв'язку може здійснюватися між - і - або - і -фосфатними групами:
![]()
У реакції X і Y – субстрати, НДФ і НМФ - відповідно нуклеозиддифосфат і нуклеозидмонофосфат, Ф і ПФ – відповідно фосфорна і пірофосфорна кислоти.
Для лігаз, у яких в зв'язаній реакції АТФ гідролізуєтся до аденозинмонофосфату (АМФ) і пірофосфату, запропонований механізм, згідно якого в якості інтермедіату утворюється ацил-АМФ; в цьому випадку АТФ реагує безпосередньо з субстратом X або Y.
Деякі лігази (наприклад, L-глутамілцистеїнсинтетаза) функціонують за механізмом трьохстадійного перенесення, для якого характерне утворення ковалентного проміжного похідного ферменту:
Е + АТФ : Е–Ф + АДФ;
Е-Ф + X : Е–X + Ф;
Е-X + У : X–У + Е
де Е – фермент, АДФ – аденозиндифосфат.
Реакції, що каналізують лігази, відіграють важливу роль в біосинтезі і функціонуванні всіх організмів.
