
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
Пектиназа




Аналогічно крохмалю і глікогену гідролізуються інші природні полісахариди:
целюлоза — за участю целюлазного комплексу ферментів (складається з ендо-1,4-b-глюканази, екзоцелобіогідролази, целобіази і екзо-1,4-b-глюкогідролази),
інулін — за допомогою інулінази (2,1-b-D-фруктанфруктаногідролази),
хітин — хітинази,
ксилан — ксиланази,
гіалуронова кислота — гіалуронідази,
пектинові речовини — комплексу пектинолітичних ферментів (пектинестерази, полігалактуронази і ін.) і т.п.
У всіх випадках полісахариди розпадаються до відповідних моносахаридів або їх похідних (інколи до дисахаридів), з яких складаються молекули вказаних полісахаридів.
Деякі з гідролаз, перерахованих вище, широко розповсюджені в природі, інші (целюлаза, інуліназа) — властиві лише певним видам рослин, тварин і мікроорганізмів.
Особливу увагу привертають целюлази, хітинази, 1,3- і 1,6-b-глюканази і ліхенази (гідролізують гетерополісахариди з 1,3- і 1,4-глікозидними зв'язками, що переміжаються), оскільки вони розкладають рослинні і мікробні залишки, що є екологічно небезпечними відходами виробництва, дозволяючи при цьому отримувати глюкозу і N-ацетилглюкозамін.
Деякі з них, наприклад, хітинази з Bacillus cereus прискорюють реакцію гідролізу хітину при рН=4 і t = 60°С до хітобіози, але не до N-ацетил-b-D-глюкозаміну.
3. Пептидгідролази (протеази).
Ферменти цього підкласу прискорюють гідроліз пептидних зв'язків в білках і пептидах, а за певних умов також і утворення пептидних зв'язків, хоча цей шлях синтезу білка не є фізіологічним.
Х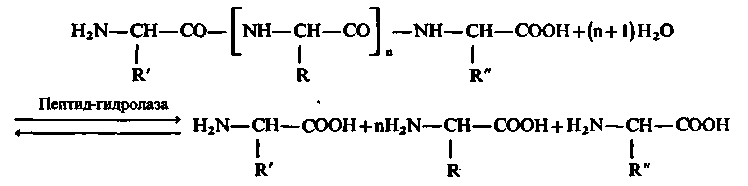 імізм
процесу гідролізу білків і пептидів за
участю пептидгідролаз можна виразити
наступною схемою:
імізм
процесу гідролізу білків і пептидів за
участю пептидгідролаз можна виразити
наступною схемою:
Серед пептидгідролаз розрізняють:
протеїнази, що каталізують гідроліз невеликого числа внутрішніх пептидних зв'язків в білковій молекулі, внаслідок чого остання розпадається до пептидів; отже вони є ендопептидазами,
пептидази, що забезпечують відщеплення від пептидного ланцюга вільних амінокислот; отже вони є екзопептидазами.
3.1. Протеїнази
Протеїнази залежно від механізму їх дії на внутрішні пептидні зв'язки в білковій молекулі ділять на 4 підпідкласа:
1) серинові протеїнази, що несуть в активному центрі радикали сер і гіс, що забезпечують здійснення каталітичної дії; представниками їх є:
хімотрипсин і трипсин, що виділяються підшлунковою залозою,
субтилізин, що продукується бактеріями, і др.;
2) тіолові (цистеїнові) протеїнази, що мають в активному центрі залишок цис; до їх числа належать:
папаїн з латексу динного дерева Carica papaya,
фіцин з латексу фікуса,
бромелаїн з соку ствола ананаса,
катепсин В — внутріклітинний фермент хребетних та ін.;
3) кислі (карбоксильні) протеїнази, що мають оптимум рН нижче 5 і містять радикали дикарбонових амінокислот в активному центрі; сюди відносять:
пепсин, що виділяється слизовою оболонкою шлунку,
катепсин D, що характеризується внутріклітинною локалізацією,
ряд кислих протеїназ, що продукуються різноманітними мікроорганізмами;
4) металопротеїнази, каталітична дія яких залежить від присутності іонів металів (Са2+, Zn2+) в активному центрі; прикладами їх можуть служити:
колагеназа,
ряд протеїназ мікробного походження (термолізин, компонент пронази і ін.).
Пепсин, трипсин і хімотрипсин виділяються залізистими клітинами у вигляді неактивних проферментів — зимогенів: пепсиногену, трипсиногену і хімотрипсиногену, оскільки їх активні центри заблоковані фрагментами поліпептидного ланцюга, після гідролітичного відщеплення яких фермент набуває активності.
Дуже важливою особливістю протеїназ є вибірковий (селективний) характер їх дії на пептидні зв'язки в білковій молекулі. Так:
пепсин вибірково прискорює гідроліз пептидних зв'язків, утворених аміногрупою фенілаланіну, тирозину або лейцину;
Міститься в слизовій оболонці шлунку; кристалічний препарат має дуже високу активність: 1 г пепсину за 2 год. розкладає 50 кг звареного білку яйця та створожує 100.000 л молока. В організмі знаходиться у вигляді пепсиногену, вивільняється під впливом соляної кислоти.
трипсин — прискорює гідроліз пептидних зв'язків, утворених карбоксильною групою аргініну або лізину;
Міститься у соці підшлункової залози. В організмі знаходиться у вигляді трипсиногену. Вивільняється під впливом ентерокінази.
хімотрипсин — прискорює гідроліз пептидних зв'язків, утворених карбоксильною групою тирозину або фенілаланіну;
Міститься в підшлунковій залозі. Трипсин і хімотрипсин розщеплюють білки загиблих клітин, що утворюють гній.
ренін - розщеплює пептидні зв’язки між фенілаланіном та метіоніном в казеїні.
Міститься в четвертому відділі шлунку теляти (сичузі), називається сичужним ферментом. Застосовується для створожування молока у виробництві сиру шляхом перетворення розчиненного білка казеїногену в нерозчинний осад казеїнату кальцію. 1 г реніну створожує 4.550 л молока;
папаїн — прискорює гідроліз пептидних зв'язків, утворених аргініном, лізином і фенілаланіном.
Рослинний протеолітичний фермент. Отримують у вигляді сухого порошку з соку плодів динного дерева (Carica papaya). Міститься також в дріжджах.
Активується сульфгідрильними сполуками. Особливу роль відіграє при цьому відновлений глутатіон. Він передає водень до окисленої форми ферменту, і, відновлюючи його, переводить у активний стан, що негативно впливає на зберігання дріжджів.
Відновлений глутатіон підвищує протеолітичну активність дріжджів, прискорюючи процес їх автолізу і зменшуючи цим їх термін зберігання. Для попередження цього необхідно перевести глутатіон в окислену форму.
В результаті дії певної протеїнази індивідуальний білок розщеплюється завжди на строго обмежене число пептидів. Це знаходить практичне використання при визначенні первинної структури білків і має величезне значення для регуляції обміну речовин, оскільки багато продуктів селективного гідролізу білків мають високу біологічну активність: саме цим шляхом з проферментів виникають ферменти, з попередників гормонів — гормони і тому подібне.
Причина вибіркової дії протеїназ полягає в тому, що радикал амінокислоти, по сусідству з якою гідролізується пептидний зв'язок, служить для утворення фермент-субстратного комплексу.
