
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
3.1.3. Пектинестерази (пектази).
Каталізують гідроліз пектинових речовин. Пектаза розщепляє складно-ефірний зв’язок з утворенням вільної полігалактуронової кислоти та метилового спирту.
3.2. Глікозидази (карбогідрази).
Глікозидази гідролітично розщеплюють глікозидні зв’язки в вуглеводах та інших глікозидах.
R 1-O-R1
+ HOH R1OH
+ R1OH
1-O-R1
+ HOH R1OH
+ R1OH
де: R1 – залишок вуглеводу,
R2 – залишок вуглеводу або речовини невуглеводної природи (аглікон).
Залежно від того на який просторовий ізомер (α чи β) діє фермент, його відносять до α- або β-глікозидаз.
Таким чином, глікозидази мають яскраво виражену просторову специфічність. Окрім глікозидів, що містять в якості аглікону залишки одноатомних спиртів, субстратами, на які поширюється дія тих або інших глікозидаз, є оліго- і полісахариди.
Глікозидази поділяють на олігази, що гідролітично розщеплюють глікозидні зв’язки в олігосахаридах та поліази, що гідролізують полісахариди.
3.2.1. Олігази.
Дисахариди, що виникають у ряді випадків при гідролізі полісахаридів (мальтоза при гідролізі крохмалю, целобіоза при гідролізі целюлози) або які існують в організмі у вільному стані (лактоза, сахароза, трегалоза і т. п.), гідролізуються при каталітичній дії α- і β-глікозидаз до індивідуальних моносахаридів.
Всі олігази, за винятком трегалази (α,α-трегалоза-глюкогідролаза), відрізняються широким спектром специфічності, прискорюючи гідроліз практично будь-яких глікозидів, що є похідними того або іншого α- або β-моносахариду.
Так, α-глюкозидаза прискорює реакцію гідролізу α-глюкозидів, у тому числі мальтози; β-глюкозидаза — β-глюкозидов, у тому числі целобіози; β-галактозидаза — β-галактозидов і серед них лактози і так далі
Олігази, окрім гідролазної активності, як правило, мають також глікозилтрансферазну дію і прискорюють процеси перенесення глікозильних залишків на ті або інші субстрати. Так, наприклад, целобіаза з аспергілу при дії на целобіозу утворює не лише β-D-глюкозу, але і трисахариди, тобто переносить залишок β-D-глюкози з одного дисахариду на іншій, що особливо яскраво проявляється на початку ферментативного процесу.
Зараз усе більше зміцнюється думка, що трансглікозування є одним з істотних елементів розпаду полісахаридів, олігосахаридів і дисахаридів, супутніх їх гідролізу.
-Глюкозидаза (мальтаза)
Р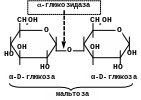
 озщеплює
-глюкозидний
зв’язок в дисахаридах (мальтозі) та
глюкозидах (сахарозі):
озщеплює
-глюкозидний
зв’язок в дисахаридах (мальтозі) та
глюкозидах (сахарозі):
α-1,4
α-1,2
Мальтаза розщеплює дисахарид мальтозу на 2 молекули -глюкози. Мальтаза має велике значення в хлібопеченні. У цьому виробництві однією з біохімічних стадій, що обумовлюють якість хліба, є процес зброджування мальтози дріжджами. Останні повинні мати високу мальтазну активність. Цим вимогам задовольняють спеціальні хлібопекарні дріжджі;
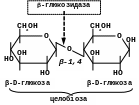
-Глюкозидаза (целобіаза)
Розщеплює -глюкозидні зв’язки в ди- та полісахаридах, а також в -глюкозидах, наприклад, в целобіозі:
-Галактозидаза (мелібіаза)
Розщеплює -галактозидний зв’язок в мелібіозі та рафінозі. Цей фермент має важливе промислове значення. Спиртове виробництво, що використовує меласу, несе суттєві збитки із-за того, що рафіноза, що міститься в цій сировині, не зброджується повністю дріжджами. Дріжджі містять -фруктозидазу і не виробляють -галактозидазу.
Внаслідок цього вони відщеплюють від рафінози лише фруктозу. Частина молекули, що залишилася (мелібіоза) не гідролізується і не піддається подальшому перетворенню на спирт.
Ц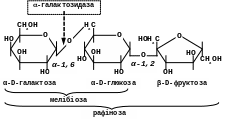 е
може бути вирішено двома шляхами:
отриманням спеціальних рас дріжджів,
що мають -галактозидазну
активність чи застосування ферментного
препарату -галактозидази.
е
може бути вирішено двома шляхами:
отриманням спеціальних рас дріжджів,
що мають -галактозидазну
активність чи застосування ферментного
препарату -галактозидази.
-Галактозидаза (лактаза)
Каталізує гідролітичне розщеплення -галактозидного зв’язку в лактозі:
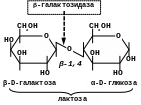
Цей фермент, окрім виконання важливої ролі в живому організмі застосовується в промисловості. При виготовленні продуктів з молока (морозиво тощо) для покращення їх смакових та інших якостей доцільним є розщеплення лактози молока на моноцукри за допомогою -галактозидази;
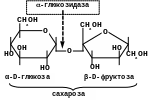
-Фруктозидаза (сахараза, інвертаза)
Розщеплює -фруктозидний зв’язок в сахарозі та рафінозі:
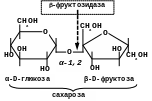
Сахараза каталізує розщеплення сахарози на глюкозу та фруктозу. Цей фермент відіграє велику роль в організмі людини та тварин, оскільки багато продуктів, які вони споживають, містять сахарозу. Необхідний і для багатьох промислових м/о, оскільки цукромістка сировина (меляса тощо) є найбільш поширеною сировиною мікробіологічної промисловості. Препарат інвертази (інвертин) застосовують в кондитерській промисловості.
Деякі глікозидази каталізують також реакції перенесення глікозильних залишків на різні субстрати, тобто є трансглікозидазами, тобто проявляють глікозилтрансферазну дію. Так, целобіоза утворює не тільки β-D-глюкозу, але й трисахариди, тобто переносить залишок β-D-глюкози з одного дисахариду на інший.
3.2.2. Поліази.
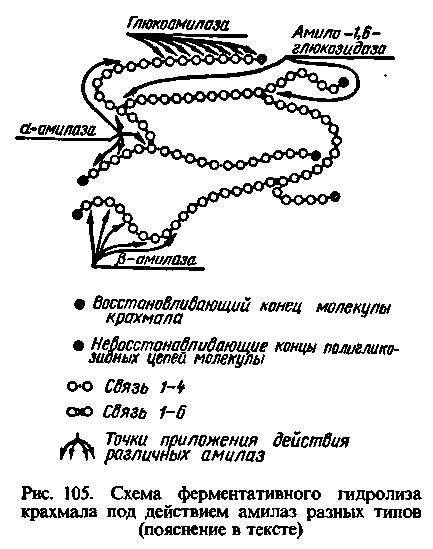
Амілази - група ферментів, що гідролізують крохмаль. Встановлена наявність трьох амілаз.
Характерна особливість амілаз — відсутність абсолютної специфічності дії. При їх участі гідролізуються різні сполуки: амілоза, амілопектин, глікоген, олігосахариди і подібні до них речовини, що побудовані із залишків α-D-глюкопіранози і містять в молекулах α-1,4- і α-1,6-глюкозидні зв'язки.
Мабуть, всі амілази є металопротеїнами (містять Zn2+ і Са2+), деякі з них мультимери; вважають, що іони металів сприяють становленню молекули мультимеру з протомерів.
α-Амілаза (тваринна амілаза, декстриногенамілаза, α-1,4-глюкан-4-глюканогідролаза).
α-Амілаза знайдена у всіх рослинних і тваринних організмах; в організмі тварин її міститься більше, ніж у рослинах. Присутня у слині, травному соці, що виділяється підшлунковою залозою, у пророслому зерні пшениці, жита, ячменю.
Прискорює гідроліз α-1,4-глікозидних зв'язків в середині молекули крохмалю невпорядковано, внаслідок чого спочатку виникають олігосахариди, які теж підпадають під дію α-амілази, якщо вони містять три або більше залишків α-D-глюкози.
Таким чином, α-амілаза є ендоамілазою, оскільки вона атакує внутрішні глікозидні зв'язки в молекулі крохмалю і для її дії не має значення близькість або віддаленість нередукуючих кінцевих залишків поліглікозидних фрагментів молекули крохмалю. Окрім крохмалю вона гідролізує також глікоген.
-Амілаза гідролізує крохмаль не повністю, утворюючи продукти з невеликою кількістю залишків глюкози - низькомолекулярні декстрини, а також невелику кількість мальтози та глюкози.

В результаті дії α-амілази утворюються продукти неповного гідролізу крохмалю – α-декстрини.
Якщо дія α-амілази поширюється на спіралізовану ділянку молекули крохмалю або молекули амілози, то гідроліз α-1,4-глікозидних зв'язків здійснюється латерально, уздовж одного боку спіралізованого α-1,4-глюкану. Оскільки кожен виток спіралі містить 6—7 залишків α-D-глюкопіранози, в результаті гідролізу утворюються гекса- або гептасахариди.
Кінцевим продуктом гідролізу крохмалю за допомогою α-амілази є мальтоза, оскільки в дисахаридах α-1,4-зв'язки під дією α-амілази не гідролізуються.
Гідроліз крохмалю за допомогою α-амілази у всіх випадках призводить до утворення α-форми мальтози, звідки веде своє походження назву ферменту.
Теоретично при дії α-амілази на амілозу про повному гідролізі можна отримати до 85% мальтози і 15% глюкози, при дії на амілопектин – до 70% мальтози, 10% ізомальтози і 20% глюкози.
β-Амілаза (рослинна амілаза, сахарогенамілаза, α-1,4-глюкан-мальтогідролаза).
β-Амілаза характерна лише для вищих рослин (зерні пшениці, жита, ячменю, соєвих бобах). В натуральному зерні -амілаза знаходиться у вільному стані, а -амілаза зв’язана з білками і тому неактивна. Звільняється вона при проростанні зерна.
Прискорює реакцію гідролізу крохмалю за α-1,4-глюкозидними зв'язками, послідовно відщеплюючи залишки мальтози, починаючи з нередукуючого кінця молекули крохмалю; її дія припиняється в точках розгалуження в молекулі крохмалю:
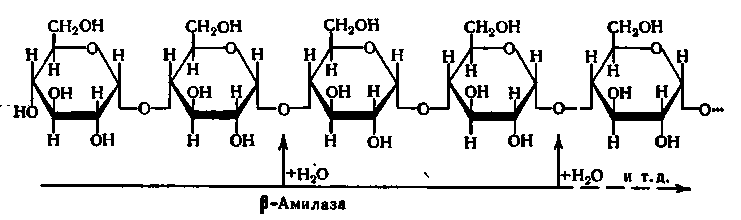
Мальтоза, що звільняється при гідролізі крохмалю під дією β-амілази, виходить у β-формі:
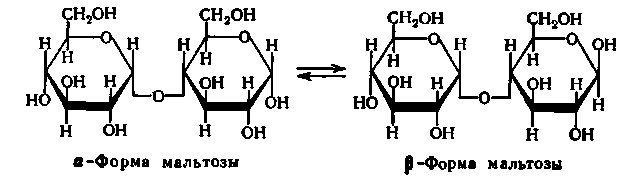
Утворення β-форми мальтози, тобто зміна просторовій конфігурації молекули за місцем глікозидного гідроксилу, що утворюється, при 1-му вуглецевому атомі залишку глюкози, відбувається у момент гідролізу α-глікозидного зв'язку. Відповідно до цього фермент і отримав свою назву.
-Амілаза практично не гідролізує нативний крохмаль, тоді як клейстеризований крохмаль гідролізує до мальтози в -конфігурації та високомолекулярних -декстринів.
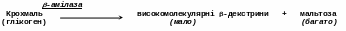
-Декстрини містять значну кількість -1-6-зв’язків, тому їх гідроліз припиняється на передостанньому -1-4-зв’язку, який межує з -1-6-зв’язком.
Теоретично при дії β-амілази на амілозу про повному гідролізі можна отримати до 100% мальтози, при дії на амілопектин – до 60% мальтози, 40% β-амілодекстрину.
Якщо в середовищі присутня і -амілаза, то вона розщепляє крупні декстрини, забезпечуючи можливість подальшої дії -амілази. Присутність -амілази посилює активність -амілази. Отже, активність двох амілаз при їх спільній дії вище суми активностей кожної з них окремо, тобто має місце синергічна дія двох амілаз.
Розрізняються - та -амілази і чутливістю до температури та рН середовища.
-Амілаза більш стійка до підвищеної температури, але чутлива до підкислення рН середовища. Це використовується в хлібопекарній промисловості, де продукти дії -амілази - низькомолекулярні декстрини - знижують якість хліба.
Оскільки у пророслому зерні пшениці та жита міститься активна -амілаза, то в процесі бродіння тіста, яке замісили з борошна пророслого зерна, накопичується значна кількість декстринів, що надають хлібу низьку еластичність, недостатню пористість, неприємний смак.
Оскільки -амілаза чутлива до зниження кислотності, то тісто замішують на рідких дріжджах або молочнокислих заквасках. Це забезпечує накопичення в тісті підвищеної кількості молочної кислоти, що пригнічує дію -амілази.
Але амілаза має і позитивне значення у хлібопекарській, пивоварній, спиртовій, текстильній промисловості. Бродіння тіста та накопичення в ньому СО2, що розрихлює його та надає хлібу рівномірну пористість та об’єм, залежать від присутності у тісті заброджених дріжджами сахарів, що, в свою чергу, залежить від швидкості накопичення мальтози під впливом амілази на крохмаль. Хоча надто енергійна дія -амілази пророслого зерна погіршує якість хліба.
Солод, що застосовується при виготовленні пива та оцукрюванню заторів у спиртовій промисловості, є джерелом активної амілази, що каталізує перетворення крохмалю в мальтозу.
При спільній дії - та -амілаз крохмаль гідролізується на 85-95 %. Негідролізований крохмаль представляє собою залишки із зв’язками 1–6 і так звані аномальні структури, на які не діють ці ферменти. Розщеплення α-1,6-глікозидних зв’язків здійснюють ферменти оліго-1,6-глюкозидаза та амілопектин-1,6-глюкозидаза.
Глюкоамілаза, або γ-амілаза (α-1,4-глюканглюкогідролаза),
Глюкоамілаза поширена повсюдно; вона відкрита Е. Л. Розенфельд (1959) в тканинах тварин, де яскраво представлена, як, втім, і в пліснявих грибах.
Глюкоамілаза прискорює реакцію гідролізу α-1,4-глюкозидних зв'язків з нередукуючих кінців (що не містятьть вільної альдегідної групи або глікозидного гідроксилу) молекули крохмалю, послідовно відщеплюючи залишки -D-глюкози, а також розщеплює -1,6-зв’язок тільки в тому випадку, коли за ним йде -1,4-зв’язок.
Утворюється переважно глюкоза та невелика кількість декстринів. За допомогою цього ферменту отримують глюкозну патоку та кристалічну глюкозу.
Крім того, прискорює реакцію гідролізу α-1,4-глюкозидних зв'язків в молекулах олігосахаридів і навіть дисахаридів (наприклад, мальтози),
Аміло-1,6-глюкозидаза прискорює реакцію гідролізу α-1,6-глікозидних зв'язків в молекулі крохмалю (амілопектину), розщеплюючи, таким чином, його молекулу в точках розгалудження поліглюкозидного ланцюга і утворюючи олігосахариди з тим або іншим числом залишків α-D-глюкози в них, залежно від довжини ланцюга, що відщеплюється.
Аміло-1,6-глюкозидаза характерна для тваринних тканин. Проте це не означає, що її немає на рослинному світі: у рослин цей же фермент називають R-ензимом, а у мікроорганізмів — ізоамілазою.

Аналогічно крохмалю і глікогену гідролізуються інші природні полісахариди:
целюлоза — за участю целюлазного комплексу ферментів (складається з ендо-1,4-β-глюканази, екзоцелобіогідролази, целобіази і екзо-1,4-β-глюкогідролази),
інулін — за допомогою інулінази (2,1-β-D-фруктанфруктаногідролази),
хітин — хітинази,
ксилан — ксиланази,
гіалуронова кислота — гіалуронідази,
пектинові речовини — комплексу пектинолітичних ферментів (пектинестерази, полігалактуронази і ін.) і т.п.
У всіх випадках полісахариди розпадаються до відповідних моносахаридів або їх похідних (іноді до дисахаридів), з яких складені молекули вказаних полісахаридів. Деякі з гідролаз, перерахованих вище, широко поширені в природі, інші (целюлаза, інуліназа) — властиві лише певним видам рослин, тварин і мікроорганізмів.
Особливу увагу привертають целюлази, хітинази, 1,3- і 1,6-β-глюканази і ліхенази (гідролізують гетерополісахариди з переміжними 1,3- і 1,4-глікозидними зв'язками), оскільки вони розкладають рослинні і мікробні залишки, які є екологічно небезпечними відходами виробництва, дозволяючи при цьому отримувати глюкозу і N-ацетилглюкозамин.
Деякі з них, наприклад, хітинази з Bacillus cereus прискорюють реакцію гідролізу хітину при рН=4 і t = 60°С до хітобіози, але не до N-ацетил-β-D-глюкозаміну.
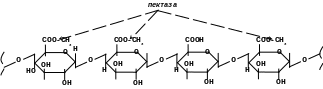
Полігалактуроназа (пектиназа) здійснює гідролітичне розщеплення α-1,4-глікозидних зв’язків в пектинових речовинах. Діє тільки на глікозидні зв’язки, утворені залишкам галактуронової кислоти. Якщо в утворенні глікозидного зв’язку приймає участь метоксильована галактуронова кислота, то цей фермент не подіє на такий зв’язок.
пектиназа
не діє
