
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
2.4. Ацилтрансферази.
Ці ферменти прискорюють перенесення ацилів (залишків карбонових кислот) на амінокислоти, аміни, спирти і інші сполуки.
Н ебілкова
частина ацилтрасфераз називається
коферментом
ацилювання
(КоА), складається із похідного АДФ,
залишку пантотенової кислоти та
тіоетаноламіну. Активною групою
коферменту ацилування є сульфгідрильна
група тіоетаноламіну - SH, тому кофермент
ацилювання позначають також символом
КоА-SН.
ебілкова
частина ацилтрасфераз називається
коферментом
ацилювання
(КоА), складається із похідного АДФ,
залишку пантотенової кислоти та
тіоетаноламіну. Активною групою
коферменту ацилування є сульфгідрильна
група тіоетаноламіну - SH, тому кофермент
ацилювання позначають також символом
КоА-SН.
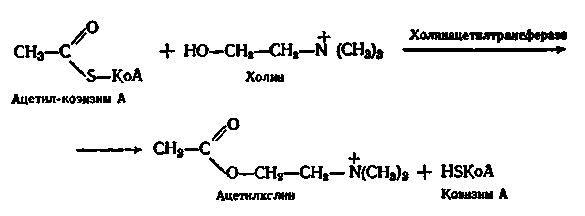
Найчастіше перенесенню в біологічних об'єктах піддається ацил оцтової кислоти — ацетил (СН3—СО–).
Кислотні залишки приєднуються до сульфгідрильної групи завдяки макроергічному зв’язку, наприклад: СН3СОS-КоА (ацетил-КоА).
Цей процес є важливим етапом аеробного окислення вуглеводів, а також окислення та синтезу жирних кислот.
Одним з прикладів реакції трансацилювання є синтез ацетилхоліну:
Важливе значення серед трансфераз мають ферменти, що прискорюють перенесення одновуглецевих фрагментів (метильних, оксиметильних, формільних і т. п.), а також нуклеотидилтрансферази, що каталізують перенесення нуклеотидних залишків в процесі синтезу нуклеїнових кислот.
3. Гідролази.
До класу гідролаз відносять ферменти, що прискорюють реакції розщеплення (а інколи і синтезу) органічних сполук за участю води: R'R"+HOH –> R'H+R"OH.
Залежно від характеру субстрату, що піддається гідролізу, гідролази поділяють на ряд підкласів, серед яких найбільш важливі наступні:
естерази, що прискорюють реакції гідролізу складних ефірів;
глікозидази, що прискорюють реакції гідролізу глікозидів, у тому числі вуглеводів;
пептидгідролази, що прискорюють реакції гідролізу (а в особливих випадках і синтезу) білків, пептидів і інших сполук, що містять пептидні зв'язки;
гідролази, що діють на С—N-зв’язки, що відрізняються від пептидних (наприклад, амідази і т. п.).
Всього в складі гідролаз налічують майже 500 ферментів.
3.1. Естерази.
Естерази каталізують реакції гідролізу складних ефірів спиртів з органічними і неорганічними кислотами. Найважливішими підпідкласами естераз є гідролази ефірів карбонових кислот і фосфатази.
3.1.1. Карбоксиестерази.
Каталізують гідролітичне розщеплення триацилгліцеридів.
Серед карбоксиестераз виділяється фермент ліпаза, яка прискорює гідроліз зовнішніх, тобто α-складноефірних, зв'язків в молекулах триацилгліцеринів (жирів):

де R1, R2, R3 – радикали жирних кислот.
В організмі тварин найактивніша ліпаза міститься у соці підшлункової залози та у печінці. У рослинах буває в розчинному та нерозчинному вигляді. Нерозчинна ліпаза міститься у насінні рицину, оптимум її дії відповідає рН 3,6. Ліпаза інших олійних культур, злакових, мікроорганізмів належить до розчинних, оптимум її дії відповідає рН 8. При підвищеній вологості, температурі ліпаза швидко розщепляє гліцериди, що веде до прогіркання продуктів.
3.1.2. Фосфоестерази (фосфатази).
Каталізують гідроліз фосфорних ефірів. Особливо широко поширені фосфатази, що діють на складні ефіри фосфорної кислоти і вуглеводів, наприклад глюкозо-1-фосфатаза:
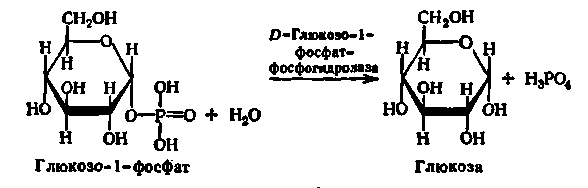
Дія фосфатаз виявляється в широкому спектрі рН від 3 до 9. Більшість з них має широку субстратну специфічність.
Особливо важливі для регуляції процесів життєдіяльності протеїнфосфатази, що забезпечують відщеплення фосфату від фосфорильованих білків, внаслідок чого змінюється їх біологічна, зокрема ферментативна, активність.
