
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
2.2. Амінотрансферази.
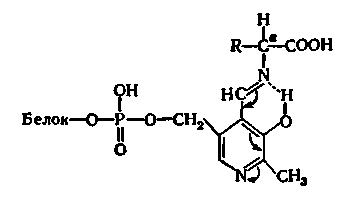
Ці ферменти прискорюють реакцію переамінування амінокислот з кетокислотами і дуже важливі для забезпечення біосинтезу амінокислот. Амінотрансферази двокомпонентні: простетической групою їх у всіх випадках є піридоксальфосфат, ковалентний приєднаний до апоферменту через свою альдегідну групу і іонним зв'язком — через залишок фосфорної кислоти:
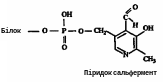
Наприклад в результаті серії реакцій, що включають поперемінне утворення фермент-субстратних комплексів, аспарагінова кислота переходить в щавелевооцтову, а α-кетоглутарова — в глутамінову. Це виражається наступним сумарним рівнянням:
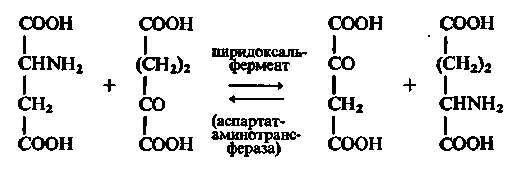
Центральну роль в піридоксалевому каталізі відіграє змішення електронної щільності у фермент-субстратном комплексі:
В результаті у α-вуглецевого атома амінокислотного залишку послаблюються зв'язки із замісниками (азотом, СООН-групою і ін.), внаслідок чого легко здійснюється розрив відповідних зв'язків.
2.3. Глікозілтрансферази.
Ці ферменти прискорюють реакції перенесення глікозильних залишків з молекул фосфорних ефірів або інших сполук до молекул моносахаридів, полісахаридів або інших речовин, забезпечуючи головним чином реакції синтезу і розпаду оліго- і полісахаридів у тваринному і рослинному світі.
Нижче приведено рівняння реакції розпаду сахарози при участі сахароза: ортофосфат-α-глюкозилтрансферази, або сахарозофосфорилази:
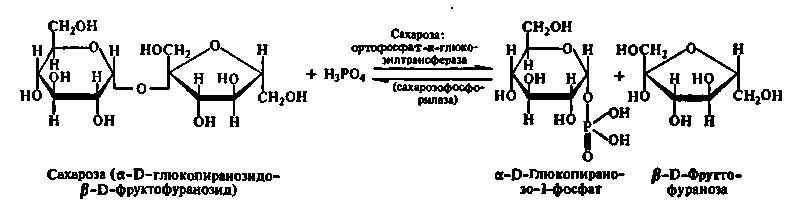
Аналогічно цьому діють крохмальфосфорилаза, глікогенфосфорилаза і інші глікозилтрансферази.
При перенесенні глікозильних залишків від полісахариду (або олігосахариду) на фосфорну кислоту відбувається розклад останнього з утворенням фосфорних ефірів моносахаридів. Цей процес називають фосфоролізом, оскільки він формально аналогічний гідролізу, але замість елементів води за місцем розриву глікозидного зв'язку між залишками моносахаридів в молекулах оліго- або полісахаридів приєднуються водень і фосфатна група фосфорної кислоти.
Сумарне хімічне рівняння фосфоролізу:
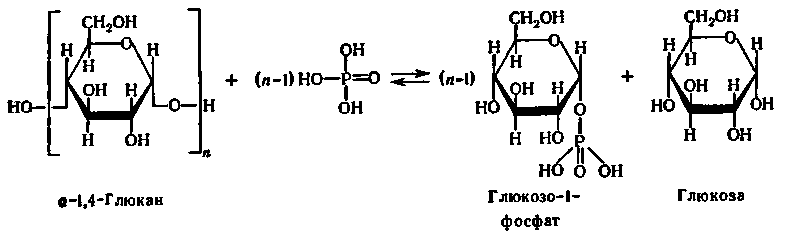
Ця реакція прискорюється специфічними ферментами — фосфорилазами, які відносяться до підкласу глікозилтрансфераз і підпідкласу гексозилтрансфераз. Вони були відкриті Я.О. Парнасом, К. Корі и Г. Корі більш ніж півстоліття тому.
Фосфорилази прискорюють процес перенесення глікозильного залишку з невідновлюючого кінця молекули полісахариду або олігосахариду на неорганічний фосфат. Фосфоролітичному розщеплюванню піддаються лише 1,4-глікозидні зв'язки.
Представлений вище процес багато разів повторюється, і ступінчастий розпад α-1,4-глюкану супроводжується утворенням великої кількості молекул глюкозо-1-фосфату.
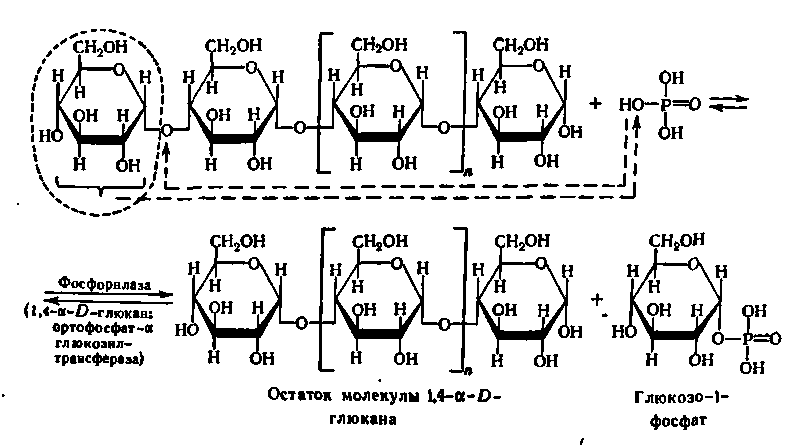
У випадку строго лінійного поліглікозиду фосфороліз йде до кінця, в разі розгалужених полісахаридів — зупиняється в точках розгалужень полісахаридного ланцюга.
Реакція фосфоролізу полісахаридів широко представлена в природі. Саме так йде розпад глікогену, коли він вступає на шлях глікогенолізу. Аналогічно цьому за допомогою реакції фосфоролізу значна частина крохмалю перетворюється на глюкозо-1-фосфат при використанні запасів крохмалю для потреб рослинного організму.
Відмічені також випадки фосфоролізу дисахаридів. Так, деякі бактерії містять мальтозофосфорилазу, що прискорює реакцію розпаду мальтози на глюкозо-1-фосфат і глюкозі при її взаємодії з Н3РО4.
На відміну від гідролаз фосфорилази здійснюють і зворотний процес - синтез складних вуглеводів, переносячи залишки моносахаридів від їх фосфорних ефірів на вуглеводи. В результаті відбувається взаємоперетворення вуглеводів.
Останнім часом з'ясовано, що перенесення глікозильних залишків особливо легко здійснюється ферментами даної групи в тих випадках, коли субстратом служить нуклеозиддифосфатмоносахарид. Ця реакція представляє, мабуть, основний шлях природного синтезу оліго- і полісахаридів. Нуклеозиддифосфатсахара є коферментами глікозилтрансфераз.
