
- •7. Ферменти
- •Будова ферментів
- •Апофермент Кофактор Холофермент
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Залежність швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту
- •Загальна схема інгібування ферменту
- •Оборотне інгібування
- •Конкурентне інгібування
- •Конкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
- •Безконкурентне інгібування
- •Інгібування субстратом
- •Класифікація і номенклатура ферментів Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання і. Оксидоредуктази
- •1. Дегірогенази
- •1.1. Піридинові дегірогенази.
- •1.2. Флавінові дегідрогенази
- •1.3. Убіхінони.
- •3. Цитохроми.
- •2. Трансферази.
- •2.1. Фосфотрансферази.
- •2.2. Амінотрансферази.
- •2.3. Глікозілтрансферази.
- •2.4. Ацилтрансферази.
- •3. Гідролази.
- •3.1. Естерази.
- •3.1.1. Карбоксиестерази.
- •3.1.2. Фосфоестерази (фосфатази).
- •3.1.3. Пектинестерази (пектази).
- •3.2. Глікозидази (карбогідрази).
- •Пектиназа
- •3. Пептидгідролази (протеази).
- •3.1. Протеїнази
- •3.2. Пептидази.
- •3.3. Дипептидази.
- •4.4. Амідази
- •5. Ізомерази
- •Всі ізомерази відіграють важливу роль в обміні речовин.
- •6. Лігази
- •Локалізація ферментів у клітині
3. Цитохроми.
Найбільш складний, але і найпоширеніший варіант окисно-відновного процесу в клітині полягає в окисленні атомів Н, віднятих від субстрату, за допомогою цитохромної системи. Система цитохромів здійснює перенесення електронів водню від відновлених дегідрогеназ на кисень повітря.
Цитохромну систему утворюють декілька оксидоредуктаз, що мають в якості простетичної групи залізопорфірини.
З'єднуючись з білками різної будови, залізопорфірини 4 типів (А, В, С і D) дають початок сімейству хромопротеїнів, що об'єднуються під загальною назвою, — цитохроми. Зараз відомо декілька десятків цитохромів. Кожен індивідуальний цитохром позначають порядковою латинською буквою а, b, с і d з відповідним порядковим індексом, наприклад b1, b2, b3 і так далі, а клас цитохрому — прописною латинською буквою А, В, С або D.
Приналежність цитохрому до певного класу визначається будовою простетичної групи (залізопорфірину), а остаточна індивідуальність — будовою апоферменту (білка).
Молекулам цитохромів характерна здатність агрегувати один з одним. Саме тому цитохроми утворюють цитохромну систему, яка є впорядкованим поєднанням в єдиному комплексі різних цитохромів, наприклад b, с і а.
Цитохромна система здатна приймати електрони, зняті з атомів Н відновленого убіхінону (УХ). Вона передає електрони далі по ланцюгу цитохромів і, нарешті, на кисневий атом; останній, з'єднуючись з іонізованими атомами Н, утворює молекулу Н2o.
У ланцюзі цитохромів кожен з індивідуальних цитохромів займає строго певне місце. Простий варіант цитохромной системи приведений на наступній схемі:
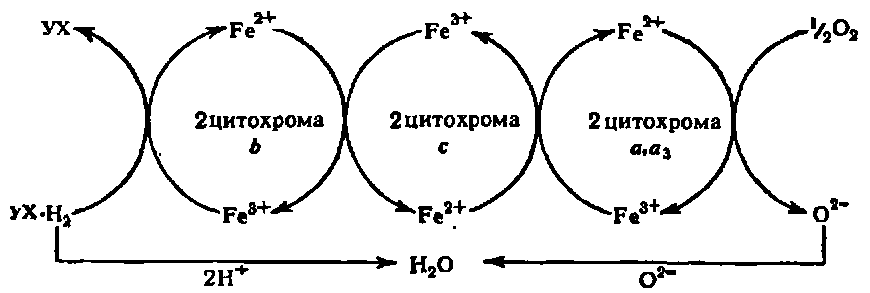
Передача електронів в цитохромному ланцюзі здійснюється за рахунок зміни валентності атома Fe порфіринового ядра.
З усіх цитохромів лише цитохроми а і а3 передають електрони на кисень повітря. Тому саме цей комплекс цитохромів завершує ланцюг цитохромів і носить назву цитохромоксидази.
Окрім атомів Fe (у складі гему) цитохром а, а3 містить також атоми Сu, з якими зв'язують його окислювальні властивості. Цитохромоксидаза складається з 6 субодиниць, дві субодиниці складають цитохром а, а інші відносяться до цитохрому а3.. Цитохроми b, с виконують функцію проміжних переносників електронів.
5. Гідрогенази – ферменти, що каталізують оборотне окислення водню за участю ферредоксину, НАД+ або цитохрому с3. Усі гідрогенази бактерій містять негемінове залізо та сульфідну сірку. Гідрогенази відіграють важливу роль в процесі фотосинтезу і фіксації молекулярного азоту.
2. Трансферази.
У цей клас входять ферменти, що прискорюють реакції перенесення функціональних груп і молекулярних залишків від однієї сполуки до іншої. Це один з найбільш обширних класів: він налічує близько 500 індивідуальних ферментів. Залежно від характеру груп, що переносяться, фосфотрансферази, амінотрансферази, глікозилтрансферази, ацилтрансферази, трансферази, що переносять одновуглецеві залишки (метилтрансферази, формілтрансферази), і ін.
2.1. Фосфотрансферази.
До фосфотрансфераз відносять ферменти, що прискорюють реакцію перенесення залишку фосфорної кислоти від АТФ на різні речовини і, навпаки, від фосфорильованої речовини на АДФ з утворенням АТФ.
Ця реакція має виключно важливе значення для життєдіяльності організму, забезпечуючи перетворення ряду органічних сполук на фосфорні ефіри, що мають підвищену хімічну активність і легше вступають в подальші реакції.
Перенесення фосфатних груп йде на спиртові, карбоксильні, азотвмісні, фосфоровмісні і інші групи тих або інших органічних сполук. Відповідно до цього серед фосфортрансфераз розрізняють декілька підпідкласів.
Донором фосфатних залишків є в більшості випадків аденозинтрифосфорна кислота (АТФ), але можливі й інші їх джерела.
Д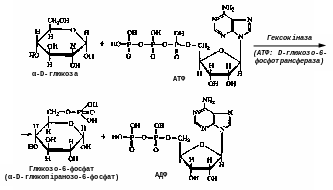 о
фосфотрансфераз відноситься, наприклад,
гексокіназа
— фермент, що прискорює перенесення
залишку фосфорної кислоти від молекули
АТФ до глюкози (з цієї реакції зазвичай
починається перетворення глюкози):
о
фосфотрансфераз відноситься, наприклад,
гексокіназа
— фермент, що прискорює перенесення
залишку фосфорної кислоти від молекули
АТФ до глюкози (з цієї реакції зазвичай
починається перетворення глюкози):
Перетворення багатьох інших моносахаридів теж починається з їх фосфорилювання за посередництва фосфотрансфераз: наприклад у випадку β-D-фруктози, β-D-рибози і ряду інших моносахаридів.
Особливу увагу останнім часом приділяють вивченню фосфотрансфераз, що забезпечують перенесення залишку фосфату з АТФ на білки, — протеїнкіназам. Вони переносять фосфат на радикали сер, тре, тир, ліз і гіс ряду білків, внаслідок чого різко змінюється біологічна активність останніх. Це, у свою чергу, позначається на інтенсивності протікання хімічних процесів в організмі, тобто на регуляції обміну речовин.
