
- •Раздел I. Общая физиология.
- •Раздел II. Частная физиология.
- •Раздел III. Методы исследования физиологических
- •7. Потенциал действия и его фазы. Изменение проницаемости калиевых, натриевых и кальциевых каналов в процессе формирования потенциала действия.
- •4) Трансформация возбуждений.
- •1.Восприятие, запечатление и запоминание.
- •20.1. Характеристика и классификация адаптивных механизмов
- •Раздел II. Частная физиология.
- •1. Импульсы от рефлексогенных зон:
- •№46 Полостное и пристеночное пищеварение в тонкой кишке
- •№47 Пищеварение в толстом кишечнике.
- •Моторная функция толстого кишечника. Дефекация.
- •Дополнительно: Поджелудочная железа
- •№71 Ствол мозга
- •№72 Средний мозг
- •№89 Вестибулярная система
- •Дополнительно: Обонятельная система
- •Дополнительно: Вкусовая система
- •№95 Висцеральная система
- •2)Информационная функция
- •3)Функция установление порога болевой чувствительности
- •Раздел III. Методы исследования физиологических функций. №1??? Методы изучения возбудимых клеток
- •Дополнительно: Гематокрит. Норма и отклонения
- •Гематокрит выше нормы
- •Гематокрит ниже нормы
- •Время свертывания крови Метод Моравица
- •Глава 4 анализ электрокардиограммы
- •Электрокардиограмма
- •Изменение тонов сердца
- •II тон усилен вследствие:
- •№23 Время кругооборота крови
- •№27??? Определение жизненной ёмкости легких (тест жел)
- •№30 Методика изучения слюноотделения у животных и человека
- •Методы изучения пищеварительных функций. Экспериментальные методы
Раздел II. Частная физиология.
№1 Ланг считал, что в систему крови входят кровь, органы кроветворения и кроверазрушения, а также аппарат регуляции. Кровь как ткань обладает следующими особенностями: 1) все ее составные части образуются за пределами сосудистого русла; 2) межклеточное вещество ткани является жидким; 3) основная часть крови находится в постоянном движении
Кровь состоит из жидкой части — плазмы и форменных элементов — эритроцитов, лейкоцитов и тромбоцитов. У взрослого человека форменные элементы крови составляют около 40—48%, а плазма — 52—60.
Основными функциями:1Транспортная функция. Кровь переносит необходимые для жизнедеятельности органов и тканей различные вещества, газы и продукты обмена Благодаря транспорту осуществляется дыхательная функция крови. Кровь осуществляет перенос гормонов, питательных веществ, продуктов обмена, ферментов, различных биологически активных веществ, солей, кислот, щелочей, катионов, анионов, микроэлементов и др. С транспортом связана и экскреторная функция крови — выделение из организма метаболитов, отслуживших свой срок или находящихся в данный момент в избытке веществ.2 Защитные функции. С наличием в крови лейкоцитов связана специфическая (иммунитет) и неспецифическая (главным образом фагоцитоз) защита организма. К защитным функциям относится сохранение циркулирующей крови в жидком состоянии и остановка кровотечения (гемостаз) в случае нарушения целостности сосудов.3Гуморальная регуляция деятельности организма. В первую очередь связана с поступлением в циркулирующую кровь гормонов, биологически активных веществ и продуктов обмена. Благодаря регуляторной функции крови осуществляется сохранение постоянства внутренней среды организма, водного и солевого баланса тканей и температуры тела, контроль за интенсивностью обменных процессов, регуляция гемопоэза и других физиологических функций.
Основные константы крови:1Относительная плотность крови. Колеблется от 1,058 до 1,062 и зависит преимущественно от содержания эритроцитов. Относительная плотность плазмы крови в основном определяется концентрацией белков и составляет 1,029—1,032 . 2 Определяется по отношению к вязкости воды и соответствует 4,5—5,0. Вязкость крови зависит главным образом от содержания эритроцитов и в меньшей степени от белков плазмы.. Вязкость плазмы не превышает 1,8—2,2. При обильном белковом питании вязкость плазмы, а, следовательно, и крови может повышаться. 3. Осмотическим давлением называется сила, которая заставляет переходить растворитель (для крови это вода) через полупроницаемую мембрану из менее в более концентрированный раствор 0,56—0,58°С. 4Онкотическое давление.не превышает 30 мм рт.ст. Онкотическое давление в большей степени зависит от альбуминов. 5.Температура крови37—40°С 6.Общее количество крови в организме взрослого человека составляет в среднем 6—8%, или 1/13, массы тела, т. е. приблизительно 5—6 л.
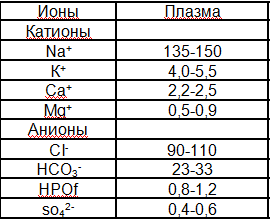
№2 К важнейшим электролитам крови относятся Na+, Cl-, K+, HCO3-, и Ca2+. Содержание Na+ и Cl- определяет осмолярность крови, а HCO3- -- ее pH
Осмотическое давление крови. Осмотическим давлением называется сила, которая заставляет переходить растворитель (для крови это вода) через полупроницаемую мембрану из менее в более концентрированный раствор. Осмотическое давление крови вычисляют криоскопическим методом с помощью определения депрессии (точки замерзания), которая для крови составляет 0,56—0,58°С. Депрессия молярного раствора (раствор, в котором растворена 1 грамм-молекула вещества в 1 л воды) соответствует 1,86°С. Подставив значения в уравнение Клапейрона, легко рассчитать, что осмотическое давление крови равно приблизительно 7,6 атм.
Осмотическое давление крови зависит в основном от растворенных в ней низкомолекулярных соединений, главным образом солей. Около 60% этого давления создается NaCl. Осмотическое давление в крови, лимфе, тканевой жидкости, тканях приблизительно одинаково и отличается постоянством. Даже в случаях, когда в кровь поступает значительное количество воды или соли, осмотическое давление не претерпевает существенных изменений. При избыточном поступлении в кровь вода быстро выводится почками и переходит в ткани и клетки, что восстанавливает исходную величину осмотического давления. Если же в крови повышается концентрация солей, то в сосудистое русло переходит вода из тканевой жидкости, а почки начинают усиленно выводить соли. Продукты переваривания белков, жиров и углеводов, всасывающиеся в кровь и лимфу, а также низкомолекулярные продукты клеточного метаболизма могут изменять осмотическое давление в небольших пределах.
Функциональная система регуляции осмотического давления. Осмотическое давление крови млекопитающих и человека в норме держится на относительно постоянном уровне (опыт Гамбургера с введением в кровь лошади 7 л 5% раствора сернокислого натрия). Все это происходит за счет деятельности функциональной системы регуляции осмотического давления, которая тесно увязана с функциональной системой регуляции водно-солевого гомеостаза, так как использует те же исполнительные органы.
В стенках кровеносных сосудов имеются нервные окончания, реагирующие на изменения осмотического давления (осморецепторы). Раздражение их вызывает возбуждение центральных регуляторных образований в продолговатом и промежуточном мозге. Оттуда идут команды, включающие те или иные органы, например, почки, которые удаляют избыток воды или солей. Из других исполнительных органов ФСОД надо назвать органы пищеварительного тракта, в которых происходит как выведение избытка солей и воды, так и всасывание необходимых для восстановления ОД продуктов; кожу, соединительная ткань которой вбирает в себя при понижении осмотического давления избыток воды или отдает ее последней при повышении осмотического давления. В кишечнике растворы минеральных веществ всасываются только в таких концентрациях, которые способствуют установлению нормального осмотического давления и ионного состава крови. Поэтому при приеме гипертонических растворов (английская соль, морская вода) происходит обезвоживание организма за счет выведения воды в просвет кишечника. На этом основано слабительное действие солей.
Фактором, способным изменять осмотическое давление тканей, а также крови, является обмен веществ, ибо клетки тела потребляют крупномолекулярные питательные вещества, и выделяют взамен значительно большее число молекул низкомолекулярных продуктов своего обмена. Отсюда понятно, почему венозная кровь, оттекающая от печени, почек, мышц имеет большее осмотическое давление, чем артериальная. Не случайно, что в этих органах находится наибольшее количество осморецепторов.
Особенно значительные сдвиги осмотического давления в целом организме вызывает мышечная работа. При очень интенсивной работе деятельность выделительных органов может оказаться недостаточной для сохранения осмотического давления крови на постоянном уровне и в итоге может наступить его увеличение. Сдвиг осмотического давления крови до 1,155% NaCl делает невозможным дальнейшее выполнение работы (один из компонентов утомления).
№3 Для организма важнейшее значение имеет поддержание постоянства реакции внутренней среды. Это необходимо для нормального протекания ферментативных процессов в клетках и внеклеточной среде, синтеза и гидролиза различных веществ, поддержания ионных градиентов в клетках, транспорта газов и т.д. Активная реакция среды определяется соотношением водородных и гидроксильных ионов. Постоянство кислотно-щелочного равновесия внутренней среды поддерживается буферными системами крови и физиологическими механизмами. Буферные системы - это комплекс слабых кислоты и основания, который способен препятствовать сдвигу реакции в ту или иную сторону.
Кровь содержит следующие буферные системы:
1.Бикарбонатная или гидрокарбонатная. Она состоит из свободной угольной кислоты и гидрокарбонатов натрия и калия (NaHCO3 и KHCO3). При накоплении в крови щелочей, они взаимодействуют с угольной кислотой. Образуются гидрокарбонат и вода. Если кислотность крови возрастает, то кислоты соединяются с гидрокарбонатами. Образуются нейтральные соли и угольная кислота. В легких она распадается на углекислый газ и воду, которые выдыхаются.
2.Фосфатная буферная система. Она является комплексом гидрофосфата и дигидрофосфата натрия (Na2HPO4 и NaH2PO4). Первый проявляет свойства основания, второй слабой кислоты. Кислоты образуют с гидрофосфатом натрия нейтральную соль и дигидрофосфат натрия (Na2HPO4+H2CO3= NaHCO3+NaH2PO4).
3.Белковая буферная система. Белки являются буфером благодаря своей амфотерности. Т.е. в зависимости от реакции среды они проявляют либо щелочные, либо кислотные свойства. Щелочные свойства им придают концевые аминогруппы белков, а кислотные карбоксильные. Хотя буферная емкость белковой системы небольшая, она играет важную роль в межклеточной жидкости.
4.Гемоглобиновая буферная система эритроцитов. Самая мощная буферная система. Состоит из восстановленного гемоглобина и калиевой соли оксигемоглобина. Аминокислота гистидин, входящая в структуру гемоглобина, имеет карбоксильные и амидные группировки. Первые обеспечивают гемоглобину свойства слабой кислоты, вторые - слабого основания. При диссоциации оксигемоглобина в капиллярах тканей на кислород и гемоглобин, последний приобретает способность связываться с катионами водорода. Они образуются в результате диссоциации, образовавшейся из углекислого газа угольной кислоты. Угольная кислота образуется из углекислого газа и воды под действием фермента карбоангидразы, имеющейся в эритроцитах (формула). Анионы угольной кислоты связываются с катионами калия, находящимися в эритроцитах и катионами натрия в плазме крови. Образуются гидрокарбонаты калия и натрия, сохраняющие буферную емкость крови. Кроме того, восстановленный гемоглобин может непосредственно связываться с углекислым газом с образованием карбгемоглобина. Это также препятствует сдвигу реакции крови в кислую сторону.
Физиологические механизмы поддержания кислотно-щелочного равновесия обеспечиваются легкими, почками, ЖКТ, печенью. С помощью легких из крови удаляется угольная кислота. В организме ежеминутно образуется 10 ммоль угольной кислоты. Закисление крови не происходит потому, что из нее образуются бикарбонаты. В капиллярах легких из анионов угольной кислоты и протонов вновь образуется угольная кислота, которая под влиянием фермента карбоангидразы расщепляется на углекислый газ и воду. Они выдыхаются. Через почки из крови выделяются нелетучие органические и неорганические кислоты. Они выводятся как в свободном состоянии, так и в виде солей. В физиологических условиях почки моча имеет, кислую реакцию (рН=5-7). Почки участвуют в регуляции кислотно-щелочного гомеостаза с помощью следующих механизмов:
1. Секреции эпителием канальцев водородных ионов, образовавшихся из угольной кислоты, в мочу.
2. Образования в клетках эпителия гидрокарбонатов, которые поступают в кровь и увеличивают ее щелочной резерв. Они образуются из угольной кислоты и катионов натрия и калия. Первые 2 процесса обусловлены наличием в этих клетках карбоангидразы.
3. Синтеза аммиака, катион которого может связываться с катионов водорода с образованием аммония.
4. Обратного всасывание в канальцах из первичной мочи в кровь гидрокарбонатов.
5. Фильтрация в мочу избытка кислых и щелочных соединений.
Значение органов пищеварения для поддержания кислотно-щелочного равновесия небольшое. В частности, в желудке в виде соляной кислоты выделяются протоны. Поджелудочной железой и железами тонкого кишечника гидрокарбонаты. Но в то же время и протоны и гидрокарбонаты обратно всасываются в кровь. В результате реакция крови не изменяется. В печени из молочной кислоты образуется гликоген. Однако нарушение функций пищеварительного канала сопровождается сдвигом реакции крови. Так стойкое повышение кислотности желудочного сока приводит к увеличению щелочного резерва крови. Это же возникает при частой рвоте из-за потери катионов водорода и хлоридов.
Кислотно-щелочной баланс крови характеризуется несколькими показателями:
1. Актуальный рН. Это фактическая величина рН крови. В норме артериальная кровь имеет рН 7,35-7,45.
2. Парциальное напряжение СО2 (РСО2). Для артериальной крови 36-44 мм.рт.ст.
3. Стандартный бикарбонат крови (SB). Содержание бикарбонат (гидрокарбонат) анионов при стандартных условиях, т.е. нормальном насыщении гемоглобина кислородом. Величина 21,3 - 24,8 ммоль/л.
4. Актуальный бикарбонат крови (АВ). Истинная концентрация бикарбонат анионов. В норме практически не отличается от стандартного, но возможны физиологические колебания от 19 до 25 ммоль/л. Раньше этот показатель называли щелочным резервом. Он определяет способность крови нейтрализовать кислоты.
5. Буферные основания (ВВ). Общая сумма всех анионов, обладающих буферными свойствами, в стандартных условиях. 40-60 ммоль/л.
При определенных условиях реакция крови может изменяться. Сдвиг реакции крови в кислую сторону, называется ацидозом, в щелочную, алкалозом. Эти изменения рН могут быть дыхательными и недыхательными или метаболическими. Дыхательные изменения реакции крови обусловлены изменениями содержания углекислого газа. Недыхательные - бикарбонат анионов. В здоровом организме, например при пониженном атмосферном давлении или усиленном дыхании (гипервентиляции) снижается концентрация СО2 в крови. Возникает дыхательный алкалоз. Недыхательный развивается при длительном приеме растительной пищи или воды, содержащей гидрокарбонаты. При задержке дыхания развивается дыхательный, а тяжелой физической работе, недыхательный ацидоз. Изменения рН могут быть компенсированными и некомпенсированными. Если реакция крови не изменяется, то это компенсированные алкалоз и ацидоз. Сдвиги компенсируются буферными системами, в первую очередь бикарбонатной. Поэтому они наблюдаются в здоровом организме. При недостатке или избытке буферных компонентов имеет место частично компенсированные ацидоз и алкалоз, но рН не выходит за пределы нормы. Если же реакция крови меньше 7,29 или больше 7,56 наблюдается некомпенсированные ацидоз и алкалоз. Самым грозным состоянием в клинике является некомпенсированный метаболический ацидоз. Он возникает вследствие нарушений кровообращения и гипоксии тканей, а как следствие, усиленного анаэробного расщепления жиров и белков и т.д. При рН ниже 7,0 происходят глубокие изменения функций ЦНС (кома), возникает фибрилляция сердца, падает артериального давления, угнетается дыхание и может наступить смерть. Метаболический ацидоз устраняется коррекцией электролитного состава, искусственной вентиляцией и т.д.
№4 Основные показатели. Структурные элементы и форма эритроцитов. Эритроциты — самые многочисленные форменные элемен-т ы крови; в зависимости от размеров различают нормоциты, микроциты и макроциты. Эритроциты не имеют ядра, митохондрий, белоксинтезирующей системы, для них характерна гомогенная цитоплазма. В эритроцитах содержится до 60 % воды (в других клетках 80 % и более) и 40 % сухого остатка, причем 34 % из него приходится на долю гемоглобина, около 6 % составляют различные белки, глюкоза, липиды и минеральные вещества. Таким образом, гемоглобин составляет 90—95 % сухой массы эритроцитов.
Около 85 % всех эритроцитов составляют дискоциты, имеющие форму двояковогнутого диска (рис. 9.2), что улучшает диффузионные свойства оболочки эритроцитов (см. ниже) и облегчает прохождение их через капилляры вследствие деформации. Остальные 15 % эритроцитов имеют различную форму, размеры и отростки. В мембране и цитоскелете эритроцитов обнаружены рецепторные белки — гликопротеиды, каталитические ферменты, играющие роль в транспорте ионов и образующие каналы в мембране. Она проницаема для анионов НСО3~, С1~, а также для О2, СО2, Н+, ОН, но при этом малопроницаема для катионов К+, Na+.
Продолжительность жизни эритроцита в кровяном русле — около 120 дней.
Количество эритроцитов у мужчин колеблется в пределах 4,5-5,5 х 1012/л, у женщин — 3,7-4,7 х 1012/л. Количество эритроцитов в крови изменяется как в норме, так и в условиях патологии. Эритроцитоз — увеличение количества эритроцитов в периферической крови. Различают два вида эритроцито-за: относительный и абсолютный. Относительный эритроцитоз развивается без активации эритропоэза, является следствием сгущения крови. Абсолютный эритроцитоз — результат усиления эритропоэза. Наблюдается два его вида: 1) компенсаторный (физиологический) — у здоровых лиц, жителей высокогорных районов в связи с хронической
гипоксией и стимуляцией эритропоэза; 2) патологический — при различных патологиях. Эритропения — уменьшение количества эритроцитов в единице объема крови; она также имеет два вида: 1) относительная эритропения — обусловлена избытком воды; 2) абсолютная эритропения — связана с различными патогенетическими процессами.
Скорость оседания эритроцитов (СОЭ) невысока (у мужчин составляет 1—10 мм/ч, у женщин — 2—15 мм/ч), что обусловлено преобладанием в плазме крови белков альбуминовой фракции. Альбумины являются лиофильными коллоидами и способствуют созданию вокруг эритроцитов гидратной оболочки, удерживая их во взвешенном состоянии. Глобулины, являясь лиофобными коллоидами, способствуют уменьшению гидратной оболочки вокруг эритроцитов и отрицательного заряда их мембран, что ведет к усилению агрегации эритроцитов и ускорению их оседания. При некоторых патологиях СОЭ повышается, так как увеличивается количество глобулинов в крови (гаптоглобина, церуло-плазмина, липопротеидов, парапротеи-нов, фибриногена), получивших название агломеринов. Оседание эритроцитов объясняется большим удельным весом их (1,096), нежели плазмы крови (1,027) (СОЭ определяют в пробирке), но кровь при этом не должна свертываться. Свойства эритроцитов Эритроциты обладают высокой пластичностью (способностью к обратимой деформации), что облегчает их прохождение через капилляры диаметром до 2,5—3 мкм. Свойство пластичности хорошо выражено у дискоидных эритроцитов (размеры 7,2—7,5 мкм). По мере старения эритроцитов пластичность их снижается, они превращаются в сфероциты (имеют форму шара), вследствие чего уже не могут проходить через капилляры диаметром до 3 мкм и поэтому задерживаются в селезенке, где и разрушаются («кладбище» эритроцитов). Пластичность оболочки эритроцитов обеспечивает их осмотическую стойкость. Осмотическое давление в эритроцитах несколько выше, чем в плазме крови, что обеспечивает тургор клеток вследствие поступления воды в эритроцит. Повышенное осмотическое давление — это результат более высокой внутриклеточной концентрации белков по сравнению с плазмой крови. При помещении эритроцитов в гипотонический раствор вода поступает в них, они набухают; при этом может наступить осмотический гемолиз (разрушение эритроцитов), в результате чего гемоглобин выходит в окружающую среду. При помещении эритроцитов в гипертонический раствор происходит их смо-раживание, что связано с выходом воды из эритроцита в среду.
Эритроциты способны к агрегации — образованию конглометров при замедлении движения крови и повышения ее вязкости, что может наблюдаться при патологиях. Вначале агрегация эритроцитов носит обратимый характер, при этом образуются ложные агрегаты или монетные столбики. В случае быстрого восстановления кровотока они распадаются на полноценные клетки. При более длительном нарушении кровотока образуются истинные агрегаты, возникает микротромбообразование, нарушается микроциркуляция и обмен веществ в тканях.
Метаболизм эритроцитов значительно ниже, чем таковой других клеток организма. В эритроците синтезируются белки, гем, липиды, резко снижено содержание нуклеиновых кислот и АТФ. Почти полностью выключены
окислительные процессы, что является весьма экономичным в энергетическом отношении. Энергетическое обеспечение эритроцита осуществляется только за счет утилизации глюкозы в результате анаэробного гликолиза. Однако для поддержания ряда других функций и стабильности мембраны эритроцитов важное значение имеет способность клеток к синтезу определенного количества АТФ, а также соединений с высокой восстанавливающей способностью, в частности NADP, NADPH.
Основные функции эритроцитов:!) главная функция — дыхательная {транспорт О2 и СО2, переносят и другие вещества); 2) участие в стабилизации КОС крови за счет гемоглобина и наличия фермента карбоангидразы; 3) участие в процессах свертывания крови (п. 9.6.4 и 9.7); 4) дезинтоксикация веществ — обеспечивается адсорбцией токсичных продуктов эндогенного и экзогенного происхождения и их инактивацией; 5) участие в иммунных реакциях организма, в реакциях преципитации, лизиса, опсонизации, в реакциях цито-токсического типа, поскольку мембрана обладает свойствами антигенов.
Дыхательная функция эритроцитов будет охарактеризована отдельно, она осуществляется с помощью гемоглобина.
Физиология гемоглобина (от греч. haeта — кровь и лат. glomus — шарик).
Общая характеристика. В каждом эритроците содержится около 28 млн молекул гемоглобина. Гемоглобин — сложный белок (относится к классу так называемых хромопротеидов), состоит из железосодержащих групп гема и белка глобина. На долю гема приходится 4 %, на белковую часть — 96 %. Молекулярная масса гемоглобина составляет 64 500 Да. У мужчин содержание гемоглобина в среднем составляет 130—160 г/л, у женщин — 120—140 г/л. Гем — это комплексное соединение протопорфирина IX с железом. Именно гем обеспечивает транспорт О2 и СО2 (п. 10.3); также он выполняет буферную функцию — способен связывать ионы Н+.
Соединения гемоглобина. Физиологические соединения — оксигемоглобин, карбогемоглобин (соединение гемоглобина с СО2) и восстановленный гемоглобин, т.е. дезоксигемоглобин. В составе этих соединений гемоглобина сохраняется двухвалентное железо. Благодаря железосодержащим группам гема гемоглобин способен обратимо связывать О2 и выполнять дыхательную функцию, чему способствует также двояковогнутая форма — увеличение площади контакта с О2 и СО2 и возможности деформации эритроцитов при прохождении его через узкие капилляры (см. рис. 9.2).
Патологические соединения — мет-гемоглобин и карбоксигемоглобин. При воздействии на гемоглобин окислителей (например, перекисей, супероксидного анион-радикала, нитритов) происходит истинное окисление гемоглобина с превращением двухвалентного железа гемоглобина в трехвалентное с образованием метгемоглобина, который не способен вступать в обратимую реакцию с О2, что нарушает дыхательную функцию гемоглобина. Карбоксигемоглобин — соединение гемоглобина с угарным газом — окисью углерода (СО). Сродство СО к гемоглобину в 300 раз выше, чем О2 к гемоглобину; распад карбоксигемоглобина происходит в 10 тыс. раз медленнее, чем оксигемоглобина. Высокое сродство гемоглобина к СО обусловливает высокую ядовитость угарного газа. Примесь даже 0,1 % СО в окружающем
воздухе приводит к тому, что почти 80 % гемоглобина оказывается связанным с угарным газом, в результате чего перенос кислорода гемоглобином нарушается — в тяжелых случаях возможен летальный исход от нехватки тканям кислорода.
Регуляция эритропоэза (образования эритроцитов). Продукция форменных элементов крови (гемоцитопоэз) осуществляется в гемопоэтических тканях: миелоидной (в эпифизах трубчатых и полости многих губчатых костей) и лимфо-идной (тимус, селезенка, лимфатические узлы). В миелоидной ткани образуются эритроциты, тромбоциты, гранулоциты, моноциты, предшественники лимфоцитов. В лимфоидной ткани продуцируются лимфоциты, плазматические клетки. Популяция циркулирующих эритроцитов в норме составляет 25 х 1012 и содержит около 750 г гемоглобина. Для поддержания постоянства содержания эритроцитов в крови из костного мозга в кровь поступает в 1 мин примерно 1,8 х 109 молодых эритроцитов (ретику-лоцитов).
Нервная регуляция. Количество эритроцитов в крови может реф-лекторно изменяться при раздражении рецепторов слизистой полости рта. Поэтому исследование содержания эритроцитов в крови проводят до принятия пищи. Стимуляторами гемопоэза являются многие БАВ.
Регуляция с помощью БАВ. Эритропоэтин (гликопротеид). Его биологическая активность в значительной мере обусловлена наличием в молекуле остатков тирозина, триптофана, а также сиаловой кислоты. Основным органом синтеза эритропоэтина являются почки, его образование стимулируется гипоксией. При избытке кислорода вырабатывается ингибитор эритропоэза. Механизмы стимуляции продукции эритропоэтина в условиях гипоксии представлены на рис. 9.3.
Гормоны. Стимулируют эритропоэз со-матотропин, тиреоидные гормоны (оказывают стимулирующее воздействие на эритропоэз не только путем повышения почечной продукции эритропоэтина, но и прямым действием на эритропоэтин-чувствительные клетки, реализуемым через B2-адренорецепторы), глюкагон (оказывает ингибирующее влияние на эритропоэз).
Для образования эритроцитов не-обходимы витамины. Фолиевая кислота и витамин В12 стимулируют процессы биосинтеза ДНК в клетках костного мозга. При их нехватке нарушается процесс созревания эритроцитов и укорачивается срок жизни последних. Витамин В12 усваивается при поступлении с пищей только при взаимодействии его с внутренним фактором Кас-ла — гастромукопротеидом, который продуцируется париетальными клетками слизистой оболочки желудка. При
взаимодействии витамина В12 (внешний фактор) с внутренним фактором Касла образуется комплекс, в котором витамин В12 защищен от расщепления ферментами ЖКТ. Кроме того, только в комплексе с внутренним фактором витамин В12 связывается с мембранными рецепторами энтероцитов в подвздошной кишке и всасывается в кровь. После всасывания витамин В12 депонируется в печени и затем медленно, по мере необходимости, освобождается и доставляется к костному мозгу и другим тканям. Его запасов в организме хватает на 3—4 года.
Микроэлементы необходимы для следующих процессов: а) созревания эритробластов, дифференцировки их в нормоциты; б) повышения обмена веществ в кроветворных органах, усиления насыщения эритроцитов гемоглобином (марганец); в) синтеза гема и глобина (железо, кобальт, медь); г) стимуляции образования эритропоэтинов (кобальт).
Физиология лейкоцитов
Общая характеристика лейкоцитов. Количество лейкоцитов в крови составляет (4-9) х 109/л. Лейкоциты (в отличие от эритроцитов) содержат ядра; размеры лейкоцитов 4—20 мкм (наиболее частый вариант 8—12 мкм). Продолжительность жизни гранулоцитов и моноцитов составляет 4—20 дней, лимфоцитов — 100— 120 дней. Увеличение количества лейкоцитов в крови называют лейкоцитозом, уменьшение — лейкопенией. Имеется две группы лейкоцитов: гранулоциты (нейтрофилы, эозинофилы, базофилы) и агранулоциты (моноциты, лимфоциты). Лейкограмма {лейкоцитарная формула) — это процентное отношение различных видов лейкоцитов в крови: нейтрофилы 46—78 % (из них 47—72 % сегментоядерные, 1—6 % палочкоядерные), эозинофилы 1—5 %, базофилы 0—1 %, моноциты 2—10 %, лимфоциты 18—40%. Индекс регенерации (нейтрофильный индекс) — отношение молодых форм нейтрофильных лейкоцитов (миелоцитов, метамиелоцитов, палочкоядерных) к старым (сегментоядерным); в норме равен 0,065. Этот индекс позволяет судить о состоянии красного костного мозга.
Различают сдвиг лейкограмм ы влево и вправо. Сдвиг влево является следствием повышенной функции красного костного мозга и сопровождается увеличением содержания в крови молодых форм нейтрофилов. Сдвиг вправо — понижение функции красного костного мозга, характеризуется увеличением содержания в крови старых форм нейтрофильных лейкоцитов.
Свойства лейкоцитов: фагоцитоз, амебовидная подвижность, миграция (диапедез) — способность проникать через стенку неповрежденных капилляров.
Функции лейкоцитов: 1) защитная (фагоцитоз микробов, бактерицидное и антитоксическое действие, участие в иммунных реакциях); 2) участие в процессах свертывания крови и фибринолиза; 3) регенеративная — способствуют заживлению поврежденных тканей; 4) транспортная — лейкоциты являются носителями ряда ферментов.
Стадии фагоцитоза: 1)стадия приближения фагоцита к объекту фагоцитоза (хемотаксис) за счет хеморецеп-тивной «чувствительности»; 2) стадия аттракции — прикрепление фагоцита к объекту фагоцитоза, осуществляется с помощью опсонинов сыворотки крови (компоненты плазмы, способные осаждаться на поверхности чужеродного объекта и делать его более фагоцитабельным);
3) стадия поглощения частицы — осуществляется с непосредственной затратой энергии (АТФ, гликолиз и гликогенолиз); 4) стадия киллинга (уничтожения) жизнеспособных объектов и их переваривания — осуществляется с помощью лизосомных ферментов фагоцитов.
Функциональные особенности гранулоцитов
Нейтрофилы. Зрелые сегментоядерные нейтрофилы находятся в синусах костного мозга в течение 3—4 дней (в кровеносном русле 6—8 ч), далее мигрируют в слизистые оболочки, ткани, где превращаются в микрофаги. Покинувшие сосудистое русло нейтрофилы в кровоток не возвращаются и разрушаются в тканях. Часть нейтрофилов удаляется из организма через ЖКТ. В лизосомах нейтрофилов происходит гидролитическое расщепление бактерий. Лизоцим нейтрофилов оказывает бактериостатическое и бактериолитическое действие, участвует в разрушении поврежденных при воспалении тканей и клеток организма. Интерферон нейтрофилов — один из элементов противовирусной защиты. Нейтрофилы с помощью стимуляции кининогенеза активируют контактную фазу процесса свертывания крови.
Эозинофилы. Имеют цитоплазму, подобную содержимому лизосом; в крови циркулируют около 5 ч и постепенно переходят в ткани, где и разрушаются. Основную часть энергии для своей жизнедеятельности эозинофилы получают в результате аэробного и анаэробного гликолиза. Их количество повышается при аллергических реакциях, глистных инвазиях и аутоиммунных заболеваниях. Эозинофилы инактивируют гистамин, в участке воспаления — брадикинин и ряд других БАВ. Обладают фагоцитарной активностью (микрофаги), участвуют в процессах свертывания крови и фибринолиза (они синтезируют плазминоген).
Базофилы созревают в костном мозге в течение 1,5 сут, в кровь выходят через 2—7 дней, где циркулируют около 6 ч; содержат много гистамина, гепарина, гиалуроновой кислоты. Базофилы участвуют в аллергических и воспалительных реакциях, в процессах фагоцитоза, свертывании крови и фибринолиза (в них содержится ряд прокоагулянтных факторов, вазоактивные амины, калликреин).
Функциональные особенности агранулоцитов
Моноциты — наиболее крупные клетки (12—18 мкм) по сравнению с другими лейкоцитами, они — предшественники тканевых макрофагов, центральное звено мононуклеарно-фагоцитарной системы. После миграции в ткани макрофаги живут более месяца (по некоторым данным, несколько лет), сохраняя способность снова переходить в кровеносное русло. Для них характерно максимальное содержание лизосом, образование псевдоподий, наличие множества выростов, инвагинаций мембраны. Фагоцитарная функция обеспечивается выраженной способностью этих клеток к миграции и накоплению в очагах воспаления, регионарных лимфатических узлах, селезенке, печени. Бактерицидное действие моноцитов осуществляется за счет ферментов миелопероксидазы и каталазы, перекиси водорода, катионных белков, лактоферрина. Моноциты обеспечивают также противоопухолевый иммунитет. Выполнение своих функций моноциты опосредуют через выработку и секрецию ими интерлейкинов, активируют рост и функции других лейкоцитов.
Лимфоциты. Основная их функция — участие в реакциях специфического иммунитета. Обучение клеток-предшественниц Т-лимфоцитов происходит в тимусе в результате контакта клеток с его стромой под действием гормонов, вырабатываемых в нем. По выполняемой функции выделяют несколько видов Т-лимфоцитов: Т-киллеры — осуществляют иммунный лизис клеток-мишеней (возбудителей инфекционных заболеваний, актиномицетов, микобак-терий, опухолевых клеток), участвуют в реакциях отторжения трансплантата; Т-эффекторы (хелперы) — осуществляют реакции гиперчувствительности замедленного типа при многих инфекционных заболеваниях, участвуют в синтезе антител; Т-супрессоры — обеспечивают саморегуляцию системы иммунитета: подавляют иммунный ответ на антигены и предотвращают возможность развития аутоиммунных реакций; Т-клетки иммунной памяти — обеспечивают возможность воспроизведения иммунного ответа при повторном контакте организма с антигеном.
В-лимфоциты. Процесс обучения происходит в лимфатических узлах кишечника, костном мозге, миндалинах. Различают В1- и В2-лимфоциты (п. 19.5), В-супрессоры, подавляющие иммунный ответ, В-клетки иммунной памяти, В-киллеры (natural killers — естественные киллеры, NK-клетки), осуществляющие цитолиз клеток-мишеней (например, клеток, пораженных вирусом, клеток опухолей). В-лимфоциты обеспечивают реакции гуморального иммунитета, и среди них выделяют клетки-продуценты антител, причем каждая лимфоидная клетка способна продуцировать антитела одной специфичности. Имеются и другие виды лимфоцитов.
Регуляция лейкопоэза. Различают лим-фопоэз — процесс образования лимфоцитов и миелопоэз — процесс образования гранулоцитов и моноцитов. Регуляция миелопоэза. Количество лейкоцитов в крови изменяется рефлекторно при раздражении пищей различных рецепторов слизистой рта.
Роль лейкопоэтинов (колониестиму-лирующий фактор — КСФ). КСФ — гликопротеид, стимулирует гранулоци-топоэз и моноцитопоээ. КСФ образуется в моноцитарно-макрофагальных клетках крови, в лимфоцитах, клетках стромы кроветворных органов, клетках сосудистой стенки.
АКТГ, глюкокортикоиды и катехола-мины стимулируют миелопоэз с помощью усиления процесса синтеза КСФ моноцитарно-макрофагальными элементами. Однако под влиянием избыточных концентраций глюкокортикои-дов органы лимфоидной ткани (тимус, селезенка, лимфатические узлы) атрофируются. Андрогены стимулируют миелопоэз, действуя на стволовые клетки и, возможно, стимулируя активность всех клеток костного мозга, участвующих в гемопоэзе. Ингибиторы миелопоэза'. лак-тоферрин, содержащийся в мембране макрофагов, кислый изоферритин, гра-нулоцитарные кейлоны (вид пептидов). Кейлоны избирательно тормозят проли-феративную активность миелобластов и промиелоцитов.
Регуляция лимфоцитопо-э з а. Антитела способны усиливать или подавлять продукцию лимфоцитов. Стимулируют лимфопоэз лимфокины, интенсивно продуцируемые на фоне антигенного воздействия на организм. Лимфоцитарные кейлоны (вид гликопротеидов) — ингибиторы клеточного деления, что осуществляется с помощью подавления синтеза ДНК. Эти кейлоны вырабатываются в селезенке, тимусе, лимфобластах. Лимфопоэтины регулируют процессы дифференцировки лимфоцитов. Роль простагландинов неоднозначна. Так, простагландин Е1 усиливает пролиферацию и дифференцировку Т-лимфоцитов в стимулированных антигеном культурах клеток тимуса и селезенки, ингибируя при этом активность В-лимфоцитов. Простагландин Е2 подавляет митогенный ответ Т-клеток, но не В-лимфоцитов. Преимущественно подавляют лимфопоэз липопротеиды с низкой плотностью (а-липопротеид, B2-фетопротеид), ненасыщенные жирные кислоты, а2-глобулин (С-реактивный белок).
Свойства и функции тромбоцитов
Тромбоциты — маленькие кровяные пластинки (диаметр 2—5 мкм), не имеют ядра, содержат гранулы. При соприкосновении с чужеродной поверхностью распластываются и выпускают псевдоподии. В 1 л крови содержится (180-320) х 109 тромбоцитов.
Свойства тромбоцитов заключаются в их способности к: 1) фагоцитозу; 2) амебовидной подвижности; 3) секреторной активности; 4) адгезии; 5) агрегации.
Адгезия — прилипание к чужеродной поверхности, в частности к измененной сосудистой стенке. Для адгезии тромбоцитов необходимы коллаген, обнаженная базальная мембрана сосуда, фактор Виллебранда, содержащийся в субэндотелии, плазме и ос-гра-нулах пластинок, а также фибронектин, имеющийся в стенке сосуда и в самих тромбоцитах. Способствуют адгезии АДФ, освобождающаяся при гемолизе эритроцитов, фибриноген, ионы кальция, взаимодействие поверхностного отрицательного заряда тромбоцита с положительным зарядом интимы кровеносного сосуда (он становится положительным после повреждения); тромбоциты активируются, чему способствует их агрегация (рис. 9.4).
Агрегация — склеивание тромбоцитов друг с другом, которое вызывает ряд веществ: адреналин, серотонин, АДФ, тромбин, коллаген, простагландины, фактор, активирующий тромбоциты, ионы кальция. Агрегация и адгезия кровяных пластинок начинаются со взаимодействия фактора, их вызывающего (индуктора), со специфическими рецепторами тромбоцитов, которыми являются гликопротеиды.
Функции тромбоцитов: 1) участие в свертывании крови; 2) ангиотрофи-ческая — питание эндотелия капилляров, благодаря чему поддерживается структура и функция сосудов микро-циркуляторного русла; 3) регуляция тонуса сосудистой стенки — с помощью серотонина, содержащегося в гранулах тромбоцитов; 4) участие в защитных реакциях организма (фагоцитоз).
Дополнительно: Гемоглобин
Кровянной пигмент/дающий окраску/, хромопротеид/класс окрашенных белков/. Состоит из 4 гемов/4 пирольных конца и 2 атома Fe/ и 1 молекулы глобина
Виды гемоглобина:
1. Гемоглобин А (Нв А) - гамоглобин взрослого
2. Гемоглобин F (фетальный, Нв F) - гемоглобин плода, заменяется в течении первого года на Нв А.
3. Гемоглобин Р (примитивный, Нв Р) - обнаруживается в первые месяцы эмбриональной жизни.
4. Патологические виды гемоглобина, например - (Нв S). Нв S наблюдается при серповидной анемии.
Функции гемоглобина:
1. Транспорт дыхательных газов. В основном это транспорт кислорода. Углекислый газ транспортируется с Нв очень незначительная часть.
2. Гемоглобин принимает участие в поддержании рН на постоянном уровне - буферная система гемоглобина.
Соединения гемоглобина:
1. Оксигемоглобин - соединение Нв с кислородом.
2. Карбогемоглобин - соединение Нв с углекислым газом (СО2).
3. Карбоксигемоголобин - соединение Нв с угарным газом (СО).
4. Метгемоглобин - соединение Нв с кислородом. Это соединение образуется в присутствии сильных окислителей и при этом железо (Fе) изменяет свою валентность - становится 3-х валентным.
Клинико-физиологическая оценка содержания гемоглобина
Содержание гемоглобина: у мужчин 13-16 мг% (130-160 г/л), у женщин - 12-14 мг% (120-140 г/л). Гиперхромемия - увеличение содержания гемоглобина. Гипохромемия - снижение содержания гемоглобина/анемия
Цветовой показатель
Цветовой показатель (ЦП) - отражает относительное насыщение эритроцитов гемоглобином. Найденное количество гемоглобина отнесенное к количеству эритроцитов, разделить на отношение количество гемоглобина в норме отнесенное к количеству эритроцитов в норме. В норме ЦП составляет от 0,8 до 1,0 - эти эритроциты называют нормохромными. Если ЦП больше 1,0, то это состояние называют гиперхромией , а а эритроциты гиперхромными, а если ЦП меньше 0,8 - гипохромией, а эритроциты - гипохромными.
№5 см №4
№6 см №4
Дополнительно: Для нормального эритропоэза необходимо железо. Последнее поступает в костный мозг при разрушении эритроцитов, из депо, а также с пищей и водой. Взрослому человеку для нормального эритропоэза требуется в суточном рационе 12—15 мг железа. Железо откладывается в различных органах и тканях, главным образом в печени и селезенке. Если железа в организм поступает недостаточно, то развивается железодефицитная анемия. Всасыванию железа в кишечнике способствует аскорбиновая кислота, переводящая Fe3+ в Fe2+, который сохраняет растворимость при нейтральных и щелочных значениях рН. На участке слизистой оболочки тонкой кишки имеются рецепторы, облегчающие переход железа в энтероцит, а оттуда в плазму. В слизистой оболочке тонкой кишки находится белок-переносчик железа — трансферрин. Он доставляет железо в ткани, имеющие трансферриновые рецепторы. В клетке комплекс трансферрина и железа распадается, и железо вступает в связь с другим белком-переносчиком — ферритином. Клетки-предшественники зрелых эритроцитов накапливают железо в ферритине. В дальнейшем оно используется, когда клетка начинает образовывать большое количество гемоглобина. Важным компонентом эритропоэза является медь, которая усваивается непосредственно в костном мозге и принимает участие в синтезе гемоглобина. Если медь отсутствует, то эритроциты созревают лишь до стадии ретикулоцита. Медь катализирует образование гемоглобина, способствуя включению железа в структуру гема. Недостаток меди приводит к анемии. Для нормального эритропоэза необходимы витамины и в первую очередь витамин B12 и фолиевая кислота. Для его образования необходим кобальт. В организм человека витамин B12 поступает с пищей — особенно его много в печени, мясе, яичном желтке. Для всасывания витамина В12 требуется внутренний фактор кроветворения, который носит наименование «гастромукопротеин». Это вещество является комплексным соединением, образующимся в желудке. Витамин В12 и фолиевая кислота принимают участие в синтезе глобина. Они обусловливают образование в эритробластах нуклеиновых кислот, являющихся одним из основных строительных материалов клетки.
Особо важную роль в регуляции эритропоэза играют специфические вещества, получившие наименование эритропоэтины обнаружены в крови здоровых людей, что позволяет считать их физиологическими регуляторами эритропоэза. Эритропоэтины оказывают действие непосредственно на клетки-предшественники эритроидного ряда (КОЕ-Э – колониеобразующая единица эритроцитарная). Функции эритропоэтинов сводятся к следующему: 1) ускорение и усиление перехода стволовых клеток костного мозга в эритробласты; 2) увеличение числа митозов клеток эритроидного ряда; 3) исключение одного или нескольких циклов митотических делений; 4) ускорение созревания неделящихся клеток — нормобластов, ретикулоцитов.
На эритропоэз действуют соединения, синтезируемые моноцитами, макрофагами, лимфоцитами и другими клетками, получившие название «интерлейкины
Регуляция лейкопоэза.Важная роль в регуляции лейкопоэза отводится интерлейкинам. В частности, ИЛ-3 не только стимулирует гемопоэз, но и является фактором роста и развития базофилов. ИЛ-5 необходим для роста и развития эозинофилов. Многие интерлейкины (ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7 и др.) являются факторами роста и дифференцировки Т- и В-лимфоцитов Лейкоциты являются наиболее «подвижной» частью крови, быстро реагирующей на различные изменения в окружающей среде и организме развитием лейкоцитоза, что обеспечивается существованием клеточного резерва. Известны два типа гранулоцитарных резервов — сосудистый и костномозговой. Сосудистый гранулоцитарный резерв представляет собой большое количество гранулоцитов, расположенных вдоль стенок сосудистого русла, откуда они мобилизуются при повышении тонуса симпатического отдела автономной (вегетативной) нервной системы.
Своеобразные изменения претерпевают лейкоциты в разные стадии адаптационного синдрома, что обусловлено действием гормонов гипофиза (АКТГ) и надпочечника (адреналина, кортизона, дезоксигидрокортизона). Уже через несколько часов после стрессорного воздействия развивается лейкоцитоз, который обусловлен выбросом нейтрофилов, моноцитов и лимфоцитов из депо крови. При этом число лейкоцитов не превышает 16—18 тыс. в 1 мкл. В стадии резистентности число и состав лейкоцитов мало отличаются от нормы. В стадии истощения развивается лейкоцитоз, сопровождающийся увеличением числа нейтрофилов и снижением числа лимфоцитов и эозинофилов.
№7 Под термином «гемостаз» понимают комплекс реакций, направленных на остановку кровотечения при травме сосудов. Значение системы гемостаза намного сложнее и шире. Факторы гемостаза принимают участие в сохранении жидкого состояния крови, регуляции транскапиллярного обмена, резистентности сосудистой стенки, влияют на интенсивность репаративных процессов и др.
Принято различать сосудисто-тромбоцитарный гемостаз и процесс свертывания крови. В первом случае речь идет об остановке кровотечения из мелких сосудов с низким кровяным давлением, диаметр которых не превышает 100 мкм, во втором — о борьбе с кровопотерей при повреждениях артерий и вен. Такое деление носит условный характер, потому что при повреждении как мелких, так и крупных кровеносных сосудов всегда наряду с образованием тромбоцитарной пробки осуществляется свертывание крови.
Система гемостаза относится к одной из важнейших защитных систем организма, обеспечивающих: *сохранение жидкого состояния крови в системе циркуляции; *регуляцию ее агрегантного состояния (текучести, реологических свойств); *остановку возникшего кровотечения при повреждении стенки сосуда; *ликвидацию (растворение) образовавшегося тромба и восстановление проходимости сосуда; *поддержание гемостаза (постоянство внутренней среды) в самом широком смысле этого слова.
И наконец, система гемостаза играет важную роль в иммунологических, воспалительных реакциях, функциональном состоянии микроциркуляции, а также осуществляет ключевую роль в механизмах развития шока, тромбоза, тромбоэмболии, метастазирования при злокачественных опухолях и т. д.
Свёртывающая система крови— многоступенчатая ферментная система, при активации которой растворенный в плазме крови фибриноген подвергается после отщепления краевых пептидов полимеризации и образует в кровеносных сосудах фибринные тромбы, останавливающие кровотечение.
Система гемостаза включает в себя форменные элементы крови (главным образом тромбоциты), сосудистую стенку, плазменные факторы свертывания и противосвертывания. Важная роль в свертывании крови принадлежит биологически активным веществам, способствующим свертыванию крови, препятствующим свертыванию крови и разжижающим уже свернувшуюся кровь. Эти вещества содержатся в плазме и форменных элементах крови, а также в тканях, в том числе сосудистой стенки.
Cосудисто-тромбоцитарный гемостаз. Остановка кровотечения начинается с первичной реакции крови на травму ткани и сосуда, важнейшая роль в которой принадлежит тромбоцитам.
Роль тромбоцитов в первичном гемостазе определяется их способностью прилипать к поверхности сосудистой стенки у места повреждения (адгезия), подвергаться биохимическим и структурным изменениям, высвобождать содержимое своих гранул (реакция освобождения) и склеиваться друг с другом (агрегация).
Адгезия (прилипание) тромбоцитов происходит только к поврежденному эндотелию при контакте с соединительной тканью, главным образом с коллагеном.
Механизм адгезии связан с дзета-потенциалом тромбоцитов: группы отрицательно заряженных сиаловых кислот на их мембране реагируют с положительно заряженными аминогруппами коллагена сосудистой стенки. Важную роль в адгезии тромбоцитов играют двухвалентные катионы и фактор Виллебранда (тканевый фактор, синтезируемый в эндотелии сосудов, для которого на тромбоцитах имеются специфические рецепторы).
Агрегация и аккумуляция тромбоцитов являются следующим этапом образования гемостатической пробки. Главный стимулятор агрегации — АДФ, источником которой служат поврежденный эндотелий, разрушенные эритроциты и тромбоциты. Другим важным агрегирующим фактором является тромбин, вызывающий агрегацию в значительно меньших количествах, которые необходимы для свертывания крови. Следы тромбина, образовавшиеся при активации внешнего или внутреннего механизма гемостаза, резко усиливают освобождение АДФ и других пластиночных факторов, способствующих уплотнению тромбоцитарной пробки.
Реакция освобождения является активным секреторным процессом, протекающим без повреждения мембраны и разрушения клеток. Освобождение может протекать в один или два этапа.
Препятствуют агрегации: повышение уровня цАМФ в тромбоцитах; простагландины Ei и D2; простациклин (активный вазодилататор).
Способствуют агрегации: снижение цАМФ в тромбоцитах; простагландины Е2, F2, тромбин, адреналин, эпинефрин.
Формирование тромбоцитарной пробки (ретракция). Изменение формы тромбоцитов и ретракция (уплотнение) тромбоцитарной пробки происходят при обязательном участии актиномиозиноподобного сократительного белка — тромбостенина.
Коагуляционный гемостаз
Характеристика факторов свертывания крови. Гомеостаз с помощью свертывания крови (т.е. гемокоагуляции) заключается в переходе растворимого белка плазмы крови фибриногена в нерастворимое состояние — фибрин, что ведет к образованию тромба, закрывающего просвет поврежденного сосуда, и остановке кровотечения. Факторы свертывания крови обозначают римскими цифрами с буквой «F», например: F IIа (буква «а» означает «активный»). Факторы содержатся в плазме крови, в форменных элементах и тканях, это в основном белки, многие из которых являются ферментами, но находятся в крови в неактивном состоянии. Большинство плазменных
факторов свертывания крови образуется в печени, для образования некоторых из них необходим витамин К. Ниже приводится краткая характеристика факторов свертывания крови.
F I (фибриноген) — образуется в печени, под влиянием тромбина переходит в фибрин, в результате чего образуются нити фибрина.
F II (протромбин) — образуется в печени в присутствии витамина К, под влиянием протромбиназы превращается в тромбин.
F III (тромбопластин) — входит в состав мембран клеток всех тканей и форменных элементов крови, активирует фактор VII и, вступая с ним в комплекс, активирует фактор X.
F IV (Са2+) — участвует в образовании ряда комплексов факторов свертывания крови.
F V (проакцелерин) — глобулин, образующийся в печени; активируется тромбином (входит в состав протромбиназы).
F VII (проконвертин) — образуется в печени под влиянием витамина К, участвует в формировании протромбиназы по внешнему механизму.
F VIII (антигемофильный глобулин А) — синтезируется в печени, селезенке, лейкоцитах, образует комплекс с фактором Виллебранда и специфическим антигеном, активируется тромбином, совместно с фактором IХа способствует активации фактора X.
F IX (антигемофильный глобулин В) — образуется в печени под влиянием витамина К, активирует факторы VII и X.
F X (Стюарта—Прауэр) — образуется в печени под влиянием витамина К, является составной частью протромбина.
F XI (предшественник тромбопла-стина)— необходим для активации фактора IX, активируется фактором ХIIа.
F XII (Хагемана, или контакта) — активируется отрицательно заряженными поверхностями, адреналином, калликреином; после этого, активирует факторы VII, XI и переводит прекалли-креин в калликреин, запускает внутренний механизм образования протромби-назы и фибринолиза.
F XIII (фибринстабилизирующий фактор, фибриназа) — стабилизирует фибрин, содержится практически во всех тканях и форменных элементах.
F XIV (фактор Флетчера, прекал-ликреин) — активируется фактором ХПа; переводит кининоген в кинин, участвует в активации факторов IX, XII и плазминогена.
F XV (фактор Фитцжеральда, Фло-жек, Вильямса) — участвует в активации фактора XII и переводе плазминогена в плазмин; высокомолекулярный кининоген (ВМК), образуется в тканях, активируется калликреином.
Основными плазменными факторами свертывания крови являются: I — фибриноген; II — протромбин; III — тканевый тромбопластин; IV — ионы Са2+.
Факторы с V по XIII — это дополнительные факторы, ускоряющие процесс свертывания крови — акцелераторы.
Плазменные факторы (F) свертывания крови: F I — фибриноген; F II — протромбин (неактивный фермент тромбин); F IV — ионы Са2+. Факторы F V и F VIII — дополнительные факторы (коферменты), ускоряющие процесс свертывания крови — акцелераторы. Факторы II, III, VII, IХ-ХШ — ферменты. Активные плазменные факторы обозначаются теми же цифрами, но с добавлением буквы «а» (F Па, F IIIа и т.д.). Активация плазменных факто-
ров происходит главным образом за счет протеолиза и сопровождается отщеплением пептидных ингибиторов. В зависимости от того, необходим или нет для образования белка витамин К, плазменные факторы подразделяют на две группы: 1) витамин К-зависимые, образующиеся преимущественно в печени при участии витамина К; 2) витамин К-независимые, для синтеза которых витамин К не требуется. Блокада синтеза витамин К-зависимых белков используется для профилактики и лечения внутрисосудистого тромбообра-зования.
Процесс свертывания крови — это ферментативный, цепной (каскадный), матричный (происходит на матрице — поврежденные ткани, фосфолипиды мембран разрушенных форменных элементов, осколки разрушенных клеток тканей) процесс перехода растворимого белка фибриногена в нерастворимый — фибрин. Процесс свертывания крови осуществляется в три фазы.
Фазы свертывания крови
Первая фаза — образование ферментного комплекса — тромбиназы; происходит по двум механизмам — внешнему и внутреннему (рис. 9.6). Внешний механизм образования тромбиназы осуществляется при выделении тканевого тромбопластина, представляющего собой фосфолипидные «осколки» мембран поврежденных клеток тканей и сосуда, и взаимодействии его с плазменным фактором VII и Са2+. Этот механизм назван внешним потому, что тканевый тромбопластин не является составной частью комплекса факторов свертывания крови. Образовавшийся кальциевый комплекс превращает неактивный плазменный фактор X в его активную форму (Ха). Внутренний механизм образования протромбиназы начинается с активации плазменного фактора XII при контакте его с поврежденной стенкой сосуда, с ВМК, калликреином, фактором тромбоцитов (Р3) — фосфолипидными «осколками» мембран тромбоцитов.
Взаимодействие фактора Х I I а с другими факторами превращает фактор X в фактор Ха. Последний взаимодействует с плазменным фактором V, ионами Са2+ и Р3-фактором, в результате чего обра зуется комплекс, называемый протром-биназой.
Вторая ф аз а (рис. 9.7)—образование активного фермента тромбина в результате протеолиза протромбина с помощью протромбиназы. При этом получаются а-, b- и у-тромбины (наиболее активный из них — а-тромбин).
Третья фаза (протекает в три этапа) — превращение растворимого белка фибриногена в нерастворимый — фибрин. Первый этап — образование фибрина-мономера (1М); второй этап — неферментативная полимеризация фибрина, получается растворимый фибрин-полимер (1s); третий этап — образование нерастворимого фибрина (Ii) (см. рис. 9.7). В результате образуется тромб, состоящий из нитей фибрина и осевших в них форменных элементов крови, главным образом эритроцитов. Кровяной сгусток закрывает просвет поврежденного сосуда. В дальнейшем тромб подвергается ретракции (сокращению) и фибринолизу (растворению), в результате чего просвет сосуда восстанавливается.
Регуляция процесса свертывания крови осуществляется с помощью ауторегуля-ции, нервных и гормональных механизмов.
Нервная регуляция.Появление в кровеносном русле пороговой и надпоро-говой концентраций тромбина вызывает возбуждение тромбочувствительных хе-морецепторов основных рефлекторных зон (синокаротидной, аортальной и почечной) и рефлекторный выброс в кровь гепарина, гепариноидов и антитромбина III. Он освобождается из сосудистой стенки, а гепарин и гепарансульфат — из тучных клеток. Афферентные пути от хеморецепторов проходят по волокнам синусного, депрессорного, почечного и других нервов.
При появлении в крови избытка плаз-мина происходит выделение в кровь прокоагулянтов и ингибиторов фибринолиза. Возбуждение симпатической нервной системы ускоряет процесс свертывания крови в основном с помощью усиленного выхода в кровоток тромбо-пластина. Возбуждение парасимпатической нервной системы также ускоряет процесс свертывания крови, в основном посредством увеличения выхода тромбопластина в кровоток. Синтез и выход в кровоток факторов свертывания регулируются по принципу обратной отрицательной связи: чем меньше их в крови, тем больше этих факторов образуется в клетках. Возрастание факторов свертывания и продуктов их распада стимулирует выработку факторов противосвертывания. В крови имеются первичные антикоагулянты, синтезируемые в печени, легких и других органах (они постоянно циркулируют), и вторичные (образуются в процессе свертывания крови и фибринолиза). Первичные антикоагулянты — это антитромбин III и гепарин, обеспечивающие 80 % антикоагулянтной активности крови, а также а2-макроглобулин, дающий 10 % антикоагулянтной активности, и протеин С. Вторичные антикоагулянты — это отработанные факторы свертывания крови (фибрин, активные факторы Х1а и Vа, фибринопептиды А и В, отщепляемые от фибриногена), а также продукты фибринолиза, например антитромбин VI.
Кора больших полушарий участвует в регуляции свертывания крови условно-рефлекторным путем. Ускорение свертываемости крови и повышение ее фибринолитической активности происходит при ожидании боли, физического и умственного напряжения, «предстартовых» ситуациях. Гормональная регуляция гемокоагуляции. Процесс свертывания крови ускоряют: адреналин, вазопрессин, окситоцин, глюкокорти-коиды, минералокортикоиды, половые гормоны; тормозят — липокаин, инсулин, тироксин (вначале стимулируют процесс гемокоагуляции, а затем угнетают). В частности, адреналин, действуя на а-адренорецепторы, запускает высвобождение в кровоток тромбопласти-на и тканевой фибриназы. Из эритроцитов под действием адреналина в плазму выделяются тромбопластин, антигепариновый и фибринстабилизирующий факторы, а также антифибринолитиче-ские соединения. В сосудистой стенке адреналин вызывает отрыв от эндотелия фрагментов клеточных мембран, обладающих свойствами тромбопластина.
состоянии в виде профибринолизин-киназы (проактиватора). Для его активации необходимы лизокиназы тканей, фактор ХПа плазмы; тканевые активаторы (особенно много их содержится в легких, щитовидной железе, простате, матке). Ингибиторы фибрино-л и з а (антиплазмины) — альбумины, включающие две группы: антиплазмины, тормозящие действие активного фермента плазмина (фибринолизина), и ингибиторы превращения плазминогена в плазмин (профибринолизина в фибри-нолизин).
Три фазы фибринолиза (рис. 9.8). Впервой фазе происходит отщепление от проактиватора плазминогена ряда аминокислот под влиянием лизокиназы, поступающей в кровь из тканей и форменных элементов, в результате чего проактиватор плазминогена переходит в активное состояние — активатор плазминогена. Во второй фазе плазминоген (профибринолизин) превращается в плазмин (фибринолизин) в результате отщепления липидного ингибитора под действием активатора на молекулу плазминогена (см. рис. 9.8).
В третьей фазе плазмин обеспечивает расщепление фибрина до полипептидов (высокомолекулярные фрагменты X и Y и низкомолекулярные — D и Е) и аминокислот. Эти фрагменты (продукты деградации фибриногена и фибрина) обладают выраженным антикоагулянтным действием, поэтому их следует отнести к вторичным антикоагулянтам.
Факторы, ускоряющие процесс свертывания крови:
* разрушение форменных элементов крови и клеток тканей (увеличивается выход факторов, участвующих в свертывании крови):
* ионы кальция (участвуют во всех основных фазах свертывания крови);
* тромбин;
* витамин К (участвует в синтезе протромбина);
* тепло (свертывание крови является ферментативным процессом);
* адреналин.
Факторы, замедляющие свертывание крови:
* устранение механических повреждений форменных элементов крови (парафинирование канюль и емкостей для взятия донорской крови);
* цитрат натрия (осаждает ионы кальция);
* гепарин;
* гирудин;
* понижение температуры;
* плазмин.
№8 Группы крови. Совокупность эритроцитарных (агглютиногены) и плазменных (агглютинины) белков определяет разделение крови на группы. Из многочисленных типов классификации наиболее распространена Янского—Ландштейнера (АВО) и резус-принадлежность (Rh+ и Rh-). Открытие групп крови и Rh-фактора сделало возможным ее переливание от донора к реципиенту. Поддержание жидкого состояния крови является обязательным условием сохранения гомеостаза. Антисвертывающая система представлена совокупностью веществ, препятствующих образованию кровяного сгустка (тромб). Фибринолитическая система обеспечивает растворение уже образовавшегося тромба.
Система классификации крови. Существуют разные виды классификации крови на группы. В основе разделения крови людей на группы в системе АВО лежит наличие в эритроцитах агглютиногенов (А, В), а в плазме крови агглютининов (α, β). При взаимодействии одноименных агглютиногенов и агглютининов происходит реакция гемагглютинации, т. е. склеивание эритроцитов.
Изучение условий агглютинации эритроцитов привело к открытию групп крови и сделало возможным ее переливание. Агглютиногены возникают у человека еще в эмбриональном периоде развития. Агглютинины появляются позже, и титр их в сыворотке крови у детей первых недель после рождения очень низок. В зависимости от наличия или отсутствия в эритроцитах агглютиногенов А и В различают четыре группы крови: группу I, или 0 (α, β); группу II, или А (α); группу III, или В (β); группу IV, или АВ (в скобках указаны агглютинины). В сыворотке IV группы агглютининов α и β нет.
Дополнительно:
Группы крови обнаружили в 1901—1907 гг. австрийский ученый К. Ландштейнер и чешский врач Я. Янский при смешивании крови различных людей и наблюдении склеивания (агглютинации) эритроцитов. Они установили в эритроцитах людей наличие особых антигенов — аг-глютиногенов и предположили существование в сыворотке крови соответствующих им антител — агглютининов. Групповую принадлежность крови обусловливают изоантигены. Главными носителями антигенных свойств являются эритроциты. У человека описано около 200 эритроцитарных изоантигенов. Они объединяются в групповые антигенные системы, в частности ABO, Rh-hr и др. Изоантигены передаются по наследству, постоянны в течение всей жизни. Как известно, в результате взаимодействия антигена с антителом происходит склеивание антигенных частиц; то же самое наблюдается и с эритроцитами. Нормальные антитела (альфа(a)- и бетта(b)-агглютинины системы АВО) находятся в сыворотке крови людей и не связаны с иммунными антигенами. Имеется несколько систем групп крови.
Система АВО. Деление людей по группам крови в системе АВО основано на содержании у них различных комбинаций агглютиногенов и агглютининов. Известно четыре основные группы крови системы АВО: Оab (I), Аb (II), Ва (III), АВО (IV). Антигены (агглютиногены) А и В — полисахариды, находятся в мембране эритроцитов и связаны с белками и липидами. В эритроцитах может содержаться также антиген О, но его антигенные свойства выражены слабо и в крови нет одноименных ему агглютининов. В эритроцитах обнаружены разновидности агглютиногенов А и В: А1-7 и В1-6, различающиеся по антигенным свойствам.
Антитела (агглютинины) а и b находятся в плазме крови. Обнаружены а1- и а2-агглютинины (экстраагглютинин). Врожденные одноименные агглютиногены и агглютинины в крови одного и того же человека не встречаются, но могут находиться иммунные анти-А- и анти-В-антитела. Если в эксперименте в пробирке смешать кровь с одноименными агглютиногенами и агглютининами, то произойдет реакция агглютинации (склеивание эритроцитов), в результате чего они разрушаются (гемолиз). Подобная реакция может произойти и у пациента в случае ошибки врача при переливании крови, что чревато летальным исходом!
Особенностью крови системы АВО является наличие врожденных агглютининов. Все другие системы крови не содержат врожденных агглютининов.
Система резус (Rh-hr) была открыта в 1941 г. К. Ландштейнером и А. Винером при иммунизации кроликов кровью обезьяны макака-резус.
Антигены системы резус (Rh) — липопротеиды, известно шесть разновидностей антигенов этой системы, и наиболее важными из них являются: Rho (D), rh' (С) и rh" (E), самый сильный из которых — Rho (D). Он имеется в эритроцитах 85 % людей (резус-положительная кровь, Rh+). У остальных 15 % людей антиген Rho (D) отсутству-
ет (резус-отрицательная кровь, Rh-). Однако у лиц, являющихся донорами, резус-принадлежность оценивают по трем антигенам: Rho (D), rh' (С) и rh" (Е) — при наличии хотя бы одного из них кровь считается (Rh+).
Антирезус-а гглютинины могут сформироваться только при попадании резус-отрицательному человеку резус-положительной крови (переливание крови, беременность). В этом случае при повторном переливании резус-отрицательному человеку (реципиенту) резус-положительной крови может произойти агглютинация, так как у реципиента уже выработаются иммунные антирезус-антитела.
Беременность и Rh-фактор. Если мать резус-отрицательна, а отец резус-положителен, то плод может быть резус-положительным. В конце беременности, особенно при нарушении гемато-плацентарного барьера, небольшое количество крови плода (0,1—0,2 мл) может проникать в кровь матери. В ответ в ее организме начинают вырабатываться антирезус-агглютинины. Первая беременность проходит сравнительно спокойно. При повторной беременности титр антирезус-антител у матери нарастает, они проникают в кровь плода (их размеры малы) и происходит агглютинация и гемолиз эритроцитов плода (гемолитическая желтуха) — в тяжелых случаях с летальным исходом. Резус-положительная кровь плода может попасть в кровь резус-отрицательной матери и во время родов. В этом случае опасность возникает для второй беременности, так как у женщины в крови заранее будут Rh-антитела.
Имеются и другие антигенные системы, наибольшее значение из которых имеют Келл-Челлано, Даффи и Кидд. Все они, как и Rh-hr, не имеют врожденных антител, но могут появиться иммунные антитела. Правила переливании крови: 1) необходимо переливать только одногруппную кровь по антигенной системе АВО, чтобы предупредить встречу одноименных аг-глютиногенов и агглютининов', 2) нельзя переливать резус-положительную (Rh+) кровь резус-отрицательному (Rh-) реципиенту, так как при повторном переливании крови может развиться гемагглю-тинация. Если же резус-отрицательной женщине будет перелита Rh+-кровь, то вынашивание плода окажется под вопросом и при первой беременности! Перед переливанием крови необходимо: 1) определить группу крови донора и реципиента по системе АВО и Rh-факто-ру; 2) провести пробу на совместимость (плазма реципиента + кровь донора), а также биологическую пробу (реципиенту вводят по 5—10 мл донорской крови 3 раза с 3-минутными интервалами), если не возникает осложнений, вводят всю порцию крови.
По жизненным показаниям допускается переливание небольшого количества крови I (0) группы, не содержащей групповых агглютиногенов, реципиентам других групп. В исключительных случаях реципиентам группы IV (АВ), не имеющей групповых агглютининов, допускается переливание крови другой группы. Однако количество переливаемой крови в обоих случаях должно быть не более 0,1 ОЦК.
Детям можно переливать только одногруппную кровь!
№9Тканевая жидкость, жидкость, содержащаяся в межклеточных и околоклеточных пространствах тканей и органов животных и человека. Т. ж. соприкасается со всеми тканевыми элементами и является наряду с кровью и лимфой внутренней средой организма. Из Т. ж. клетки поглощают необходимые питательные вещества и выводят в неё продукты обмена. Химический состав, физические и биологические свойства Т. ж. специфичны для отдельных органов и соответствуют их морфологическим и функциональным особенностям. Т. ж. близка к плазме крови, но содержит меньше белка (около 1,5 г на 100 мл), другое количество электролитов, ферментов, продуктов обмена (метаболитов). Состав и свойства Т. ж. отличаются определённым постоянством (см. гомеостаз), что предохраняет клетки органов и тканей от воздействий, связанных с изменениями состава крови. Проникновение в Т. ж. из крови веществ, необходимых для питания тканей, и удаление из неё метаболитов осуществляются через гисто-гематические барьеры. Оттекая от органов в лимфатические сосуды, Т. ж. превращается в лимфу. Объём Т. ж. у кролика равен 23—25% массы тела, у человека — 23—29% (в среднем 26,5%). К Т. ж. многие авторы относят спинномозговую жидкость, жидкость передней камеры глаза, сердечной сумки, плевральной полости и др. Тканевая жидкость состоит из воды, аминокислот, сахаров, жирных кислот, коферментов, гормонов, нейромедиаторов, солей, а также отходов жизнедеятельности клеток.
Химический состав тканевой жидкости зависит от обмена веществ между клетками тканей и кровью. Это значит, что тканевая жидкость имеет различный состав в различных тканях.
Не все составляющие крови переходят в ткань. Эритроциты, тромбоциты и белки плазмы не могут пройти через стенки капилляров. Получившаяся смесь проходит через них, в основном, является плазмой крови без белков. Тканевая жидкость также содержит несколько типов лейкоцитов, которые выполняют защитную функцию.
Лимфа считается внеклеточной жидкостью, до тех пор пока она не войдёт в лимфатические сосуды, где он становится лимфой. Лимфатическая система возвращает белки и лишняя тканевая жидкость возвращается в кровоток. Содержание ионов в тканевой жидкости и плазме крови различны в межклеточной жидкости и плазме крови из-за эффекта Гиббса-Доннана. Это вызывает небольшую разницу в концентрации катионов и анионов между ними.
В состав лимфы входят клеточные элементы, белки, липиды, низкомолекулярные органические соединения (аминокислоты, глюкоза, глицерин),электролиты. Клеточный состав лимфы представлен в основном лимфоцитами. В лимфе грудного протока их число достигает 8 • 109/л. Эритроциты влимфе в норме встречаются в ограниченном количестве, но их число значительно возрастает при травмах тканей; тромбоциты в норме не определяются. Макрофаги и моноциты встречаются редко. Гранулоциты могут проникать в лимфу из очагов инфекции. Ионный состав лимфы не отличается отионного состава плазмы крови и интерстициальной жидкости. В то же
время по содержанию и составу белков и липидов лимфа значительно отличается от плазмы крови. В лимфе человека содержание белков составляет всреднем 2—3 %. Концентрация белков в лимфе зависит от скорости ее образования: увеличение поступления жидкости в организм вызывает ростобъема образующейся лимфы и уменьшает концентрацию белков в ней.
В лимфе в небольшом количестве содержатся все факторы свертывания, антитела и различные ферменты, имеющиеся в плазме. Холестерин и фосфолипиды находятся в лимфе в виде липопротеинов. Содержание свободных жиров, которые находятся в лимфе в виде хиломикронов, зависит от количества жиров, поступивших в лимфу из кишечника. После приема пищи в
лимфе грудного протока содержится большое количество липопротеинов и липидов, всосавшихся в желудочно-кишечном тракте. Между приемами пищи содержание липидов в грудном протоке минимально.
Функции лимфатической системы
Наиболее важной функцией лимфатической системы является возврат белков, электролитов и воды из интерстициального пространства в кровь. За сутки в составе лимфы в кровоток возвращается более 100 г низкомолекулярного белка, профильтровавшегося из кровеносных капилляров в интерстициальное пространство. Через лимфатическую систему переносятся многие продукты, всасывающиеся в желудочно-кишечном тракте, и прежде всего жиры. Некоторые
крупномолекулярные вещества поступают в кровь исключительно по системе лимфатических сосудов. Лимфатическая система действует как транспортная система по удалению эритроцитов, оставшихся в ткани после кровотечения, а также по удалению и обезвреживанию бактерий, попавших в ткани. В реализации этой функции активную роль играют лимфатические узлы, расположенные по ходу сосудов, которые продуцируют
лимфоциты и другие важнейшие факторы иммунитета. При возникновении инфекции в каких-либо частях тела региональные лимфатические узлы воспаляются в результате задержки в них бактерий или токсинов. В синусах лимфатических узлов, расположенных в корковом и мозговом
слоях, содержится эффективная фильтрационная система, которая позволяет практически стерилизовать поступающую в лимфатические узлы инфицированную лимфу.
Цереброспинальная жидкость (син.: ликвор, спинномозговая жидкость) — прозрачная бесцветная жидкость, заполняющая полости желудочков мозга, субарахноидальное пространство головного мозга и спинномозговой канал, периваскулярные и перицеллюлярные пространства в ткани мозга. Она выполняет питательные функции, определяет величину внутримозгового давления. Состав ЦСЖ формируется в процессе обмена веществ между мозгом, кровью и тканевой жидкостью, включая все компоненты ткани мозга. В ЦСЖ содержится ряд биологически активных соединений:гормоны гипофиза и гипоталамуса, ГАМК, АХ, норадреналин, дофамин,
серотонин, мелатонин, продукты их метаболизма. Среди клеток ЦСЖ преобладают лимфоциты (более 60 % от общего числа клеток) — в норме в 2 мкл спинномозговой жидкости содержится
3 клетки. Химический состав ЦСЖ очень близок к плазме крови: 89—90 % воды, 10—11 % сухого остатка, содержащего органические и неорганические вещества, участвующие в метаболизме мозговой ткани. Общий белок ЦСЖ содержит до 30 различных фракций; основную часть его формируют миелин и образующиеся при его распаде промежуточные продукты, гли110
копептиды, липопротеины, полиамины, белок S-100. ЦСЖ содержит лизоцим, ферменты (кислая и щелочная фосфатазы, рибонуклеазы, лактатдегидрогеназа, ацетилхолинэстераза, пептидазы и др.).
В клинической практике важную диагностическую значимость имеет белковый коэффициент Кафки ЦСЖ — отношение количества глобулинов к альбуминам (в норме составляет 0,2—0,3).
Физиологическое значение спинномозговой жидкости многообразно. Роль цереброспинальной жидкости в поддержании нормальной деятельности ЦНС очень значительна.
Прежде всего, спинномозговая жидкость предохраняет головной и спинной мозг от механических воздействий при толчках и сотрясениях, т.е. является своего рода "гидравлической подушкой мозга". Головной мозг как бы плавает в этой жидкости (таким образом, его вес уменьшается с 1500 г до менее 100 г), уменьшая истинный его вес и предохраняя мозговые ткани от повреждений о кости черепа.
За счёт соответствующих перемещений жидкость компенсирует колебания объёма мозга в разные фазы сокращений сердца.
Вместе с тем она является и внутренней средой, которая регулирует процессы всасывания питательных веществ нервными клетками и поддерживает осмотическое и онкотическое равновесие на тканевом уровне.
Кроме того, она служит своеобразной "канализацией", по которой продукты метаболизма головного мозга, такие как СО2, соли молочной кислоты, NH3, ионы водорода, переходят в кровеносное русло, и средой, по которой различные вещества распределяются по нервной системе.
Посредством спинномозговой жидкости осуществляется тканевой обмен в центральной нервной системе, обеспечивается постоянство внутренней среды центральной нервной системы вне зависимости от колебаний в составе крови.
Ткани, разграничивающие кровь и ликвор, выполняют барьерную функцию. Этот гематоэнцефалический барьер (ГЭБ), обеспечивает бесперебойное поступление из крови в спинномозговую жидкость необходимых ингредиентов и задерживает вредные вещества.
Цереброспинальная жидкость участвует в питании клеток мозга, в создании осмотического равновесия в тканях мозга и в регуляции обмена веществ в мозговых структурах. По ликвору переносятся различные регуляторные молекулы, изменяющие функциональную активность разных отделов ЦНС.
Поддерживает определенную концентрацию катионов, анионов и рН, что обеспечивает нормальную возбудимость ЦНС (например, изменения концентрации Са, К, магния изменяют кровяное давление, скорость сердечных сокращений).
спинномозговая жидкость ликвор циркуляция
Спинномозговая жидкость обладает также защитными свойствами (бактерицидными), в ней накапливаются антитела, выполняя роль защитного иммунологического барьера.
Она принимает участие в механизмах регуляции кровообращения в замкнутом пространстве полости черепа и позвоночного канала.
Обеспечивает поддержание постоянного внутричерепного давления и водно-электролитного гомеостаза, поддерживает трофические и обменные процессы между кровью и мозгом, транспортирует биологически активные вещества от одного мозгового поля к другому (например, тиреотропного и лютеинизирующего рилизинг факторов).
Таким образом, по своим особенностям спинномозговая жидкость является не только механическим защитным приспособлением для мозга и лежащих на его основании сосудов, но и специальной внутренней средой, которая необходима для правильного функционирования центральных органов нервной системы.
Благодаря беспрерывному смешиванию крови и лимфы спинномозговая жидкость с помощью каких-то механизмов и неизвестных физико-химических реакций, можно сказать, таинственных, строго охраняет свою структуру. Все бесчисленные функции мозга зависят от целостности и полноты трех потоков и от состава крови, лимфы и спинномозговой жидкости (ликвора).
№10 Сердечно-сосудистая система человека состоит из сердца, кровеносных сосудов, по которым циркулирует кровь, и лимфатической системы, в которой течет лимфа. Функцией сердечно-сосудистой системы является снабжение органов и тканей кислородом, питательными веществами, а также удаление из органов и тканей продуктов их жизнедеятельности и двуокиси углерода. Кровообращение обеспечивает все процессы метаболизма в организме человека и поэтому является компонентом различных функциональных систем, определяющих гомеостаз. Выполняя одну из главных функций – транспортную – сердечно-сосудистая система обеспечивает ритмичное течение физиологических и биохимических процессов в организме человека. К тканям и органам по кровеносным сосудам доставляются все необходимые вещества (белки, углеводы, кислород, витамины, минеральные соли) и отводятся продукты обмена веществ и углекислый газ. Сердечно-сосудистая система выполняет регуляторную и защитную функции и в содружестве с нервной и гуморальной системами играет важную роль в обеспечении целостности организма. Сосудистая система делится на кровеносную и лимфатическую. Эти системы анатомически и функционально тесно связаны, дополняют друг друга. Кровеносная система состоит из центрального органа кровообращения – сердца, ритмические сокращения которого дают движение крови по сосудам, и самих сосудов. Лимфатическая система состоит из лимфатических сосудов, узлов и протоков.
№11 целом движение крови по сосудам с некоторыми поправками подчиняется законам гидродинамики. Движение крови по сосудам получило название гемодинамики. Согласно общим законам гемодинамики сопротивление току крови по сосудам зависит от длины сосудов, их диаметра и вязкости крови:
Объемная скорость зависит от диаметра сосудов. Наиболее большая объемная скорость кровотока в аорте, наименьшая в капилляре. Однако, объемная скорость кровотока во всех капиллярах системного круга кровообращения равна объемной скорости кровотока в аорте, т.е. количество крови, протекающей за единицу времени через разные участки сосудистого русла, одинаково.
Кроме объемной скорости кровотока, важным показателем гемодинамики является линейная скорость кровотока. Линейная скорость кровотока – это расстояние, которое частица крови проходит за единицу времени в том или ином сосуде. Линейная скорость кровотока прямо пропорциональна объемной скорости и обратно пропорциональна диаметру сосуда.
Функции сердечно-сосудистой системы
Главной функцией является обеспечение движения крови по всему организму — при отсутствии движения кровь не может выполнять транспортную функцию. Обмен веществ между кровью и тканями происходит только в капиллярах, суммарная площадь которых огромна — достигает 1000 м2. Сердечно-сосудистая система является интегрирующей системой в организме.
В стенках сердца и сосудов вырабатываются многие БАВ, например атриопептид — натрийуретический гормон, гепарин, гистамин, серотонин, эндотелии — сосудосуживающее вещество, антитела, факторы свертывания крови.
Кровь циркулирует по кругу в результате циклической деятельности сердца и нагнетания ее (крови) в артериальную систему.
Цикл сердечной деятельности
Цикл сердечной деятельности включает систолу (греч. systole — сокращение) предсердий, систолу желудочков и общую паузу сердца. Общая пауза — это часть сердечного цикла, когда совпадают по времени диастола (греч. dyastole — расширение) желудочков с диастолой предсердий.
Структура цикла сердечной деятельности
Систола предсердий —0,1с.
Систола желудочков —0,33с, она включает:
• период изгнания крови — 0,25 с (фаза быстрого изгнания — 0,12 с и фаза медленного изгнания — 0,13 с);
• период напряжения — 0,08 с (фаза асинхронного сокращения — 0,05 с и фаза изометрического сокращения — 0,03 с).
Общая пауза сердца —0,37с, которая включает:
• период расслабления желудочков — 0,12 с (протодиастола — 0,04 с и фаза изометрического расслабления — 0,08 с);
• период наполнения желудочков кровью — 0,25 с (фаза быстрого наполнения — 0,08 с и фаза медленного наполнения — 0,17 с).
Весь цикл сердечной деятельности при частоте сокращений 75 в 1 мин длится 0,8 с Систола предсердий начинается после общей паузы сердца и обеспечивает дополнительную подачу крови в желудочки (примерно 1/5 от конечно-диасто-лического объема). Значение систолы предсердий заключается еще и в том, что возникающее при этом давление в желудочках обеспечивает дополнительное растяжение миокарда желудочков и последующее усиление их сокращений во время систолы.
К началу систолы предсердий вся мускулатура предсердий и желудочков расслаблена. Открыты атриовентри-кулярные клапаны, они провисают в желудочки, расслаблены сфинктеры, представляющие собой кольцевую мускулатуру в области впадения вен в предсердия и выполняющие функцию клапанов. Поскольку весь рабочий миокард расслаблен, давление в полостях сердца равно нулю. Из-за градиента давления в полостях сердца и в артериальной системе полулунные клапаны закрыты. Возбуждение предсердий начинается в области впадения полых вен, поэтому одновременно с сокращением рабочего миокарда предсердий сокращается мускулатура сфинктеров в области устьев впадающих в сердце вен: они закрываются, давление в предсердиях начинает
расти, и дополнительная порция крови поступает в желудочки. Поскольку сфинктеры закрыты, во время систолы предсердий кровь из них обратно в полые вены не возвращается.
К концу систолы предсердий давление в левом предсердии возрастает до 10—12 мм рт. ст., в правом — до 4— 8 мм рт. ст. Такое же давление к концу систолы предсердий создается и в желудочках. Вслед за систолой предсердий происходит их диастола, которая длится 0,7 с. Предсердия при этом наполняются кровью (резервуарная функция предсердий). Через 0,007 с (интерсистолический интервал) после окончания систолы предсердий начинается систола желудочков.
Систола желудочков обеспечивает выброс крови в артериальную систему.
Период напряжения. Фазу асинхронного сокращения обеспечивает неодновременное возбуждение мышечных волокон сократительного миокарда желудочков. Сокращение начинается с волокон, ближайших к проводящей системе сердца (перегородки, сосочковых мышц, верхушки желудочков). К концу этой фазы в сокращение вовлечены все мышечные волокна, поэтому давление в желудочках начинает быстро повышать ся, вследствие чего закрываются атрио-вентрикулярные клапаны и начинается фаза изометрического сокращения. Сокращающиеся вместе с желудочками сосочковые мышцы натягивают сухожильные нити и препятствуют выворачиванию клапанов в предсердия. Кроме того, эластичность и растяжимость сухожильных нитей смягчают удар крови об атриовентрикулярные клапаны, что обеспечивает долговечность их работы. Во время фазы изометрического сокращения давление в желудочках быстро нарастает. Как только давление в левом желудочке окажется больше диастоличе-ского давления в аорте (70-80 мм рт. ст.), а в правом желудочке — больше диасто-лического давления в легочной артерии (10-12 мм рт. ст.), открываются соответствующие полулунные клапаны — начинается период изгнания.
Период изгнания. В фазу быстрого изгнания давление в левом желудочке достигает 120—130 мм рт. ст., в правом — 25—30 мм рт. ст. В фазу медленного изгнания давление в желудочках начинает падать. Оба желудочка сокращаются одновременно, причем волна их сокращения возникает в верхушке сердца и распространяется вверх, выталкивая кровь из желудочков в аорту и легочный ствол. В период изгнания длина мышечных волокон и объем желудочков уменьшаются, атриовентрикулярные клапаны закрыты, так как в желудочках давление высокое, а в предсердиях оно равно нулю. Полулунные клапаны открыты, предсердные сфинктеры также открыты, потому что весь миокард предсердий расслаблен, кровь заполняет предсердия. Вслед за фазой изгнания начинается диастола желудочков, с которой частично совпадает и диастола предсердий, поэтому данный
период сердечной деятельности следует именовать общей паузой сердца.
Общая пауза сердца начинается с протодиастолы. Она продолжается от начала расслабления мышц желудочков до закрытия полулунных клапанов. Давление в желудочках становится несколько ниже, чем в аорте и легочной артерии, поэтому полулунные клапаны закрываются. В фазу изометрического расслабления полулунные клапаны уже закрыты, а атриовентрикулярные — еще не открыты. Поскольку расслабление желудочков продолжается, давление в них падает, что приводит к открытию атриовентрикуляр-ных клапанов массой крови, накопившейся во время диастолы в предсердиях. Начинается период наполнения желудочков, которое обеспечивается несколькими факторами, при этом взаимодействие их ускоряет расширение желудочков.
Важную роль в расслаблении желудочков и расширении их камер играет потенциальная энергия сил упругости сердца. Дело в том, что во время систолы сердца сжимаются его соединительнотканный упругий каркас и три слоя мышечных волокон, которые имеют различное направление в разных слоях. Желудочек в этом отношении можно сравнить с резиновой грушей, которая принимает прежнюю форму после того, как на нее надавили.
Расправлению желудочков способствуют: 1) скопившаяся в предсердиях кровь, которая сразу проваливается в полости желудочков; 2) кровь, выталкиваемая предсердиями во время их систолы; 3) давление крови в коронарных артериях, которая в это время начинает усиленно поступать из аорты в толщу миокарда («гидравлический каркас сердца»), по скольку миокард расслаблен, сосуды не сдавлены.
Значение диастолы предсердий и желудочков. Обеспечивает отдых сердцу, наполнение его камер кровью, миокард интенсивно снабжается кровью (получает кислород и питательные вещества). Это весьма важно, так как во время систолы коронарные сосуды левого желудочка сжимаются сокращающимися мышцами, при этом кровоток в коронарных сосудах резко снижается (на 85 %). В миокарде предсердий и правом желудочке кровоток постоянный (более слабое сокращение их миокарда, низкое давление в полостях).
Количество крови, выбрасываемой желудочком сердца в 1 мин, является одним из важнейших показатёлей функционального состояния сердца и называется минутным объемом крови (МОК). Он одинаков для правого илевого желудочков. Когда человек находится в состоянии покоя, МОК составляет в среднем 4,5—5,0 л. Разделив минутный объем на число сокращений сердца в 1 мин, можно вычислить систолический объем крови. При ритме сердечных сокращений 70—75 уд/мин систолический объем равен 65-70 мл крови. Следует заметить, что в покое в систолу из желудочков изгоняется примерно половина находящейся в них крови. Оставшаяся в жeлудочках кровь составляет конечный систолический объем, являющийся резервом, который может быть мобилизован при необходимости.быстрого и значительного увеличения сердечного выброса.
Принято также рассчитывать величину сердечного индекса, представляющего собой отношение МОК в Л/MИН K поверхности тела. Средняя величина этого показателя для «стандартного» мужчины равна 3 л/мин*M2. Минутный и систолический объем крови и сердечный индекс объединяются общим понятием — сердечный выброс. Наиболее точный способ одределения МОК у человека предложен Фиком (1870). МОК вычисляют, зная разницу между содержанием кислорода в артериальной и венозной крови и объем кислорода, потребляемого человеком в минуту.
Допустим, что в 1 мин через легкие в кровь поступило 400 мл кислорода и содержание кислорода в артериальной крови на 8 об.% больше, чем в венозной. Это означает, что каждые 100 мл крови поглощают в легких 8 мл кислорода. Следовательно, чтобы усвоить все количество кислорода, который поступил через легкие в кровь за минуту (в нашем примере 400 мл), необходимо, чтобы через легкие прошло 100*400/=5л
Это количество крови и составляет МОК.
№12 Сердечная мышца, как и всякая другая мышца, обладает рядом физиологических свойств: возбудимостью, проводимостью, сократимостью, рефрактерностью и автоматией.
Возбудимость — это способность кардиомиоцитов и всей сердечной мышцы возбуждается при действии на нее механических, химических, электрических и других раздражителей, что находит свое применение в случаях внезапной остановки сердца. Особенностью возбудимости сердечной мышцы является то, что она подчиняется закону "все — или ничего”. Это значит, что на слабый, допороговой силы раздражитель сердечная мышца не отвечает, (т.е. не возбуждается и не сокращается) ("ничего”), а на раздражитель пороговой, достаточной для возбуждения силы сердечная мышца реагирует своим максимальным сокращением ("все”) и при дальнейшем увеличении силы раздражения ответная реакция со стороны сердца не изменяется. Это связано с особенностями строения миокарда и быстрым распространением по нему возбуждения через вставочные диски — нексусы и анастомозы мышечных волокон. Таким образом, сила сердечных сокращений в отличие от скелетных мышц не зависит от силы раздражения. Однако этот закон, открытый Боудичем, в значительной степени условен, так как на проявление данного феномена влияют определенные условия — температура, степень утомления, растяжимость мышц и ряд других факторов.
Стоит добавить, что он применим только по отношению к действию на сердце искусственного раздражителя. Боудич в эксперименте с вырезанной полоской миокарда обнаружил, что если ее ритмически раздражать электрическими импульсами одинаковой силы, то на каждое последующее раздражение мышца ответит большим сокращением до ее максимальной величины. Это явление получило название "лестницы Боудича”.
Проводимость — это способность сердца проводить возбуждение. Скорость проведения возбуждения в рабочем миокарде разных отделов сердца неодинакова. По миокарду предсердий возбуждение распространяется со скоростью 0,8— 1 м/с, по миокарду желудочков— 0,8 —0,9 м/с. В атриовентрикулярной области на участке длиной и шириной в 1 мм проведение возбуждения замедляется до 0,02— 0,05 м/с, что почти в 20 —50 раз медленнее, чем в предсердиях. В результате этой задержки возбуждение желудочков начинается на 0,12—0,18 с позже начала возбуждения предсердий. Существует несколько гипотез, объясняющих механизм атриовентрикулярной задержки, но этот вопрос требует своего дальнейшего изучения. Однако эта задержка имеет большой биологический смысл — она обеспечивает согласованную работу предсердий и желудочков.
Рефрактерность — состояние невозбудимости сердечной мышцы. Степень возбудимости сердечной мышцы в процессе сердечного цикла меняется. Во время возбуждения она теряет способность реагировать на новый импульс раздражения. Такое состояние полной невозбудимости сердечной мышцы называется абсолютной рефрактерностью и занимает практически все время систолы. По окончании абсолютной рефрактерности к началу диастолы возбудимость постепенно возвращается к норме — относительная рефрактерность. В это время (в середине или в конце диастолы) сердечная мышца способна отвечать на более сильное раздражение внеочередным сокращением — экстрасистолой. За желудочковой экстрасистолой, когда внеочередной импульс зарождается в атриовентрикулярном узле, наступает удлиненная (компенсаторная) пауза.
Она возникает в результате того, что очередной импульс, который идет от синусного узла, поступает к желудочкам во время их абсолютной рефрактерности, вызванной экстрасистолой и этот импульс или одно сокращение сердца выпадает. После компенсаторной паузы восстанавливается нормальный ритм сокращений сердца. Если дополнительный импульс возникает в синоатриальном узле, то происходит внеочередной сердечный цикл, но без компенсаторной паузы. Пауза в этих случаях будет даже короче обычной. За периодом относительной рефрактерности наступает состояние повышенной возбудимости сердечной мышцы (экзальтационный период) когда мышца возбуждается и на слабый раздражитель. Период рефрактерности сердечной мышцы продолжается более длительное время, чем в скелетных мышцах, поэтому сердечная мышца не способна к длительному титаническому сокращению.
Иногда отмечаются патологические режимы распространения возбуждения, при которых предсердия и желудочки возбуждаются самопроизвольно с высокой частотой и сокращаются неодновременно. Если эти возбуждения периодичны, то такую аритмию называют трепетанием, если они неритмичны —мерцанием. Как трепетание, так и мерцание желудочков вызывает наибольшую опасность для жизни.
Сократимость. Сократимость сердечной мышцы имеет свои особенности. Сила сердечных сокращений зависит от исходной длины мышечных волокон (закон Франка–Старлинга). Чем больше притекает к сердцу крови, тем более будут растянуты его волокна и тем большая будет сила сердечных сокращений. Это имеет большое приспособительное значение, обеспечивающее более полное опорожнение полостей сердца от крови, что поддерживает равновесие количества притекающей к сердцу, и оттекающей от него крови. Здоровое сердце уже при небольшом растяжении отвечает усиленным сокращением, в то время как слабое сердце даже при значительном растяжении лишь немного увеличивает силу своего сокращения, а отток крови осуществляется за счет учащения ритма сокращений сердца. Кроме того, если по каким–либо причинам произошло чрезмерное сверх физиолочески допустимых границ растяжение сердечных волокон, то сила последующих сокращений уже не увеличивается, а ослабляется.
Сила и частота сердечных сокращений меняется и под действием различных нервно–гуморальных факторов без изменения длины мышечных волокон.
Особенностями сократительной деятельности миокарда является то, что для поддержания этой способности необходим кальций. В безкальциевой среде сердце не сокращается. Поставщиком энергии для сокращений сердца являются макроэргические соединения (АТФ и КФ). В сердечной мышце энергия (в отличие от скелетных мышц) выделяется, главным образом, в аэробную фазу, поэтому механическая активность миокарда линейно связана со скоростью поглощения кислорода. При недостатке кислорода (гипоксемия) активируются анаэробные процессы энергетики, но они только частично компенсируют недостающую энергию. Недостаток кислорода отрицательно влияет и на содержание в миокарде АТФ и КФ.
В сердечной мышце, имеется так называемая атипическая ткань, образующаяпроводящую систему сердца (рис. 10.).
Эта ткань имеет более тонкие миофибриллы с меньшей поперечной исчерченностью. Атипические миоциты более богаты саркоплазмой. Ткань проводящей системы сердца более возбудима и обладает резко выраженной способностью к проведению возбуждения. В некоторых местах миоциты этой ткани образуют скопления или узлы. Первый узел располагается под эпикардом в стенке правого предсердия, вблизи впадения полых вен.
Второй узел располагается под эпикардом стенки правого предсердия в области атриовентрикулярной перегородки, разделяющей правое предсердие от желудочка, и называется предсердно-желудочковым (атриовентрикулярным) узлом. От него отходит пучок Гиса, разделяющийся на правую и левую ножки, которые по отдельности идут в соответствующие желудочки, где они распадаются на волокна Пуркинье. Проводящая система сердца имеет непосредственное отношение к автоматии сердца.
Автоматия сердца — это способность ритмически сокращаться под влиянием импульсов, зарождающихся в самом сердце без каких-либо раздражений. Автоматию сердца можно наблюдать на удаленном, и помещенном в раствор Рингера, сердце лягушки. Явление автоматии сердца было известно очень давно. Его наблюдали Аристотель, Гарвей, Леонардо Да Винчи.
Долгое время в объяснении природы автоматии существовало две теории — нейрогенная и миогенная. Представители первой теории считали, что в основе автоматии лежат нервные структуры сердца, а представители второй теории связывали автоматию со способностью к ней мышечных элементов.
Взгляды на автоматию получили новые направления в связи с открытием проводящей системы сердца. В настоящее время способность к автоматической генерации импульсов в настоящее время связывают с особыми Р-клетками, входящими в состав синоатриального узла. Многочисленными и разнообразными опытами (Станниус—методом наложения лигатур, Гаскел – ограниченным охлаждением и нагреванием разных участков сердца), затем исследованиями с регистрацией электрических потенциалов было доказано, что главным центром автоматии 1 порядка, датчиком, водителем (пейсмекером) ритма сердечных сокращений является синоатриальный узел, так как в Р–клетках этого узла отмечается наибольшая скорость диастолической деполяризации и генерации потенциала действия, связанного с изменением ионной проницаемости клеточных мембран.
По удалению от этого узла способность проводящей системы сердца к автоматии уменьшается (закон градиента убывающей автоматии, открытый Гаскеллом). Исходя из этого закона, атриовентрикулярный узел обладает меньшей способностью к автоматии (центр автоматии второго порядка), а остальная часть проводящей системы является центром автоматии третьего порядка.
В нормальных условиях функционирует только автоматия синоатриального узла, а автоматия других отделов подавлена более высокой частотой его возбуждений. Это было доказано Станниусом методом наложения лигатур на разные отделы сердца лягушки. Так, если у лягушки наложить первую лигатуру, отделив венозный синус от предсердий, то сокращения сердца временно прекратятся. Затем через некоторое время или сразу после наложения второй лигатуры на предсердно–желудочковый узел начнутся сокращения предсердий или желудочка (в зависимости от того, как ляжет лигатура и куда отойдет узел), но во всех случаях эти сокращения будут иметь более редкий ритм ввиду меньшей способности к автоматии атриовентрикулярного узла.
Таким образом, импульсы вызывающие сокращения сердца, первоначально зарождаются в синоатриальном узле. Возбуждение от него распространяется по предсердиям и доходит до атриовентрикулярного узла, далее через него по пучку Гиса к желудочкам. При этом возбуждение от синоатриального узла к атриовентрикулярному по предсердиям передается не радиально, как это представлялось раньше, а по наиболее благоприятному, предпочтительному пути, т.е. по клеткам очень сходным с клетками Пуркинье.
Волокна проводящей системы сердца своими многочисленными разветвлениями соединяются с волокнами рабочего миокарда. В области их контакта происходит задержка передачи возбуждения в 30 мс, что имеет определенное функциональное значение. Одиночный импульс, пришедший раньше других по отдельному волокну проводящей системы, может вообще не пройти на рабочий миокард, а при одновременном приходе нескольких импульсов они суммируются, что облегчает их переход на миокард.
Во
время сокращений в мышце сердца
наблюдаются фазовые изменения
возбудимости. На рис. 9 дано схематическое
изображение потенциала действия, фаз
возбудимости и сокращения. Сразу после
начала возбуждения (1) сердечная мышца
полностью теряет возбудимость (абсолютная
рефрактерная фаза). Вслед за этой фазой
возбудимость постепенно восстанавливается,
но все время остается ниже нормальной
- относительная рефрактерная фаза (2).
После относительной рефрактерной фазы
наступает кратковременная фаза повышенной
возбудимости мышцы сердца (3), а затем
ее возбудимость возвращается к исходному
уровню (4).
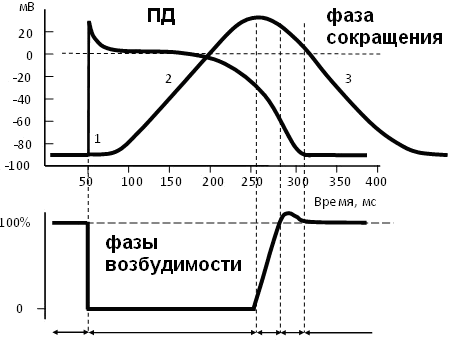 Рис.
9. Потенциал действия, фазы возбудимости
и сокращения сердечной мышцы
Благодаря
относительно большой продолжительности
абсолютной рефрактерной фазы, на частые
прерывистые раздражения сердце отвечает
ритмическими сокращениями и не переходит
в состояние тетануса - длительного
укорочения. Если нанести внеочередное
раздражение в период относительной
рефрактерной фазы, мышца сердца может
ответить внеочередными сокращениями,
которые принято называть экстрасистолой.
После экстрасистолы желудочка удлиняется
время его диастолы (компенсаторная
пауза) (рис. 10). Механизм возникновения
компенсаторной паузы следующий: очередной
импульс, зародившийся в синусном узле,
приходит в желудочек тогда, когда он
находится в абсолютной рефрактерной
фазе в результате экстрасистолы и
поэтому не отвечает на этот импульс. На
рис. 10 дана схема, поясняющая возникновение
экстрасистолы и компенсаторной
паузы.
Рис.
9. Потенциал действия, фазы возбудимости
и сокращения сердечной мышцы
Благодаря
относительно большой продолжительности
абсолютной рефрактерной фазы, на частые
прерывистые раздражения сердце отвечает
ритмическими сокращениями и не переходит
в состояние тетануса - длительного
укорочения. Если нанести внеочередное
раздражение в период относительной
рефрактерной фазы, мышца сердца может
ответить внеочередными сокращениями,
которые принято называть экстрасистолой.
После экстрасистолы желудочка удлиняется
время его диастолы (компенсаторная
пауза) (рис. 10). Механизм возникновения
компенсаторной паузы следующий: очередной
импульс, зародившийся в синусном узле,
приходит в желудочек тогда, когда он
находится в абсолютной рефрактерной
фазе в результате экстрасистолы и
поэтому не отвечает на этот импульс. На
рис. 10 дана схема, поясняющая возникновение
экстрасистолы и компенсаторной
паузы.
 Рис.
10. Экстрасистола и компенсаторная
пауза
1
– моменты нанесения электрического
раздражителя, 2 - моменты поступления
импульсов из синусового узла, 3 –
экстрасистола, 4 – компенсаторная пауза,
5 – выпавшее сокращение
Рис.
10. Экстрасистола и компенсаторная
пауза
1
– моменты нанесения электрического
раздражителя, 2 - моменты поступления
импульсов из синусового узла, 3 –
экстрасистола, 4 – компенсаторная пауза,
5 – выпавшее сокращение
Дополнительно: ПД клеток миокарда желудочков у человека при частоте сердцебиений
75 раз в 1 мин длится около 0,3 с. С момента возникновения ПД и до конца его плато (во время фаз 0, 1 и 2) мембрана клетки становится невосприимчивой к действию других раздражителей, т.е. находится в абсолютной -рефрактерности. Соотношения между потенциалом действия
клетки миокарда, сокращением мышцы желудочка и динамикой его возбудимости показаны на рис. 6.4. Различают период абсолютной рефрактерности (полная невозбудимость), который в миокарде человека продолжаётся 0,27 с; период относительной рефрактерности, во время которого сердечная мышца может ответить сокращением лищь на очень сильные раздражения (продолжается 0,03 с и соответствует фазе быстрой реполяризации ПД), и период супернормальной возбудимости когда сердечная мышца может отвечать сокращением на подпороговые раздражения. Сокращение (систола) миокарда.продолжается около 0,3 с, что по времени примерно совпадает с общей рефрактерностью, представляющей собой сумму абсолютной и относительной рефрактериости. Следовательно в периоде сокращения сердце неспособно реагировать на другие. раздражители. Наличие "длительной рефрактерной фазы препятствует развитию непрерывного укорочения (тетанус).сердечной мышцы, что привело бы к невозможности осуществления сердцем нагнетательной функции. Раздражение, нанесенное на миокард в период расслабления (диастола), когда его возбудимость частично или полностью восстановлена, вызывает внеочередное сокращение сердца — экстрасистолу. Если внеочередное возбуждение возникает в синусно-предсердном узле в тот момент, когда рефрактерный период закончился, но очередной автоматический импульс еще не появился, наступает раннее сокращение сердца — синусовая экстрасистола. Пауза, следующая за такой экстрасистолой, длится та¬
кое же время, как и обычная.
Внеочередное возбуждение, возникшее в миокарде желудочков, не отражается на автоматизме синусно-предсердного узла. Этот узел своевременно посылает очередной импульс, который достигает желудочков в тот момент, когда они еще находятся в рефрактерном состоянии после экстрасистолы, поэтому миокард желудочков не отвечает на очередной импульс, поступающий из предсердия. Затем рефрактерный период желудочков кончается и они опять могут ответить на раздражение, но проходит некоторое время, пока из синусно-предсердного узла придет следующий импульс. Таким образом, экстрасистола, вызванная возбуждением, возникшим в одном из желудочков (желудочковая экстрасистола), приводит к продолжительной, так называемой компенсаторной паузе желудочков при неизменном ритме работы предсердий.
У человека экстрасистолы могут появиться при наличии очагов раздражения в самом миокарде, в области предсердного или желудочковых водителей ритма. Экстрасистолы могут возникать в результате влияний, поступающих к сердцу из ЦНС. Наличие или отсутствие экстрасистол,
а также их характер определяются при регистрации электрокардиограммы
Предсердная экстрасистолия — это преждевременное возбуждение сердца под действием внеочередного импульса из предсердий.
Желудочковая экстрасистолия (ЖЭ) — это преждевременное возбуждение сердца, возникающее под влиянием импульсов, исходящих из различных участков проводящей системы желудочков.
№14(л) Если над проекцией клапанных створок или в ближайшей к аорты и легочной артерии области к груди приложить стетоскоп или микрофон фонокардиографа, то можно услышать звуки, которые сопровождают каждое сокращение сердца. Ухом можно различить 2 звуки (тона). Чувствительный прибор позволяет зафиксировать появление 4 тонов. Первый (систолическое) тон совпадает по времени с началом систолы желудочков. В его формировании участвуют С компоненты - клапанный, мышечный и сосудистый. Клапанный компонент обусловлен закрытием створок предсердно-желудочковых клапанов, вибрацией этих створок и сухожильных нитей, которые содержат эти створки, турбулентным движением крови, вибрацией стенки желудочков в фазу изометрического сокращения, а также колебанием начальных отделов аорты и легочного ствола в фазу быстрого выброса крови. Основным компонентом названного тона является клапанный. Он главным образом влияет на силу систолического тона. Так, при повышении интенсивности сокращения желудочков в связи с быстрым нарастанием давления тон становится громче. Это же наблюдается и в том случае, когда створки клапанов раскрыты шире при увеличении кровенаполнения желудочков. Продолжительность систолического тона составляет около 0,14 с. Второй (диастойичний) тон обусловлен ударом створок полумесячной клапанов друг о друга при их закрытии в начале диастолы, их вибрации, турбулентным движением крови, которая бьется об закрытые створки клапанов, вибрацией крупных артерий (аорты и легочного ствола). Его продолжительность - от 0,08 до 0,11 с. Третий тон возникает вследствие вибрации стенок желудочков в фазу быстрого заполнения их кровью, четвертый - при си-. столе предсердий и возврате части крови в предсердие, когда в начале систолы желудочков атриовентрикулярные клапаны еще открыты.
№15(опечатки в словах) саморегуляция деятельности сердца.
Внутриклеточная: заключается в способности кардиомиоцитов при выполнении ими специф сократ функции синтезировать различные белки в соответствии с уровнем их разрушения. Синтез белков происходит дифференцированно,этот процесс осущест-ся кардиомиоцитами во взаимодействии с соединительно тканными к-ми. Особенность кардиомиоцитов заключается в цикличности их обенных процессов, связанных с ритмом серд деят-ти. Наиболее быстрый распад атф и гликогена происходит в момент систолы. Ресинтез и восстановление уровня этих в-в успевает полностью осущет-ся за время диастолы. Поэтому в чс при усленной работе сердца одним из компенсаторных механизмов адаптирующих деят-сть сердца к воз-ям яв-ся удлинение диастолы. Кардиомиоциты способны избирательно адсорбироватьт из крови и накапливать в цитоплазме в-ва, поддерживающие и регулирующие их биоэнергетику, а также соед-ия, повышающие потребнотсь к-ок в кислороде. Последние имеют большое приспособительное значение, так как вызывают увеличение силы сокращения сердца. Так адсорбция из крови ан и норан обеспечивает усиление сердечного кровотока и следовательно боле сильное растяжение к-ок миокарда во время диастолы. Следовательно, чем больше крови притекло к сердцу, тем сильнее оно растянуто во время диастолы и тем интенсивнее его сокращение (закон Франка- Старлинга). Межклеточная: связана с наличием вставочных дисков-нексусов, обеспеч-их транспорт в-в, соед-ие миофибрилл, переход возб-ия с к-ки на к-ку. В случае выпадения функции нексусов нарушается одновременность прихода возб-ия к отдельным к-ам, синхронность сокращения, появ-ся нарушения ритма. Межклеточная регуляция, включает также взаимодей-ия кардиомиоцитов с соед-нотканными к-ми. Соед-нлтканные к-ки выполняют функцию мех опоры, яв-ся источником ВМС . Внутрисердечная: автономная регуляция,хотя входит в систему цн регуляции. Эта регуляция осущ-ся метасимпотической нс, нейроны которой находятся в интрамуральных ганглиях сердца. Метасимпот нс обладает полным набором функ-ых эл-ов: сенсорные к-ки, интегрирующий интернейронный аппарат, двигательные нейроны.на вставочных и моторных метасим нейронах синоптически оканчиваются преганглинарные волокна блуждающего нерва и симпотической системы. Интеркардиальный метасимп нервный аппарат регулирует ритм сердечных сокращений, скорость предсердно-желудочкового проведения, реполяризацию кардиомиоцитов, скорость диастолического расслабления ( велика роль при трансплонтации). При нагрузках на организм с транссердцем изменения такие же как в нормальных условиях. Метасимпот нс выполняет в организме защитную роль, поддерживая стабильность наполнения кровью артериальной системы. Экстракардиальная: обеспечивает спец супраспинальные и корковые механизмы,передающие свои влияния по волокнам блуждающих и симпотических нервов. Вагусные влияния: в продолговатом мозгу расп-ся парасимотическое ядро блуждающего нерва, аксоны к-ок этого ядра образуют синапсы на моторных метасимпотических нейронах интрамуральных ганглиев сердца. Волокна правого блужд нерва распределяются в правом предсердии-> связанные с ним метасимпотические нейроны иннервируют миокард, каронарные сосуды и синуснопредсердный узел. Волокна левого блужд нерва влияют на предсердножелудочковый узел-> стимуляция правого блужд нерва влияет на частоту серд сокращений, а левого на предсердножелудоч поведение. Стимуляция этих нервов уменьшает частоту сокращений сердца и ослабляет их силу. Сильное раздрожение переферического конца перерезанного блужд нерва или введение ах сопровождается замедлением серд ритма- отрицательный хронотропный эффект. Возникает уменьшение амплитуды сокращений- отрицательный инотропный эффект, понижается возбудимость серд мышцы- отриц батмотропный эффект, и уменьшается скорость проведения взбуждения в сердце- отриц дромотропный эффект. Сильное разд-ие блужд нерва- остановка сердца. Однако при длительном разд-ии сокращение сердца могут восстановится- ускользание из под влияния блужд нерва. Слабое разд-ие вагуса- как дейст-ие симпотических нервов, т.к в метасимп нейронах кроме холинэргических находятся адренергические рецепторы, обладающие более низким порогом возбуждения. При полном наполнении сердца- тормозные реакции вагуса, при слабом- стимулирующие реакции. Симпотические влияния: симпот нерв также влияет на все стороны серд функции, эти влияния проявляются в учащении сокращения сердца- положительный хронотропный эффект, усиление сокращений предсердий и желудочков- положительный ино тропный эффект, улучшение проведения возбуждения в сердце- положит дромотропный эффект, повышение возбудимости сердца- положит батмотропный эффект. Павлов среди симпотических ветвей обнаружил волокна которые вызывают избирательное увеличение силы серд сокращений- усиливающий нерв сердца. Этот нерв играет трофическую роль, оказывает влияние на проведение возбуждения в сердце. Эффекты раздражения симпотических волокн возникают более чем через 10 сек и продолжаются длительное время после окончания раздражения. Гуморальная регуляция: осуществляется через кровь: 1. Гармоны (ан, тироксин и тд),2. Ионы (К, Са, Nа) 3. Продукты метаболизма (молочная кислота, вода , СО2) 4. Температура крови. АН- положительный хроно- и инотропные эффекты, он соединяется с бетаадренорецепторами кардиомиоцитов-> активация цамф-> активация фосфарилазы-> расщепление гликогена до глюкозы-> энергия к миокарду. Глюкогон влияет также. Тироксин положит хронотропный эффект и увеличение чувствительности сердца к симпотическим воздействиям. Кортикостероиды, ангиотензины и серотонин положит инотроп эффект. К- отриц инотроп,хронотропный, батмотропный и дромотропный эффекты при увеличении К-> снижение потенциала покоя-> возбуждение, проведение и длительный потенциал действия. При больших концентрациях К- синусноатриальный узел прекращает работать=> остановка сердца в диастолу. При низких концентрациях К- увеличивается возбуждение=> нарушается ритм сокращения. Уменьшение избирательности Са приводит к положит инотропному эффекту, т.к Са активирует фосфарилазу. При избытке Са остановка сердца в систолу, т.к Са насос не успевает выкачить избытки кальция. Nа- при его избытке повышается потребность в кислороде, а если еще и повышается нагрев то каронарные сосуды не способны обеспечить миокард кислородом=> некаронарогенные инфаркты миокарда. Гипоталамус: влияет либо тока на ритм сердца, либо тока на силу сокращений или расслаблений миокарда левого желудочка. В нем существуют отдельные структуры регулирующие опред функции сердца.гипоталамус- интегративный центр, который может изменять параметры серд деят-ти для обеспечения текущих потребностей организма, однако осуществляемая им перестройка в деят-ти висцеральных органов зависит от сигналов поступающих из лимбической системы и коры головного мозга. Корковая регуляция: высшая ступеньт в регуляции деят-ти сердца. В коре есть активные области которые влияют на деят-ть сердца это отражения блуждающих нервов и его сердечных ветвей (моторная, премоторная зоны, орбитальная поверхность лобных долей, передняя часть височных долей). При нормальном функционировании организма кора способна тормозить или активировать работу сердца. Психология и эмоции влияют на сердце. Через условный рефлекс. Неврозы=> нарушение деят-сти сердца.
Механизм Франка-Старлинга Нам известно, что в разных ситуациях объем крови, который сердце перекачивает за минуту, почти полностью определяется венозным возвратом, т.е. объемом крови, поступающим в сердце из вен. Это можно объяснить следующим образом: кровоток каждого отдельного органа контролируется местными механизмами в зависимости от метаболических потребностей данного органа; кровь, оттекающая от отдельных органов, сливается в общую венозную систему и поступает к сердцу; сердце, в свою очередь, автоматически перекачивает всю поступившую к нему кровь в артериальное русло, снабжая периферические органы, и т.д. Способность сердца адаптироваться к увеличению объема поступающей к нему крови называют внутрисердечным механизмом Франка—Старлинга, названным в честь выдающихся физиологов прошлого века. Суть механизма в следующем: чем больше степень растяжения миокарда объемом притекающей крови, тем больше сила сокращения сердечной мышцы и, следовательно, тем больше объем крови, который сердце перекачивает в аорту. Другими словами, в физиологических пределах сердце перекачивает всю кровь, которая возвращается к нему по венам. Как объяснить механизм Франка-Старлинга? Когда избыточный объем крови поступает в желудочки, волокна сердечной мышцы растягиваются. Нити актина и миозина в миофибриллах занимают положение, близкое к оптимальному для развития большей силы сокращения. Таким образом, желудочки автоматически перекачивают избыточный объем крови в артерии. Способность мышечных волокон, растянутых до оптимальной длины, сокращаться с большей эффективностью характерна для всех поперечнополосатых мышц, а не только для миокарда. Усиление насосной функции сердца при увеличении венозного возврата происходит и по другой причине. Растяжение стенки правого предсердия приводит к увеличению частоты сердечных сокращений на 10-20%, что тоже вносит вклад в увеличение выброса крови из желудочков в артерии.
Дополнительно: В основе гемодинамической регуляции силы сердечных сокращений лежит закон Франка—Старлинга, установленный авторами на сердечно-легочном препарате. При сохранении у животного малого круга кровообращения большой круг кровообращения был замещен искусственной системой трубок. Это позволило, с одной стороны, изменяя давление в венозном резервуаре, увеличивать или уменьшать приток крови к правому предсердию, а с другой — определять изменения объема сердца и количества крови, поступающей в сердце и вытекающей из него. Установлено, что чем больше крови притекает к сердцу во время диастолы, тем сильнее растягиваются волокна сердечной мышцы и тем сильнее оно сокращается при следующей систоле. Механизм этого явления объясняют двумя причинами: сократительный кардиомиоцит состоит из двух элементов — собственно сократительного и эластического. Сократительный элемент в возбужденном состоянии способен сокращаться, а последовательно соединенный с ним эластический элемент действует как обычная пружина с нелинейной характеристикой. Однако сила сокращений возрастает только при средних величинах их растяжения; во время диастолы увеличивается площадь контакта между митохондриями и миофибриллами, вследствие чего возрастают интенсивность диффузии АТФ из митохондрий в миофибриллы и энергетическое обеспечение сократительного аппарата.
Следствия закона Старлинга
Следствиями закона Старлинга являются изменения параметров гемодинамики.
Следствие 1. При увеличении венозного давления при неизменном артериальном возрастает сила сердечных сокращений и увеличиваются СО и МОК.
Следствие 2. При увеличении артериального давления и неизменном венозном давлении возрастает сила сердечных сокращений (для преодоления возросшего сопротивления), но СО и МОК не меняются. Физиологической нагрузкой, растягивающей волокна сердечной мышцы, является количество крови, заполняющей полости сердца. Чем больше в сердце скапливается крови за время диастолы, тем сильнее растягиваются волокна сердечной мышцы и тем энергичнее они сокращаются при следующей систоле. Благодаря этому быстро устанавливается соответствие между притоком крови к сердцу и ее оттоком от него.
В соответствии с законом Старлинга осуществляется синхронное сокращение правой и левой половин сердца. Особое значение гемодинамическая регуляция приобретает при некоторых патологических состояниях сердца, в частности при недостаточности аортальных клапанов, когда часть крови из аорты возвращается в левый желудочек. Впоследствии, в фазу диастолы желудочков, в них поступает обычная порция крови в результате систолы предсердий. Это приводит к тому, что стенки желудочков растягиваются кровью больше, чем в норме, и, по закону Старлинга, за счет усиления следующего систолического сокращения количество крови, выброшенное в аорту, будет больше нормального. Однако возврат через дефект в клапанах некоторой порции крови приведет к тому, что практически в кровеносное русло попадет обычная порция крови, т.е. само сердце как бы компенсирует имеющийся дефект.
Закон Франка—Старлинга относителен, поскольку растяжение сердечных волокон ведет к усилению их последующего сокращения только при некоторых средних степенях растяжения. При растяжении сверх известного предела сила последующего сокращения уже не увеличивается, а, наоборот, ослабевает. В целом этот способ регуляции силы сокращения получил название гетерометрической регуляции сердца (т.е. с изменением длины кардиомиоцитов). Существуют также гомеометрические механизмы саморегуляции сердца (без изменения длины кардиомиоцитов). К ним относится феномен Анрепа: при повышении давления в аорте или легочном стволе сила сердечных сокращений автоматически возрастает, обеспечивая тем самым возможность выброса того же объема крови, что и при исходной величине артериального давления, т.е. чем больше противонагрузка, тем больше сила сокращений. Механизмы, лежащие в основе феномена Анрепа, до сих пор не раскрыты. Предполагают, что с увеличением противонагрузки растет концентрация Са2+ в межфибриллярном пространстве и поэтому возрастает сила сердечных сокращений. Другим проявлением гомеометрической регуляции является лестница Боудича. Раздражая электрическим током полоску сердца лягушки, утратившую способность к автоматизму, автор обнаружил, что каждое последующее сокращение в ответ на стимулы одной амплитуды выше по амплитуде предыдущего.
№16 Роль гуморальных веществ в регуляции деятельности сердца. Гормональные влияния. Тироксин увеличивает частоту и силу сердечных сокращений, чувствительность сердца к симпатическим воздействиям, увеличивает синтез белков в сердце, что ведет к его гипертрофии. Кортикоиды, ангиотензин, серотонин, адреналин, норадреналин, вазопрессин, эндотелии (пептид эндоте-лиоцитов), глюкагон, инсулин увеличивают силу сокращений сердца. Механизм действия разных гормонов на сердце различен. Однако многие из них свое воздействие реализуют посредством активации аденилатциклазы, которая находится на внутренней стороне клеточной мембраны. Аденилатциклаза ускоряет образование цАМФ из молекул АТФ. Под действием цАМФ происходит ряд биохимических превращений, увеличивается поступление Са2+ в клетки, захват его и освобождение СП Р.
Адреналин и норадреналин, циркулирующие в крови, также увеличивают вход Са2+ в клетку в момент развития ПД, вызывая тем самым усиление сердечных сокращений, но их роль невелика.
Действие кальция на сократимость сердца. Са2+ усиливает сердечные сокращения, потому что он улучшает электромеханическое сопряжение, активирует фосфорилазу, что способствует высвобождению энергии. Большие концентрации Са2+ вызывают настолько сильное сокращение сердца в эксперименте, что оно останавливается в систоле.
Влияние калия на сердечную деятельность зависит от его концентрации в крови. При снижении концентрации К+ вне клетки ниже нормы (4 ммоль/л) уменьшается его содержание и внутри клетки, вследствие чего уменьшается мембранный потенциал (частичная деполяризация). Это приводит главным образом к повышению активности пейсмекера, поскольку мембранный потенциал приближается к КП, при этом активизируются также гетеротопные очаги возбуждения, что может сопровождаться нарушениями сердечного ритма. Примерно такие же изменения в деятельности сердца наблюдаются и при небольшом увеличении (в 1,5—2 раза) концентрации К+ в окружающей среде. Увеличение же концентрации К+ вне клеток в 3—4 раза и более ведет к снижению возбудимости и проводимости кардиомиоцитов и даже к полной деполяризации клеток и остановке сердца, что используется в хирургической практике при операциях на сердце.
Считается, что увеличение концентрации К+ вне клеток в 1,5—2 раза ведет к снижению его градиента к уменьшению выхода К+ из клеток и к частичной деполяризации клеток, что приводит к повышению возбудимости кардиомиоцитов. При увеличении же концентра-
ции К+ в 3—4 раза и более наблюдается полная деполяризация кардиомиоцитов вследствие уменьшения градиента К+ или полного его отсутствия. Следует, однако, заметить, что добавляется электронейтральная среда (раствор соли КС1, чистый калий — это хрупкий металл и сгорает при контакте с водой).
Гипоксия и гиперкапния посредством активации центральных и периферических хеморецепторов возбуждают симпатическую нервную систему, что ведет к стимуляции деятельности сердца. Легкая степень гипоксии, действуя непосредственно на сердце, стимулирует его работу, значительная — угнетает, что обусловлено ограничением окислительных процессов. Решающим фактором, сопутствующим гипоксии и гиперкапнии и действующим непосредственно на сердце, является изменение рН внутри клеток сердца. Снижение рН в кардиомиоцитах (в норме рН 7,1) ослабляет силу сокращений сердца вследствие угнетения освобождения Са2+ из СПР и снижения чувствительности мио-филаментов к Са2+. Повышение температуры увеличивает, а понижение снижает чсс.
Дополнительно: Гуморальная регуляция деятельности сердца. Прямая (непосредственное влияние гуморальных факторов на рецепторы миокарда). Основные гуморальные регуляторы деятельности сердца: 1. Ацетилхолин. Действует на М2-холинорецепторы. М2-холинорецеп-горы относятся к метаботропным рецепторам. Образование лиганд-рецепторного комплекса ацетилхолина с этими рецепторами приводит к активации, ассоциированной с М2-холинорецептором субъединицы Gai, которая тормозит активность аденилатциклазы и опосредованно снижает активность протеинкиназы А. Протеинкиназа А имеет важное значение в активности миозинкиназы, играющей определяющую роль в фосфорили-ровании головок тяжелых нитей миозина, ключевого процесса сокращения миоцитов, поэтому можно полагать, что снижение ее активности способствует развитию отрицательного инотропного эффекта. При взаимодействии ацетилхолина с М2-холино-рецептором не только угнетается аденилатциклаза, но и акти вируется мембранная гуанилатциклаза, ассоциированная с этим рецептором. Это приводит к увеличению концентрации цГМФ и, как следствие, к активации протеинкиназы G, которая способна: фосфорилировать мембранные белки, образующие лигандуправляемые К+- и анионные каналы, что увеличивает проницаемость этих каналов для соответствующих ионов; фосфорилировать мембранные белки, образующие лигандуправляемые Na+- и Са++- каналы, что приводит к уменьшению их проницаемости; фосфорилировать мембранные белки, образующие К+/ Na+- насос, что приводит к уменьшению его активности. Фосфолирирование лигандуправляемых калиевых, натриевых, кальциевых каналов и К+ Na+ насоса протеинкиназой G приводит к развитию тормозного действия ацетилхолина на сердце, которое проявляется в отрицательном хронотропном и отрицательном инотропном эффектах. Кроме того, следует иметь в виду, что ацетилхолин непосредственно активирует ацетилхолинрегулируемые калиевые каналы атипических кардиомиоцитов. Тем самым снижает возбудимость этих клеток за счет увеличения полярности мембран атипичных кардиомиоцитовсиноатриального узла и, как следствие, вызывает урежение сердечной деятельности (отрицательный хронотропный эффект). 2. Адреналин. Действует на β1-адренорецепторы. β1-адренорецепторы относятся к метаботропным рецепторам. Воздействие на данную группу рецепторов катехоламинами активирует аденилатциклазу Gas-субъединицей, ассоциированной с данным рецептором. Как следствие, в цитозоле повышается содержание цАМФ, происходит активация протеинкиназы А, которая активирует специфическую миозинкиназу, ответственную за фосфорилирование головок тяжелых нитей миозина. Такое воздействие ускоряет сократительные процессы в миокарде и проявляется как положительные ино- и хроно-тропные эффекты. Тироксин регулирует изоферментный состав миозина в кардиомиоцитах, усиливает сердечные сокращения. Глюкогон оказывает неспецифическое влияние, за счет активации аденилатциклазы усиливает сердечные сокращения. 3. Глюкокортикоиды усиливают действие катехоламинов за счет того, что повышают чувствительность адренорецепторов к адреналину. 4. Вазопрессин. В миокарде имеются V1-рецепторы к вазопрессину, которые ассоциированы с G-белком. При взаимодействии вазопрессина с Vi -рецептором субъединица Gaq активирует фосфолипазу Сβ. Активированная фосфолипаза Сβ катализирует соответствующий субстрат с образованием ИФ3 и ДАГ. ИФ3 активирует кальциевые каналы цитоплазматиче-ской мембраны и мембраны саркоплазматического ретикулума, что приводит к увеличению содержания кальция в цитозоле. ДАГ параллельно активирует протеинкиназу С. Кальций инициирует мышечное сокращение и генерацию потенциалов, а протеинкиназа С ускоряет фосфорилирование головок миозина, как следствие, вазопрессин усиливает сердечные сокращения. Простагландины I2, Е2 ослабляют симпатические влияния на сердце. Аденозин. Влияет в миокарде на Р1-пуриновые рецепторы, которых достаточно много в области синоатриального узла. Усиливает выходящий калиевый ток, увеличивает поляризацию мембраны кардиомиоцита. За счет этого снижается пейсмекерная активность синоатриального узла, уменьшается возбудимость других отделов проводящей системы сердца. Ионы калия. Избыток калия вызывает гиперполяризацию мембран кардиомиоцитов и, как следствие, брадикардию. Малые дозы калия увеличивают возбудимость сердечной мышцы.
№17 Рефлекторная регуляция сердечной деятельности обеспечивает приспособление деятельности сердца к потребностям организма. Группы рефлексов: внутрисердечные рефлексы; с интерорецепторов; с экстерорецепторов. Наиболее выражено влияние с интерорецепторов сердечно-сосудистой системы. Участки скопления рецепторов называются рефлексогенными зонами. Виды рефлекторных влияний. 1. С каротидных синусов. Каротидные синусы - ампулообразные расширения сонных артерий в месте бифуркации на внутреннюю и наружную. Здесь 2 вида механорецепторов: 1-го порядка - реагирует на повышение давления; 2-го порядка - реагируют на понижение давления. При повышении давления возбуждаются механорецепторы 1-го порядка, от каротидного синуса по волокнам IX пары черепно-мозговых нервов импульсы идут в продолговатый мозг и возбуждают ядра нерва. Частота этих импульсов такова, что происходит иррадиация на ядра Х пары - n.vagus возбуждается, деятельность сердца тормозится. В итоге уменьшается сила и частота сердечных сокращений, меньше крови в единицу времени поступает в сосудистую систему, кровяное давление снижается. При снижении кровяного давления - возбуждаются механорецепторы 2-го порядка, по волокнам IX пары черепно-мозговых нервов возбуждение предаётся в продолговатый мозг. Частота импульсов такова, что происходит торможение активности Х пары черепно-мозговых нервов, начинает преобладать влияние симпатического отдела нервной системы - частота и сила сердечных сокращений увеличивается - кровяное давление возрастает. 2. Рефлекторное влияние с дуги аорты. Дуга аорты иннервируется волокнами n.vagus. Одни и те же рецепторы реагируют и на повышение кровяного давления и на понижение кровяного давления. Но возникают импульсы различные по частоте и амплитуде. 3. Рефлекторные влияния с правого предсердия. Эффект Бейнбриджа: при растяжении правого предсердия импульсы идут к ядрам n.vagus, из активность тормозится, что приводит к увеличению частоты сердечных сокращений. 4. Рефлекторные влияния перикарда. Рефлекс Черниговского - при растяжении перикарда или возбуждении его хеморецепторов наблюдается торможение сердечной деятельности. 5. Рефлекторное влияние с сосудов малого круга кровообращения. Рефлекс Парина - при увеличении кровяного давления в сосудах малого кровяного круга наблюдается торможение сердечной деятельности. 6. Рефлекторное влияние рецепторов устьев полых вен. Рефлекс Бецальда-Яриша - при повышении давления в полых венах наблюдается торможение сердечной деятельности. 7. Рефлексы с интерорецепторов внутренных органов - в основном желудочнокишечного тракта. Рефлекс Гольца - при раздражении желудочно-кишечного тракта - тормозится сердечная деятельность (висцеро-висцеративный рефлекс). 8. Рефлексы с экстероцепторов (в основном с кожи). При раздражении болевых рецепторов, холодовых рецепторов, слизистых оболочек резкими запахами - активирется симпатическая нервная система, наблюдается тахикардия.
Влияние на сердце блуждающих, симпатических, парасимпатических нервов
И блуждающие, и симпатические нервы оказывают на сердце 5 влияний:
хронотропный (изменяют частоту сердечных сокращений);
инотропный (изменяют силу сердечных сокращений);
батмотропный (влияют на возбудимость миокарда);
дромотропный (влияет на проводимость);
тонотропный (влияют на тонус миокарда);
То есть они оказывают влияние на интенсивность обменных процессов.
Парасимпатическая нервная система - отрицательные все 5 явлений; симпатическая нервная система - все 5 явлений положительные.
Влияние парасимпатических нервов.
Отрицательное влияние n.vagus связано с тем, что его медиатор ацетилхолин взаимодействует с М-холинорецепторами.
Отрицательное хронотропное влияние - за счёт взаимодействия между ацетилхолином с М-холинорецепторами синоартиального узла. в результате открываются калиевые каналы (повышается проницаемость для К+), в результате уменьшается скорость медленной диастолической спонтанной поляризации, в итоге уменьшается количество сокращений в минуту (за счёт увеличения продолжительности действия потенциала действия).
Отрицательное инотропное влияние - ацетилхолин взаимодействует с М-холинорецепторами кардиомиоцитов. В результате тормозится активность аденилатциклазы и активируется гуанилатциклазный путь. Ограничение аденилатциклазного пути уменьшает окислительное фосфорилирование, уменьшается количество макроэргических соединений, в итоге уменьшается сила сердечных сокращений.
Отрицательное батмотропное влияние - ацетилхолин взаимодействует и М-холинорецепторами всех образований сердца. В резултате увеличивается проницаемость клеточной мембраны миокардиоцитов для К+. Величина мембранного потенциала увеличивается (гиперполяризация). Разность между мембранным потенциалом и Е критическим увеличивается, а эта разность показатель порога раздражения. Порог раздражения увеличивается - возбудимость уменьшается.
Отрицательное дромоторопное влияние - т. к. возбудимость уменьшается, то малые круговые токи медленнее распространяются, поэтому уменьшается скорость проведения возбуждения.
Отрицательный тонотропный эффект - под действием n.vagus не происходит активации обменных процессов. Влияние симпатических нервов.
Медиатор норадреналин взаимодействует с бетта 1-адренорецепротами синоатриального узла. в результате открываются Са2+-каналы - повышается проницаемость для К+ и Са2+. В результате увеличивается скорость мелоенной спонтанной диастолической деполяризации. Продолжительность потенциала действия уменьшается, соответственно частота сердечных сокращений увеличивается - положительный хронотропный эффект.
Положительный инотропный эффект - норадренолин взаимодействует с бетта1- рецепторами кардиоцитов. Эффекты:
активируется фермент аденилатциклаза, т. о. стимулируется окислительное фосфорилирование в клетке с образованием, увеличивается синтез АТФ - увеличивается сила сокращений.
увеличивается проницаемость для Са2+, который участвует в мышечных сокращениях, обеспечивая образование актомиозиновых мостиков.
под действием Са2+ увеличивается активность белка кальмомодулина, который обладает сродством к тропонину, что увеличивает силу сокращений.
активируются Са2+-зависимые протеинкиназы.
под действием норадреналина АТФ-азная активность миозина (фермент АТФ-аза). Это самый важный для симпатической нервной системы фермент.
Положительный батмотропный эффект: норадреналин взаимодействует с бетта 1-адренорецепорами всех клеток, увеличивается проницаемость для Na+ и Ca2+ (эти ионы поступают внутрь клетки), т. о. возникает деполяризация клеточной мембраны. Мембранный потенциал приближается к Е критическому (критический уровень деполяризации). Это снижает порог раздражения, а возбуждаемость клетки увеличивается.
Положительное дромотропное влияние - вызвано повышением возбудимости.
Положительное тонотропное влияние - связано с адаптационно-трофической функцией симпатической нервой системы. Для парасимпатической нервной системы наиболее важен отрицательный хронотропный эфект, а для симпатической нервной системы - положительное инотропное и тонотропное влияние.
Роль рефлексогенных зон в регуляции деятельности сердца. В стенках многих отделов сосудистой системы сердца содержатся рецепторы, которые раздражаются под воздействием давления крови (барорецепторы) или под действием химических агентов (хеморецепторы). Наибольшее значение для сердечной деятельности имеют рефлексогенные зоны дуги аорты, ветвей сонных и легочной артерий, полые вены и эпикард. Раздражение барорецепторов этих зон наблюдается при повышении или снижении их кровенаполнения. При увеличении объема крови в дуге аорты она растягивается. Это приводит к возбуждению механорецепторов, импульсация от которых поступает депрессорным нервом у ядра, что приводит к повышению их тонуса. Информация по ним передается блуждающим нервом к сердцу, снижая его функцию. Подобная закономерность наблюдается и при повышении давления в синокаротидний зоне, информация от рецепторов которого поступает в центр нервом Геринга. При уменьшении объема крови (давления) в рефлексогенных зонах ослабляется тонус ядер блуждающего нерва, благодаря чему повышается активность симпатической нервной системы, которое сопровождается усилением функции сердца. Такой же механизм улучшения работы сердца наблюдается при растяжении большим »порциями крови полых вен в месте их впадения в правое передсердця (рефлекс Бейнбридж). Рефлексогенные зоны отвечают не только на механические раздражения, но и на химические вещества, которые заносятся в них кровью. Так, при раздражении хеморецепторов изолированного каротидного синуса адреналином, никотином, углекислотой информация поступает в ядра блуждающего нерва, повышая его тонус. Это сопровождается снижением функции сердца. Выявлено также рецепторы в сердце - эпикарде, миокарде и эндокарде. их раздражение рефлекторно изменяет сердечную деятельность. Нервные волокна от их рецепторов в основном проходят в составе блуждающего нерва. С помощью блуждающего нерва возникает и рефлекс Гольца - остановка сердца при нанесении удара в живот, его развитие связано с возбуждением брюшного нерва кишок, информация по которому передается в центр блуждающего нерва, а от него к сердцу. До рефлексов, связанных с блуждающим нервом, относится и очно-сердечный рефлекс Ашнера - при нажатии на глазные яблоки существенно уменьшается ЧСС. Многие уровней систем нервной регуляции сердца направлены главным образом на согласование функции сердца с состоянием остальных отделов сердечно-сосудистой системы, функциональную активность других органов и организма в целом. Причем чем выше расположен отдел ЦНС, тем больше информации он получает и точнее регулирует деятельность сердца. Взаимодействие различных уровней регуляторных систем образует целостную иерархическую систему механизмов регуляции, что позволяет сердцу функционировать в точном соответствии с конкретными потребностями организма в кровоснабжении
№18



№19 Кровяное давление - это давление крови на стенки сосудов.
Артериальное давление - это давление крови в артериях.
На величину кровяного давления влияют несколько факторов.
1. Количество крови, поступающее в единицу времени в сосудистую систему.
2. Интенсивность оттока крови на периферию.
3. Ёмкость артериального отрезка сосудистого русла.
4. Упругое сопротивление стенок сосудистого русла.
5. Скорость поступления крови в период сердечной систолы.
6. Вязкость крови
7. Соотношение времени систолы и диастолы.
8. Частота сердечных сокращений.
Таким образом, величина кровяного давления, в основном, определяется работой сердца и тонусом сосудов (главным образом, артериальных).
В аорте, куда кровь с силой выбрасывается из сердца, создается самое высокое давление (от 115 до 140 мм рт. ст.).
По мере удаления от сердца давление падает, так как энергия, создающая давление, расходуется на преодоление сопротивления току крови.
Чем выше сосудистое сопротивление, тем большая сила затрачивается на продвижение крови и тем больше степень падения давления на протяжении данного сосуда.
Так, в крупных и средних артериях давление падает всего на 10%, достигая 90 мм рт.ст.; в артериолах оно составляет 55 мм, а в капиллярах – падает уже на 85%, достигая 25 мм.
В венозном отделе сосудистой системы давление самое низкое.
В венулах оно равно 12, в венах – 5 и в полой вене – 3 мм рт.ст.
В малом круге кровообращения общее сопротивление току крови в 5-6 раз меньше, чем в большом круге. Поэтому давление в легочном стволе в 5-6 раз ниже, чем в аорте и составляет 20-30 мм рт.ст. Однако и в малом круге кровообращения наибольшее сопротивление току крови оказывают мельчайшие артерии перед своим разветвлением на капилляры.
Дополнительно: Кровяное давление в разных отделах кровеносного русла.
При продвижении крови от сердца к периферии колебания давления ослабевают в связи с эластичностью аорты и артерий, поэтому кровь в аорте и артериях продвигается толчками, а в артериолах и капиллярах — непрерывно.
Наибольшее падение давления происходит в артериолах и затем в капиллярах. Несмотря на то, что капилляры имеют меньший диаметр, чем артериолы, уменьшение давления на более значительную величину происходит в артериолах. Это связано с их большей длиной по сравнению с капиллярами. В артериальной части капилляра (на «входе») давление крови равно 35 мм рт.ст., а в венозной (на «выходе») — 15 мм рт.ст.
В полых венах давление приближается к 0 мм рт.ст. При регистрации давления в крупных венах на графике (флебограмма) различают волны первого и второго порядка. К волнам первого порядка относят зубцы а, с, v. Волна а обусловлена застоем крови в полых венах во время систолы правого предсердия. Волна с связана с ударом крови в сонной артерии в стенку яремной вены. Волна v обусловлена застоем крови в полых венах во время систолы правого желудочка.
Факторы, влияющие на величину кровяного давления.
Ударный объём левого желудочка;
Растяжимость аорты и крупных артерий;
Периферическое сосудистое сопротивление, в основном на уровне артериол (контролируется вегетативной нервной системой);
Количество крови в артериальной системе.
Объемная скорость кровотока. Объемная скорость кровотока зависит от просвета сосуда: самая высокая скорость кровотока — в аорте и полых венах, самая низкая — в каждом отдельном капилляре. Однако объемная скорость кровотока постоянна во всех сосудах одного калибра, так как количество крови, протекающей через разные участки сосудистого русла, например через все артерии и вены, одинаково в единицу времени.
Для
расчета величины сопротивления току
крови на определенном участке сосудистой
сети можно использовать приведенную
выше формулу:
![]()
Сопротивление
току крови тем больше, чем больше ее
вязкость, чем больше длина сосуда, по
которому течет кровь, и чем меньше радиус
этого сосуда. Зависимость сопротивления
R
от этих величин отражает второе уравнение
Пуазейля:
![]() где 1 — длина сосуда; r
— радиус сосуда; η
— вязкость
крови.
где 1 — длина сосуда; r
— радиус сосуда; η
— вязкость
крови.
В соответствии с уравнением максимально большое сопротивление движению крови оказывают артериолы и несколько меньшее — капилляры в связи с их малой длиной по сравнению с артериолами.
Высокое сопротивление артериол и капилляров обусловливает то, что именно на этом участке сосудистого русла давление крови значительно падает. 85 % энергии, затрачиваемой сердцем на продвижение крови по организму, расходуется в артериолах и капиллярах, а 10 и 5 % — соответственно в артериях и венах.
![]() Линейная
скорость кровотока. Кроме
объемной скорости кровотока, важным
показателем гемодинамики является
линейная скорость кровотока, т.е.
расстояние, которое частица крови
проходит за единицу времени. Линейная
скорость кровотока V
прямо пропорциональна площади поперечного
сечения сосудов πr2
одногокалибра:
Линейная
скорость кровотока. Кроме
объемной скорости кровотока, важным
показателем гемодинамики является
линейная скорость кровотока, т.е.
расстояние, которое частица крови
проходит за единицу времени. Линейная
скорость кровотока V
прямо пропорциональна площади поперечного
сечения сосудов πr2
одногокалибра:
Поскольку объемная скорость кровотока не меняется по ходу сосудистого русла, линейная скорость зависит только от общей поперечной площади сосудов одного калибра. Чем больше площадь, тем меньше скорость.
Во время выброса крови из сердца линейная скорость крови равняется 50—60 см/с. Во время диастолы скорость падает до 0. В артериях максимальная скорость кровотока равняется 25—40 см/с. В артериолах толчкообразное течение крови сменяется непрерывным. Самая низкая скорость кровотока в капиллярах — 0,5 мм/с. В венах линейная скорость кровотока возрастает до 5—10 см/с.
Линейная скорость максимальна в центре сосуда и минимальна у его стенок в связи с наличием сил трения между кровью и стенкой сосуда.
№20 см №18
№21 Артериальный пульс, его происхождение и характеристика.
В артериях периодически возникают колебания их стенок, называемые артериальным пульсом. Определяются следующие свойства пульса: ритм, частота, напряжение, наполнение, величина и форма.
Ритм. У здорового человека сокращение сердца и пульсовые волны следуют друг за другом через равные промежутки времени, то есть пульс ритмичен.
При расстройствах сердечного ритма пульсовые волны следуют через неодинаковые промежутки времени и пульс становится неритмичным.
Частота. Частота пульса в нормальных условиях соответствует частоте сердечных сокращений и равна 60-80 сокр/мин. При тахикардии увеличивается число пульсовых волн в минуту, появляется частый пульс; при брадикардии пульс становится редким.
Напряжение. Напряжение пульса определяется той силой, которую нужно приложить исследующему для полного сдавления пульсирующей артерии. Это свойство пульса зависит от величины систолического артериального давления. Чем выше давление, тем труднее сжать артерию, - такой пульс называется напряженным, или твердым. При низком давлении артерия сжимается легко - пульс мягкий.
Наполнение. Наполнение пульса отражает наполнение исследуемой артерии кровью, обусловленное в свою очередь тем количеством крови, которое выбрасывается в систолу в артериальную систему и вызывает колебание объема артерии. Оно зависит от величины ударного объема, от общего количества крови в организме и ее распределения.
Величина. Величина пульса, то есть величина пульсового толчка, - понятие, объединяющее такие его свойства, как наполнение и напряжение. Она зависит от степени расширения артерии во время систолы и от ее спадения в момент диастолы. Это в свою очередь зависит от наполнения пульса, величины колебания артериального давления в систолу и диастолу и способности артериальной стенки к эластическому расширению.
Форма. Форма пульса зависит от скорости изменения давления в артериальной системе в течение систолы и диастолы.
Анализ сфигмограммы.
З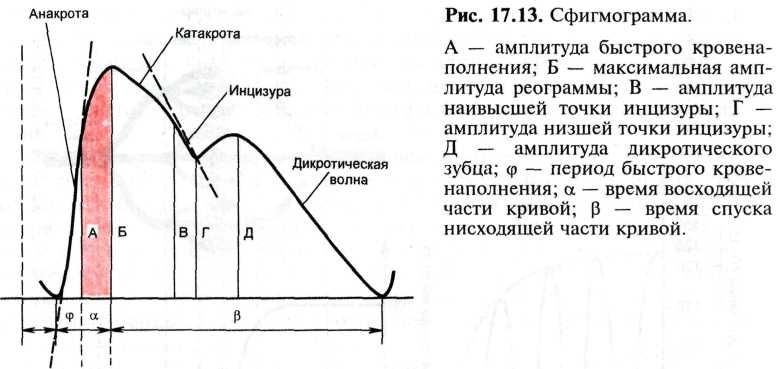 апись
артериального пульса называется
сфигмографией.
На
сфигмограмме различают анакроту,
катакроту, инцизуру и дикротический
подъем, природа которых связана с волнами
первого порядка, т.е. с изменением
давления крови в аорте при выбросе крови
из сердца. Стенка аорты при этом несколько
растягивается, а затем возвращается к
исходному размеру вследствие своей
эластичности. Механическое колебание
стенки аорты, называемое пульсовой
волной, передается
далее на артерии, артериолы и здесь, не
доходя до капилляров, затухает.
апись
артериального пульса называется
сфигмографией.
На
сфигмограмме различают анакроту,
катакроту, инцизуру и дикротический
подъем, природа которых связана с волнами
первого порядка, т.е. с изменением
давления крови в аорте при выбросе крови
из сердца. Стенка аорты при этом несколько
растягивается, а затем возвращается к
исходному размеру вследствие своей
эластичности. Механическое колебание
стенки аорты, называемое пульсовой
волной, передается
далее на артерии, артериолы и здесь, не
доходя до капилляров, затухает.
Скорость распространения пульсовой волны.
Скорость распространения пульсовой волны выше скорости течения крови, в среднем она равна 10 м/с. Поэтому пульсовая волна достигает лучевой артерии в области запястья (наиболее часто используемое место регистрации пульса) примерно за 100 мс при расстоянии от сердца до запястья 1 м. Следовательно, при синхронной регистрации пульса лучевой артерии и процессов в сердце пульсовые колебания будут запаздывать на 100 мс.
Если колебания давления, распространяясь от сердца к периферии, постепенно затухают, то амплитуда каждой фазы пульса в периферических артериях увеличивается. В артериолах пульс затухает окончательно и отсутствует в капиллярах, венулах, мелких и средних венах. В крупных венах появляется венный пульс.
Факторы, обеспечивающие непрерывное движение крови по сосудам.
остаточная сила работы сердца;
присасывающая сила сердца во время диастолы;
присасывающая сила грудной клетки в фазу вдоха;
капиллярные силы поверхностного натяжения;
наличие в венах клапанов; активность скелетных мышц.
Венный пульс. В мелких и средних венах пульсовые колебания давления крови отсутствуют. В крупных венах вблизи сердца отмечаются пульсовые колебания — венный пульс, имеющий иное происхождение, чем артериальный пульс. Он_обусловлен затруднением притока крови из вен в сердцево время систолы предсердий и желудочков Во время систолы этих отделов сердца давление в венах повышается, происходят их расширение и колебания стенок. Удобнее всего записывать венный пульс яремной вены. На кривой венного пульса — флебограмме — различают три зубца: а, с, v. Зубец а совпадает с систолой правого предсердия и обусловлен тем, что в момент сйстолы предсердия устья полых вен зажимаются кольцом мышечных волокон вследствие чего приток крови в предсердия из вен временно приостанавливается. Во время диастолы предсердий доступ в них крови становится вновь свободным, и в это время кривая венного пульса
круто снижается. Вскоре на кривой венного пульса появляется небольшой зубец с. Он обусловлен толчком пульсирующей сонной артерииг лежащей вблизи яремной вены После зубца с начинается падение кривой, которое сменяется новым подъемом — Зубцом v. Последний обусловлен, тем, что к концу систолы желудочков предсердия наполнены кровью, дальнейшее поступление Ё них крови невозможно, происходят застой крови в венах и растяжение их стенок. После зубца v наблюдается падение кривой, совпадающее с диастолой желудочков и поступлением в них крови из предсердий.
Дополнительно:
Косвенная характеристика сократительных
процессов, происходящих в правых отделах
сердца, может быть получена при помощи
югулярной флебографии, отражающей
динамику оттока крови из полых вен в
правое предсердие. Каждый сердечный
цикл на югулярной флебограмме (рис.
9.15) представлен тремя положительными
(а, с, v) и двумя отрицательными (х, у)
волнами.
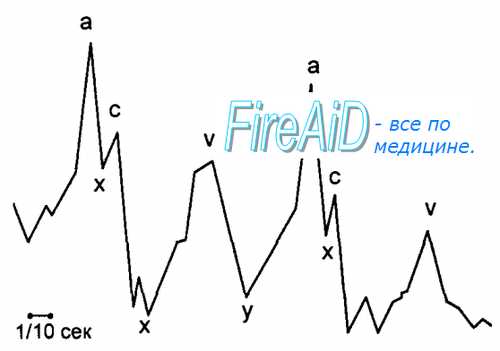
Рис. 9.15. Графическая запись венозного пульса (флебограмма). Систола правого предсердия вызывает замедление оттока крови из вен, что приводит к возникновению положительной волны флебограммы, обозначаемой символом «а» (от лат. atrium). Следующая положительная волна возникает в начале систолы правого желудочка при закрытии трехстворчатого клапана и обозначается символом «с» (от лат. саг-otis), так как ее появление совпадает с началом подъема каротидной сфигмограммы. Далее следует отрицательная волна «х», которая отражает ускоренный отток крови из центральных вен в расслабляющееся предсердие. Самая глубокая точка этой волны совпадает по времени с закрытием полулунных клапанов. Наполнение правого предсердия при закрытом трехстворчатом клапане приводит к повышению в нем давления и затруднению оттока крови из вен, что отражается на флебограмме положительной волной «v» (от лат. ventriculus). Последующее быстрое поступление крови из правого предсердия в желудочек в период диастолы сердца проявляется в виде отрицательной волны флебограммы, которая называется волной диастолического коллапса и обозначается символом «у».
№22 Характеристика микроциркуляторного русла (рис. 11.18). Длина капилляров варьирует в пределах 0,5-1,0 мм, диаметр составляет 5—10 мкм; кровяное давление в артериальном конце равно 30 мм рт. ст., в венозном — 15 мм рт. ст., средняя скорость кровотока — около 1 мм/с. В капиллярах, через их стенку, осуществляется транспорт веществ, в результате чего клетки органов и тканей обмениваются с кровью теплом, водой и газом, другими веществами, образуется лимфа. Время прохождения эритроцита через капилляр большого круга кровообращения составляет 2,5 с, в малом круге — 0,3—1 с. Его определяют с помощью биомикроскопии, дополненной кинотелевизионным и другими методами. Транскапиллярный обмен веществ происходит путем фильтрации, простой и облегченной диффузии, трансцитоза и осмоса. Объем транспорта веществ зависит от количества функционирующих капилляров и их проницаемости, от линейной скорости кровотока, от гидростатического и онкотического давления в капиллярах.
В покое во многих тканях функционирует лишь 25-30 % капилляров от их общего количества, а при деятельном состоянии их число возрастает — например, в скелетных мышцах до 50-60 %. Проницаемость сосудистой стенки увеличивается под влиянием гистамина, се-ротонина, брадикинина, по-видимому, вследствие трансформации малых пор в большие. Проницаемость капилляров увеличивается под влиянием гиалурони-дазы, снижается — при действии ионов кальция, витаминов Р, С, катехолами-нов. Обменная поверхность капилляров состоит из чередующихся белковой, ли-пидной и водной фаз. Липидная фаза представлена почти всей поверхностью
эндотелиальной клетки, белковая — переносчиками и ионными каналами, водой заполнены межэндотелиальные поры и каналы, эндотелиоциты имеют фенестры. Свободно диффундирующие вещества быстро переходят в ткани, и диффузионное равновесие между кровью и тканевой жидкостью достигается уже в начальной половине капилляра. Для ограниченно диффундирующих веществ диффузионное равновесие достигается в венозном конце капилляра, либо оно не устанавливается вообще при большой линейной скорости кровотока.
Фильтрация — главный фактор, обеспечивающий переход жидкости из капилляров в интерстиций (рис. 11.19). Обеспечивает фильтрацию жидкости в артериальном конце капилляра фильтрационное давление (ФД). При этом фильтрации способствуют гидростатическое давление крови (ГДК = 30 мм рт. ст.) и онкотическое давление жидкости в тканях (ОДТ = 5 мм рт. ст.). Препятствует фильтрации онкотическое давление плазмы крови (ОДК = 25 мм рт. ст.). Гидростатическое давление в интерстиций колеблется около нуля, поэтому ФД = ГДК + ОДТ - ОДК = 30 + 5 - 25 = 10 (мм рт. ст.).
Реабсорбция межклеточной жидкости в капиллярах. По мере продвижения крови по капилляру ГДК снижается до 15 мм рт. ст., в результате силы, способствующие фильтрации, становятся меньше сил, противодействующих фильтрации, — формируется реабсорбционное давление (РД), обеспечивающее переход жидкости из интер-стиция в венозные концы капилляра: РД = ОДК - ГДК - ОДТ = 25 — 15 — — 5 = 5 (мм рт. ст.).
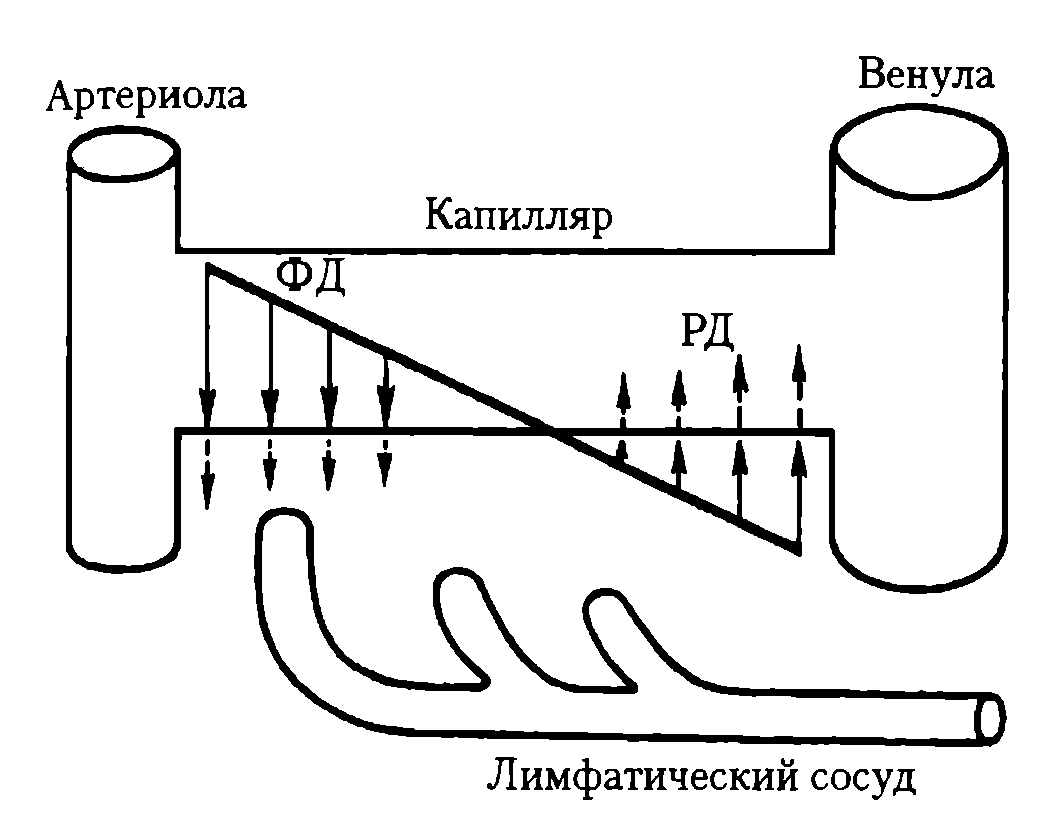
Рис. 11.19. Обмен жидкости между кровью
и интерстицием через стенку капилляра.
Стрелками указаны направление движения
жидкости и изменения движущей силы:
ФД — фильтрационное давление; РД — реабсорб-ционное давление
Количество фильтрата (20 л/сут) несколько превышает количество реабсор-бируемой жидкости (около 18 л/сут), однако эта часть воды (2 л) из тканей удаляется через лимфатическую систему. Между объемом жидкости, фильтрующейся в артериальном конце капилляра, и объемом жидкости, реабсорбируемой в венозном конце и удаляемой лимфатическими сосудами, в норме существует динамическое равновесие. В случае накопления воды в интерстиций возникает отек тканей. В транспорте воды и частиц из капилляра в интерстиций участвуют диффузия и пиноцитоз.
№23 Лимфатическая система — это совокупность лимфатических сосудов и расположенных по их ходу лимфатических узлов, обеспечивающая всасывание межклеточной жидкости, веществ и возврат их в кровяное русло.
Лимфатические сосуды. Начинается эта система с тончайших, закрытых с одного конца терминальных лимфатических капилляров. Их стенки высоко проницаемы, вместе с тканевой жидкостью внутрь лимфатического капилляра легко проходят молекулы белка. Архитектура сплетений лимфатических сосудов отражает конструкцию и функцию органов: они практически отсутствуют в головном и спинном мозге, мозговых оболочках, гиалиновом хряще, глазном яблоке, роговице, плаценте; мало их в мышцах, связках, фасциях, сухожилиях; наибольшее скопление лимфатических капилляров отмечено в печени, тонком кишечнике. В результате слияния терминальных капилляров образуются лимфатические «вены», снабженные, подобно венам кровеносной системы, клапанами, препятствующими обратному току лимфы.
Участки между двумя клапанами (клапанные сегменты), в последующем названные лимфангионами (Mesein),
обеспечивают насосную функцию лимфатической системы (Р. С. Орлов). В зависимости от строения средней оболочки лимфатические сосуды делят на две группы: мышечные и безмышечные. Центральным коллектором лимфы у человека является грудной проток. В него впадают многочисленные сосуды, собирающие лимфу от нижних конечностей, органов брюшной полости, левой половины груди, от сердца и левого легкого, от левой верхней конечности, от левой половины головы и шеи. Грудной проток впадает в угол, образованный левыми (наружной яремной и подключичной) венами в месте их слияния. Главный коллектор лимфы дополняется правым лимфатическим протоком, формирующимся путем слияния лимфатических сосудов правой половины головы, шеи, груди и правой верхней конечности. Этот проток впадает в правый венозный угол. Вся постоянно образующаяся лимфа возвращается в общий кровоток.
Лимфатические узлы — ключевые участки лимфатической системы. Благодаря наличию гладкомышечных элементов, они способны сокращаться, особенно при нейрогуморальных воздействиях. Число сосудов, приносящих лимфу в лимфоузлы, больше числа выносящих сосудов. Лимфатические узлы существенно влияют на клеточный состав лимфы. Лимфа очень медленно проходит здесь через узкие и извилистые протоки. Функции лимфатической системы Дренажная функция — удаление из интерстиция продуктов обмена и избытка воды, профильтровавшейся из кровеносных капилляров и не полностью реабсорбировавшейся.
Защитная функция —транспорт антигенов и антител, кооперация различных иммунокомпетентных клеток (лимфоцитов, макрофагов), формирование первичного и вторичного иммунных ответов на антиген, реализация клеточного иммунитета, перенос из лимфоидных органов плазматических клеток для обеспечения гуморального иммунитета. Детоксикация — переход в лимфу из интерстиция патологически измененных белков, токсинов, клеток и обезвреживание их в лимфоузлах. В патологических случаях попадающие в лимфу бактерии фагоцитируются клетками лимфатического узла. Иногда часть бактерий, пройдя через первый лимфатический узел, задерживается во втором или третьем узлах. При массивном заражении микробы могут пройти через все узлы и вторгнуться в кровеносное русло. Когда микробы попадают в лимфатические узлы, в них развивается воспалительный процесс. Они увеличиваются в размерах, становятся болезненными. У людей, которые много курят, лимфатические узлы в области легких наполняются частицами табачного дыма, становятся темно-серыми или черными. Эти частицы могут нарушить функционирование лимфатических узлов, снизить устойчивость организма к легочным инфекциям, способствуют другим заболеваниям, в том числе и развитию рака легких.
Кроветворная функция. В лимфатических узлах образуются главным образом лимфоциты и, в меньшей степени, моноциты; продолжается диф-ференцировка долгоживущих Т-лим-фоцитов. При попадании в организм микроорганизмов или после трансплантации чужеродных тканей в ближайшем лимфатическом узле интенсивно делятся лимфатические клетки и образуются малые лимфоциты.
Транспортирует из пищеварительной системы в кровь продукты гидролиза пищевых веществ, в основном липиды.
Лимфатическая система обеспечивает возврат белков, липидов и электролитов в кровь —за сутки в кровь возвращается около 40 г белка.
Состав и свойства лимфы. Лимфа представляет собой прозрачную жидкость слегка желтоватого цвета. Вязкость и плотность лимфы ниже, чем плазмы крови, вследствие меньшего содержания в ней белков. Удельный вес лимфы колеблется в широких пределах (от 1,015 до 1,026) и зависит от областей, откуда она оттекает; рН « 9. Лимфа состоит из лимфоплазмы и форменных элементов, в основном лимфоцитов. По химическому составу лимфа близка к плазме крови (см. таблицу).
Механизм образования лимфы. Главным фактором образования лимфы является градиент фильтрационного давления. Лимфа формируется из ин-терстициальной жидкости (см. п. 11.10), давление в которой колеблется около нуля. Давление же в лимфатических капиллярах ниже атмосферного вследствие насосной функции лимфангионов. Пи-ноцитоз обеспечивает транспорт белков, хиломикронов, других частиц в полость лимфатического капилляра через эндо телиальные клетки. В лимфатические сосуды попадает только небольшая часть жидкости, которая не реабсорбируется обратно из интерстиция в кровеносный капилляр, она в виде лимфы возвращается в кровеносное русло. В лимфатические капилляры попадает 2—4 л жидкости в сутки. Белки в небольшом количестве попадают в интерстиций, затем в лимфокапилляр, за белком движется вода. В лимфатических сосудах взрослого человека с массой тела 60 кг натощак в состоянии покоя содержится 1,5—3 л лимфы, т.е. 25— 50 мл/кг массы тела.
Хотя диаметр пор в стенке кровеносного капилляра меньше, чем размер молекул белка плазмы, небольшое количество белка проникает в интерстиций. Кроме того, некоторое количество белка может переходить через эндотелий путем пиноцитоза.
Непосредственной движущей силой лимфы, как и крови, в любом участке сосудистого русла является градиент давления, который создается несколькими факторами.
Сократительная активность лимфатических сосудов и узлов, которая активируется повышением в них гидростатического давления вследствие попадания порции лимфы из соседнего лимфангиона. В лимфангионе имеются мышцесодер-жащая часть и участок со слабым развитием мышечных элементов (область прикрепления клапанов). Для функций лимфатических сосудов характерны фаз-
ные ритмические сокращения (10—20 в 1 мин), медленные волны (2—5 в 1 мин) и тонус.
Пульсация близлежащих крупных артериальных сосудов, сокращение скелетных мышц, повышение внутри-брюшного давления также способствуют движению лимфы.
Клапанный аппарат обусловливает односторонний ток жидкости по направлению к сердцу при сдавливании лимфатических сосудов и их активном сокращении.
Присасывающее действие грудной к л е т к и, по общепринятому мнению, способствует продвижению лимфы в область крупных вен грудной полости, как и движение крови по венам.
№24(большиство информации надо самому)
Кровообращение в сердце
У млекопитающих миокард получает кровь по двум коронарным (венечным) артериям — правой и левой, устья которых располагаются в корне аорты. Ветви левой снабжают кровью левый желудочек и межжелудочковую перегородку, левое и правое предсердия. Ветви правой венечной артерии проникают в стенки правой половины сердца. Капиллярная сеть миокарда очень густая: число капилляров приближается к числу мышечных волокон. Миокард пронизан сетью так называемыхнесосудистых каналов. По диаметру они соответствуют венулам и артериолам, а по строению стенки напоминают капилляры. Они соединяют соответствующие сосуды с полостями сердца. К дренажной системе сердца относятся еще и синусы, располагающиеся в глубоких слоях миокарда. В них открываются капилляры.
Условия циркуляции крови в венечных сосудах значительно отличаются от условий циркуляции в сосудах других органов тела. Ритмические колебания давления в полостях сердца и изменение его формы и размеров в течение сердечного цикла оказывают существенное влияние на кровоток через венечные сосуды. Так, в момент систолического напряжения желудочков сердечная мышца сдавливает находящиеся в ней сосуды, поэтому кровоток ослабевает, доставка кислорода к тканям снижается. Сразу же после конца систолы кровоснабжение сердца увеличивается. Ток коронарного кровообращения может изменяться и в зависимости от давления в аорте. Однако кровоток через сердце может возрастать при неизменности артериального давления благодаря механизмам регуляции коронарного кровообращения.
Нервная регуляция коронарного кровообращения остается во многом до конца не исследованной. Основная регулирующая роль взаимодействия естественных симпатических и парасимпатических влияний состоит в быстром и адекватном приспособлении
255
коронарного кровообращения к текущим потребностям организма. Возбуждение блуждающих нервов расширяет коронарные сосуды. При раздражении сердечных симпатических ветвей также наблюдается расширение коронарных сосудов и увеличение кровотока. При этом увеличиваются сила и частота сердцебиений, растет скорость сокращения сердечной мышцы и интрамуральное давление. Эти факторы, изменяющие метаболизм миокарда, сами по себе вызывают расширение коронарных сосудов.
Легочное кровообращение
Кровоснабжение легких осуществляется легочными и бронхиальными сосудами. Легочные сосуды составляют малый круг кровообращения и выполняют главным образом функцию газообмена между кровью и воздухом. Бронхиальные сосуды обеспечивают питание легкого и принадлежат к большому кругу кровообращения. Между этими двумя системами существуют выраженные анастомозы.
Особенностью малого круга кровообращения являются относительно небольшая длина его сосудов, меньшее (примерно в 10 раз по сравнению с большим кругом) сопротивление, оказываемое току крови, тонкость стенок артериальных сосудов и почти непосредственное соприкосновение капилляров с воздухом легочных альвеол. Из-за меньшего сопротивления кровяное давление в артериях малого круга в 5−6 раз меньше давления в аорте. Эритроциты проходятчерез легкие примерно за 6 с, находясь в обменных капиллярах 0,7 с (Г.И. Косицкий). Бронхиальные артерии большого круга разветвляются в легких только до дыхательных бронхиол, и питание стенки альвеол происходит через капиллярную сеть легочных сосудов.
Кровообращение в печени
Печень получает одновременно артериальную и венозную кровь. Артериальная кровь поступает по печеночной артерии, венозная — из воротной вены от пищеварительного тракта, поджелудочной железы и селезенки. Общий отток крови в полую вену осуществляется по печеночным венам. Через собственно печеночную артерию проходит 20−30 % всей крови, остальное — через воротную вену. Следовательно, венозная кровь от пищеварительного тракта, поджелудочной железы и селезенки возвращается к сердцу только пройдя еще дополнительно через печень. Такая особенность кровообращения печени, получившая название портального кровообращения, связана с пищеварением и выполнением барьерной функции.
Кровь в системе портального кровообращения проходит через две сети капилляров. Первая сеть расположена в стенках органов пищеварения, поджелудочной железы, селезенки, она обеспечивает всасывательную, выделительную и двигательную функции этих органов. Вторая сеть капилляров находится непосредственно в паренхиме печени. Она обеспечивает ее обменную и экскреторную функции, предотвращение интоксикации организма продуктами, образующимися в пищеварительном тракте.
Исследования Н.В. Экка показали, что если кровь из воротной вены направить непосредственно в полую вену, т.е. минуя печень, произойдет отравление организма со смертельным исходом.
Особенностью микроциркуляции в печени является тесная связь между разветвлениями воротной вены и собственно печеночной артерии с образованием в дольках печени синусоидных капилляров, к мембранам которых непосредственно прилежат гепатоциты. Большая поверхность соприкосновения крови с гепатоцитами и медленный кровоток в синусоидных капиллярах создают оптимальные условия для обменных и синтетических процессов.
В системе портального кровообращения артериальная кровь под давлением 110−120 мм рт. ст. поступает в первую сеть капилляров (например, стенки кишки), где оно понижается до 10−15 мм рт. ст. После прохождения второй сети капилляров уже в печеночных венах оно составляет 0−5 мм рт. ст. Эта разность давлений обеспечивает поступательное движение крови.
Регуляция портальной гемодинамики осуществляется посредством системы периодически сокращающихся входных и выходных сфинктеров синусоидных капилляров. Такая система приспосабливает кровоток к деятельности органов брюшной полости, а также обеспечивает депонирование крови
Кровообращение мозга с помощью 2 сонных и 2 позвоночных атерий, которые образуют артериальный круг большого мозга от него отходят артериальные ветви питающие мозговую ткань.При усиленной работе коры больших полушарий головного мозга увеличивается ее кровоснабжение ,вследствии расширения мозговых сосудов.
Почечное кровообращение 4,0 млг в минуту.Наличие двух последовательно капилярных сетей.приносящие артериолы распадаются на клубочковые капилры, отдельные от околоканальцевого капилярного ложа почек выносящими арериолами.
№25 Рефлекторная регуляция тонусов сосудов.
Различают собственные сердечно-сосудистые рефлексы и сопряженные.
Сопряженные сердечно-сосудистые рефлексы делят на две группы: экстерорецептивные (возникающие при раздражении рецепторов лежащих на поверхности тела) и интерорецептивные (возникающие при раздражении рецепторов внутренних органов).
Любое действие на организм, приходящее от экстерорецепторов, прежде всего повышает тонус сосудодвигательного центра и вызывает прессорную реакцию. Так, при механическом или болевом раздражении кожи сильном раздражении зрительного и других рецепторов наступает рефлекторное сужение сосудов.
С сосудистыми реакциями связано перераспределение крови в организме и кровоснабжение работающих органов.
Особенно большое значение в перераспределении крови в организме имеют реакции, возникающие при раздражении интерорецепторов и рецепторов с работающих мышц. Обеспечение работающих мышц кислородом и питательными веществами происходит за счет расширения сосудов и увеличения кровоснабжения работающих мышц. Расширение сосудов происходит при раздражении хеморецепторов продуктами обмена -АТФ, молочной, угольной и другими кислотами, которые вызывают уменьшение тонуса и расширение сосудов. В расширенные сосуды поступает больше крови и тем улучшается питание работающих мышц. Но при этом рефлекторно происходит перераспределение крови. Под влиянием эфферентных импульсов из сосудодвигательного центра происходит сужение сосудов неработающих органов. Расширенные сосуды работающих органов оказываются нечувствительными к этим сосудосуживающим импульсам.
Дополнительно: Тонус сосудодвигательного центра зависит от афферентных сигналов, приходящих от периферических рецепторов, расположенных в некоторых сосудистых областях и на поверхности тела, а также от влияния гуморальных раздражителей, действующих непосредственно на нервные центры. Особенно важное значение имеют рецепторы, сосредоточенные в дуге аорты и в области разветвления сонной артерии на внутреннюю и наружную. Рецепторы сосудистых рефлексогенных зон возбуждаются при повышении давления крови в сосудах. Они являются барорецепторами. Влияние депрессорных и синокаротидных нервов на АД представляет собой регуляцию «на выходе» системы, работающую по принципу отрицательной обратной связи. При отклонении АД от заданной величины включаются компенсаторные реакции, восстанавливающие это давление до нормы. Это — регуляции «по рассогласованию». Как было сказано выше, существует еще один, принципиально иной, механизм регуляции АД «по возмущению» «на входе» системы. В данном случае компенсаторные реакции включаются еще до того, как АД изменится, предупреждая отклонение его от нормы. Необходимые для этого реакции запускаются сигналами, возникающими в рецепторах растяжения миокарда и коронарных сосудов, несущих информацию о степени наполнения кровью полостей сердца и артериальной системы. В этом случае регуляторные реакции реализуются через внутрисердечную нервную систему, а также через вегетативные центры ЦНС. Рефлекторная регуляция давления крови осуществляется при помощи не только механорецепторов, но и хеморецепторов, сосредоточенных в аортальном и каротидном тельцах. Хеморецепторы чувствительны к двуокиси кислорода и недостатку кислорода в крови: они раздражаются также окисью углерода, цианидами, никотином. Возбуждение хеморецепторов аорты и сонной артерии вызывает сосудистые прессорные рефлексы, в то время как раздражение механорецепторов — депрессорные рефлексы.
Сосудодвигательный центр
В. Ф. Овсянниковым в 1871 г. было установлено, что нервный центр, обеспечивающий определенную степень сужения артериального русла — сосудодвигательный центр — находится в продолговатом мозге. Локализация этого центра определена путем перерезки ствола мозга на разных уровнях. Если перерезка произведена у собаки или кошки выше четверохолмия, то артериальное давление не изменяется. Если перерезать мозг между продолговатым и спинным, максимальное давление крови в сонной артерии понижается до 60—70 мм рт. ст. Отсюда следует, что сосудодвигательный центр локализован в продолговатом мозге и находится в состоянии тонической активности, т. е. длительного постоянного возбуждения. Устранение его влияния вызывает расширение сосудов и падение артериального давления.
Более детальный анализ показал, что сосудодвигательный центр продолговатого мозга расположен на дне IV желудочка и состоит из двух отделов — прессорного и депрессорного. Раздражение первого вызывает сужение артерий и подъем артериального давления, а раздражение второго — расширение артерий и падение давления.
В настоящее время считают, что депрессорный отдел сосудодвигательного центра вызывает расширение сосудов, понижая тонус прессорного отдела и снижая, таким образом, эффект сосудосуживающих нервов.
Влияния, идущие от сосудосуживающего центра продолговатого мозга, приходят к нервным центрам симпатической части вегетативной нервной системы, расположенным в боковых рогах грудных сегментов спинного мозга, где образуются сосудосуживающие центры, регулирующие тонус сосудов отдельных участков тела. Спинномозговые центры способны через некоторое время после выключения сосудосуживающего центра продолговатого мозга немного повысить давление крови, снизившееся вследствие расширения артерий и артериол. Кроме сосудодвигательного центра продолговатого и спинного мозга, на состояние сосудов оказывают влияние нервные центры промежуточного мозга и больших полушарий.
Классический опыт Клода Бернара.
Перерезка симпатического нерва ведет к покраснению уха кролика вследствие расширения денервированных сосудов.
Раздражение симпатического нерва - «побеление» уха (вследствие спазма сосудов).
Причины, влияющие на тонус сосудодвигательного центра.
