
- •Актуалізація теми
- •Мета і завдання
- •Практичне значення одержаних результатів
- •Теоретична частина розділ 1 анестетики
- •Загальні відомості про анестетики.
- •1. Інгаляційні анестетики (вводяться через дихальні шляхи):
- •2. Неінгаляційні анестетики (як правило, вводяться внутрішньовенно):
- •1.2. Окремі представники анестетиків, їх добування,ідентифікація та застосування
- •Ароматичні солі діазонію
- •2.2 Ваємодія ненасичених сполук з солями діазонію в присутності різноманітних аніонів
- •2.3. Взаємодія ненасичених сполук з солями арилдіазонію в присутності сульфур(VI) оксиду
- •Розділ 3. Синтез жирно-ароматичного триазену на основі анастезину і його взаємодії з бутадієном в присутності сульфур(VI) оксиду
- •Розділ 4. Охорона праці при виконанні дипломної роботи
- •4.1 Правила роботи в лабораторії
- •4.2. Охорона праці при роботі з персональним комп’ютером
- •Фізичні:
- •Психофізіологічні:
- •Експериментальна частина Хлорид n-етилкарбоксифенілдіазонію
- •Ангідрид 1-(n-етилкарбоксифенілсульфоніл)-1,4,5,6-тетрагідрофталевої кислоти
- •Висновки
- •Список використаних джерел
- •Додаток
Додаток
Дані квантово-хімічних розрахунків молекули
1-(п-етилкарбоксифенілсульфоніл)-4-хлоро-2-бутену
Висновки про реакційну здатність органічних сполук, механізми хімічних реакцій можна зробити на основі квантово-хімічних розрахунків молекулярних характеристик молекул, а саме: енергію молекули, геометрію молекули, енергію та форму молекулярних орбіталей, заряди на атомах, розподіл електростатичного потенціалу, дипольний момент.
Тому для пояснення будови синтезованої сполуки 1-(п-етилкарбоксифенілсульфоніл)-4-хлоро-2-бутену проведено квантово-хімічні розрахунки. Оптимізація геометрії досліджуваної молекули проводилась методом самоузгодженого поля Хартрі-Фока в напівемпіричному наближенні параметричного методу 3 (РМ3), що реалізується у програмі Hyper Chem; також були розраховані коливальні частоти і відповідні інтенсивності ІЧ поглинання. Дійсні значення всіх частот коливань вказують на знаходження істинного мінімуму на гіперповерхні повної енергії молекули.
Для характеристики реакційної здатності молекул найчастіше використовують заряди на атомах, довжини зв’язків, енергії граничних молекулярних орбіталей. Найбільший інтерес представляють верхня зайнята і нижня вакантна молекулярні орбіталі (ВЗМО і НВМО), оскільки багато властивостей молекул залежать від виду цих орбіталей. Зокрема, використовуючи теорему Купманса, за значеннями енергії ВЗМО і НВМО можна оцінити перший потенціал іонізації (IM = −EВЗМО), спорідненість до електрону (AM = EНВМО) і енергетичну щілину EНВМО − EВЗМО для молекули, що відображають її донорно-акцепторні і окисно-відновні властивості. Форма вказаних граничних МО дозволяє зробити висновки про механізми органічних реакцій, так як електрофільна атака часто проходить в області найбільших значень ВЗМО, а нуклеофільна − за місцем найбільших значень НВМО. Крім того, дві молекули прагнуть реагувати за місцем найбільшого перекривання ВЗМО і НВМО.
Проведені розрахунки молекули дозволили отримати значення енергій граничних молекулярних орбіталей, довжини та порядки зв’язків, заряди на атомах, значення теплоти утворення та величину повної енергії.
Розрахунок молекулярних характеристик молекули методом РМ3
Властивості |
Сполука* |
Повна енергія, ккал/моль |
–79511.810 |
Електронна енергія, ккал/моль |
–480613.053 |
Енергія відштовхування атомних остовів, ккал/моль |
401101.244 |
Теплота утворення, ккал/моль |
117.553 |
Дипольний момент, D |
4.566 |
Енергія ВЗМО, еВ |
–10.207 |
Енергія НВМО, еВ |
–1.181 |
* 1-(п-етилкарбоксифенілсульфоніл)-4-хлоро-2-бутен;
Будова досліджуваної молекул
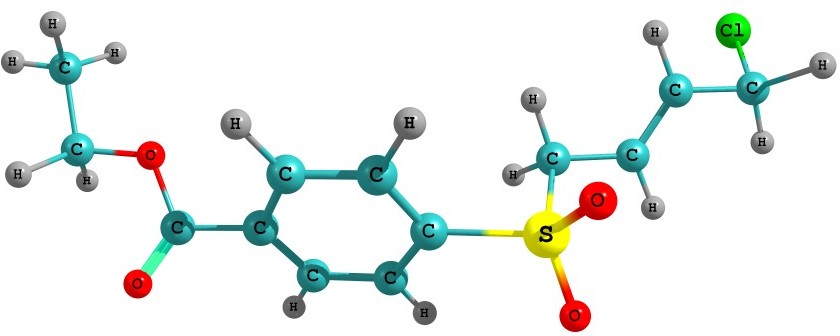
Заряди на атомах
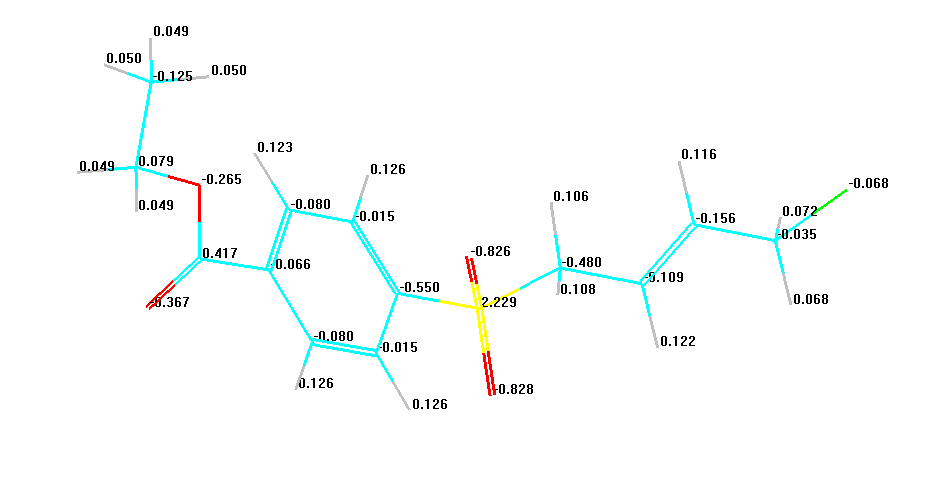
Довжини зв’язків
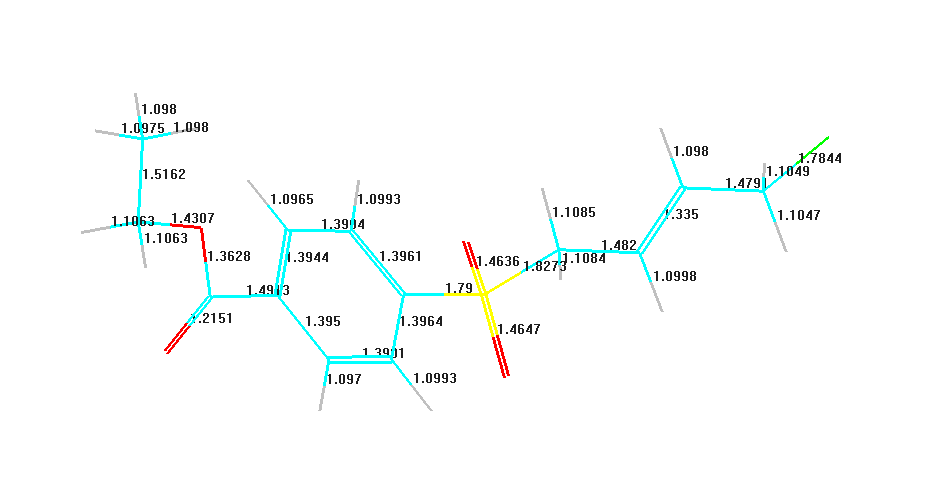
Порядки зв’язків
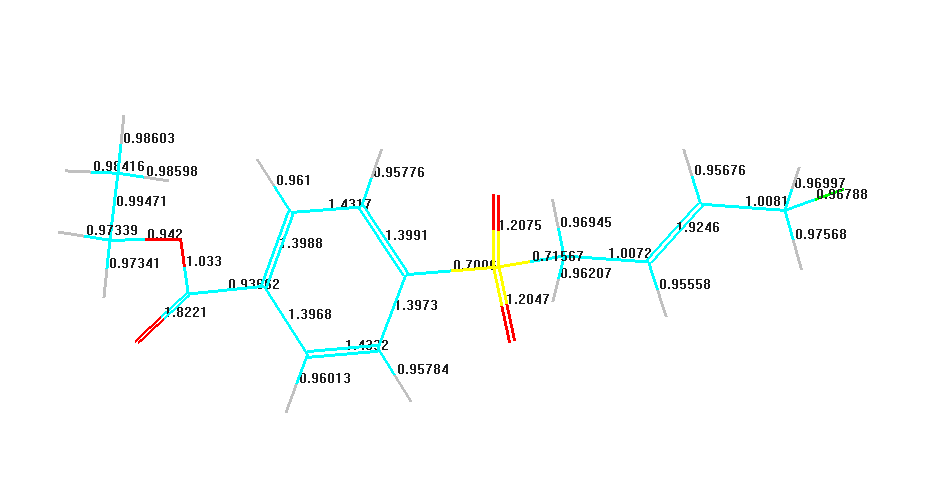
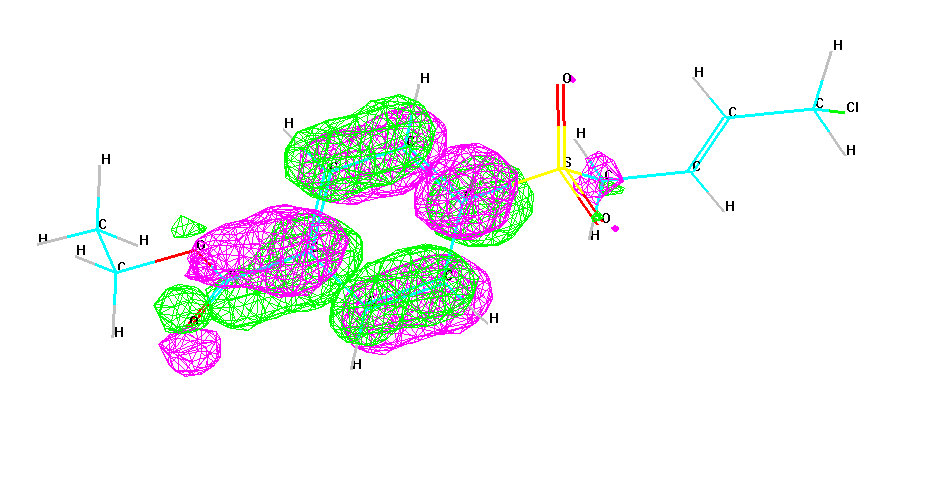
ВЗМО
ВЗМО являє собою π-орбіталь, в якій електронна густина зосереджена на атомах Карбону алільного радикалу та містить великий вклад від атома Хлору і меншою мірою від атомів Оксигену сульфогрупи, що безперечно впливає на механізм хімічної реакції.
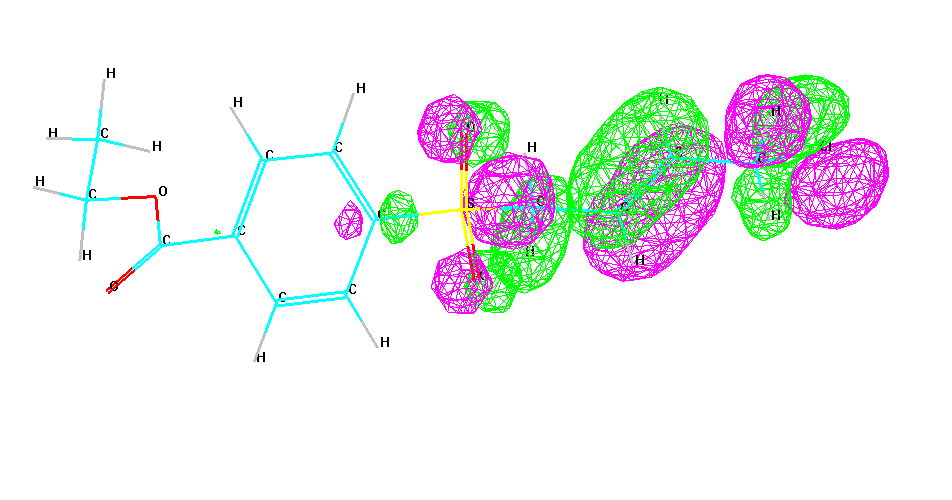
НВМО
Являє собою класичну π-орбіталь молекули бензену.
Отже, розглянувши ВЗМО і НВМО, можна зробити висновок, що атом Хлору в цій молекулі має значну рухливість.
