
1. . Аміак - безбарвний газ з характерним різким запахом і їдким смаком. . Амоніак добре розчинний у воді. Розчинність амоніаку у воді зумовлена утворенням водневим зв’язків між їхніми молекулами.При температурі, нижчій за – 33,4ºС, він переходить у рідкий стан.
Добування. У лабораторії аміак добувають із суміші твея дих речовин — нашатирю NH4Cl і гашеного вапна Са(ОH)2 за рівнянням: 2NH4Cl + Са(ОН)2 = CaCl2+2NH3↑ + 2Н20
2. Хлороводень HCl — одна з найважливіших сполук хлору. Це безбарвний газ із різким запахом, трхи важчий за повітря, дуже добре розчиняється у воді.
В лабораторних умовах хлороводень добувають під час взаємодії хлориду натрію з концентрованою сульфатною кислотою. При цьому утворюються хлороводень і кисла сіль (гідросульфат натрію): NaCl + H2SO4 = HCl↑ + NaHSO4.
3. Аміак — безбарвний газ з характерним різким запахом і їдким смаком. Він майже у два рази легший від повітря. При −33,35°С і звичайному тиску аміак скраплюється в безбарвну рідину, а при −77,75 °C замерзає, перетворюючись у безбарвну кристалічну масу. Його зберігають і транспортують у рідкому стані в стальних балонах під тиском 6—7 атм. У воді аміак розчиняється дуже добре: при 0°С і звичайному тиску в 1 об'ємі води розчиняється близько 1200 об'ємів NH3, а при 20°С — 700 об'ємів. Концентрований розчин містить 25% NH3 і має густину 0,91 г/см3. Розчин аміаку у воді називають аміачною водою або нашатирним спиртом. Звичайний медичний нашатирний спирт містить до 10%: NH3, амічна вода від 10% і більше. При нагріванні розчину аміак легко випаровується.
Хлорово́день (HCl) — безбарвний задушливий газ з різким запахом,Хлорово́день (HCl) — безбарвний задушливий газ з різким запахом, димить на повітрі. Легко розчиняється у воді (500 об'ємів газу у 1 об'ємі води) з утворенням соляної кислоти. Іноді хлороводнем помилково називають соляну кислоту. Хлористий водень складається з двоатомних молекул, кожна з яких складається з Гідрогену і Хлору. Молекула пов'язана ковалентним зв'язком. Так як атом Хлору набагато більш електронегативний, ніж атом Гідрогену, ковалентний зв'язок між двома атомами абсолютно полярний. Отже, молекула має великий дипольний момент з негативним частковим зарядом δ− на атом хлору і позитивний частковий заряд δ+ в атомі водню. Частково через високу полярність, HCl дуже розчинний у воді (і в інших полярних розчинниках). При контакті, H2O і HCl в сукупності утворюють катіон гідроксонію, Н3O+ та хлорид аніон Cl− через оборотну хімічну реакцію: \mathrm{HCl + H_2O\leftrightarrow \ H_3O^+ + \ Cl^-} Отриманий розчин — соляна кислота. Процес розчинення сильно
4. Солі амонію - складні речовини, до складу яких входять катіони амонію NH4 +, пов'язані з кислотним залишком. Фізичні властивості Кристалічні речовини, добре розчинні у воді. Отримання Аміак (або гідроксид амонію) + кислота. NH 3 + HNO 3 → NH 4 NO 3 (нітрат амонію) 2NH 4 OH + H 2 SO 4 → (NH 4) 2SO 4 (cульфат амонію) + 2Н 2 O Хімічні властивості 1. Сильні електроліти (дисоціюють у водних розчинах) NH 4 Cl → NH 4 + + Cl - 2. Розкладання при нагріванні. a) якщо кислота летюча NH 4 Cl (t) → NH 3 + HCl NH 4 HCO 3 → NH 3 + Н 2 O + CO 2 b) якщо аніон виявляє окисні властивості NH 4 NO 3-t → N 2 O + 2Н 2 O (NH 4) 2Cr 2 O 7-t → N 2 + Cr 2 O 3 + 4Н 2 O 3. З кислотами та солями (реакція обміну) a) (NH 4) 2 CO 3 + 2НCl → 2NH 4 Cl + Н 2 O + CO 2 2NH 4 + + CO 32 - + 2H + + 2Cl-→ 2NH 4 + + 2Cl-+ Н 2 O + CO 2 CO 32 - + 2H + → Н 2 O + CO2 b) (NH 4) 2 SO 4 + Ba (NO 3) 2 → BaSO 4 + 2NH 4 NO 3 2NH 4 + + SO 42 - + Ba 2 + + 2NO 3 - → BaSO 4 + 2NH 4 + + 2NO 3 - Ba 2 + + SO 42 - → BaSO 4
4. Солі амонію піддаються гідролізу (як сіль слабкої підстави і сильної кислоти) - середовище кисле: NH 4 Cl + Н 2 O → NH 4 OH + HCl NH 4 + + Н 2 O → NH 4 OH + H + 5. При нагріванні з лугами виділяють аміак (якісна реакція на NH4 +) NH 4 Cl + NaOH (t) → NaCl + NH 3 + Н 2 O
5. -----
6. Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться металічні елементи (до них також належать метали побічних підгруп — d-елементи).За хімічною активністю метали можна розподілити на три групи: високоактивні — калій, натрій, барій, кальцій і ін., середньої активності — цинк, залізо, нікель тощо і малоактивні — срібло, золото і платина. Відносну активність металів можна визначити за положенням елемента в періодичній системі Д. І. Менделєєва: металічний характер елементів і хімічна активність металів посилюється в періодах справа наліво, а в головних підгрупах - згори донизу. Типові металічні елементи перебувають у лівому нижньому куті довгого варіанта періодичної системи.
7. . Металі́чний зв'язо́к — тип хімічного зв'язку, при якому валентні електрони атомів делокалізуються і починають взаємодіяти з атомними остовами усього тіла. При встановленні металічного типу зв'язку з атомів утворюється метал, в якому позитивно заряджені іони занурені в електронний газ. Незважаючи на заряджений стан іонів, взаємодія між ними екранується рухливими електронами, й не поширюється на далекі відстані. металічний зв'язок є багатоцентровим хімічним зв'язком з дефіцитом електронів і базується на узагальненні зовнішніх електронів атомів. Тому він характерний лише для конденсованого стану речовини. У газуватому стані атоми всіх речовин, у тому числі й металів, зв'язані між собою тільки ковалентним зв'язком.
Більшість металів утворює одну з наступних високосиметричних ґраток з щільною упаковкою атомів: кубічну об'ємно центровану, кубічну гранецентрировану і гексагональну. У кубічної об'ємно центрованої ґратки атоми розташовані у вершинах куба і один атом в центрі обсягу куба.
8. Фізичні властивості металів
Той факт, що метали володіють рядом характерних фізичних особливостей пояснюється особливою будовою їхніх кристалічних ґраток, а саме наявністю в них вільних електронів (“електронного газу”).
За звичайних умов всі метали (крім ртуті) - тверді непрозорі речовини сірого кольору з специфічним металевим блиском, що пов'язано з взаємодією вільних електронів з падаючими на метал квантами світла. Деякі метали (магній, алюміній, свинець і ін.) покриваються на повітрі плівкою оксидів і втрачають блиск. При нагріванні до певної температури метали плавляться, а при подальшому нагріванні переходять в пароподібний стан.
Температури плавлення і кипіння певним чином пов'язані з розташуванням металу в періодичній системі. Розташовані на початку кожного періоду метали мають найнижчу температуру плавлення, але із збільшенням порядкового номеру металу в періоді температура плавлення зростає і досягає максимуму в підгрупі Cr. Далі температура плавлення понижується і досягає мінімуму в підгрупі Zn. Самий легкоплавкий метал - ртуть (tпл. = -39 ?C, самий тугоплавкий метал - вольфрам (tпл. = 3390 ?C). Метали з tпл. вище 1000 ?C вважаються тугоплавкими (мідь, залізо, хром, титан, молібден), нижче - легкоплавкими (ртуть, натрій, магній, алюміній).
Електропровідність пояснюється можливістю спрямувати рух вільних електронів від негативного полюса до позитивного під впливом невеликої різниці потенціалів. Найкращий провідник - срібло; з усіх металів тільки германій є напівпровідником. В ряду Ag, Cu, Al, Fe зменшується. При нагріванні електропровідність зменшується, тому що з підвищенням температури підсилюються коливання атомів і іонів у вузлах кристалічних ґраток, що утрудняє спрямований рух "електронного газу".
Теплопровідність обумовлена високою рухливістю вільних електронів і коливальним рухом атомів, завдяки чому відбувається швидке вирівнювання температури по всій масі металу. Закономірність та ж. Найбільша теплопровідність - у бісмуту і ртуті.
Пластичність - це здатність металу під дією зовнішніх сил змінювати форму, яка зберігається і після припинення зовнішніх сил; саме тому метали можна витягувати в дріт, прокатувати в тонкі листки тощо. Пластичність обумовлена тим, що іони в кристалічній гратці можуть зміщуватися один відносно одного під дією зовнішніх факторів. В ряду - Au, Ag, Cu, Sn, Pb, Zn, Fe пластичність зменшується.
Густина. Вона тим менша, чим менша атомна маса металу і чим більшим є радіус його атому (найлегший - літій (с = 0,53 г/см3); найважчий - осмій (с = 22,6 г/см3)). Метали, що мають с < 5 г/см3 вважаються "легкими металами". Типові легкі метали - лужні та лужноземельні, алюміній, магній; важкі - цинк, залізо, мідь свинець, ртуть, золото.
Твердість. Найтвердіший метал - хром (ріже скло); найм'якіші - калій, натрій, рубідій і цезій (ріжуться ножем).
Знаходження в природі
Поширеність елементів-металів у природі різна. Так, вміст в земній корі Al - 7,5 %; Fe - 4,25 %; Ca - 3,25 %. Тобто поширеними є метали з порівняно малими атомними масами. Близько 40 металів не тільки мало поширені (рідкісні), але й розсіяні в земній корі.
В чистому (самородному) вигляді зустрічаються тільки неактивні, головним чином благородні (Au, Ag,Pt, зрідка Hg, Cu).Більшість металів у природі знаходиться у вигляді малорозчинних у воді і стійких до дії повітря сполук, які називають мінералами. Метали в природі найчастіше знаходяться в вигляді оксидів, сульфідів, сульфатів, хлоридів, карбонатів, фосфатів, нітратів та більш складних сполук. Накопичення металовмісних мінералів, що входять до складу гірських порід, з яких технологічно можливо й економічно доцільно вилучати метал, називають рудами. Такі сполуки, як правило, співіснують з великою кількістю інших мінералів, що не містять цей метал (пустою породою).
9. Взаємодія з кислотами
Взаємодія металів з кислотами-неокисниками (НkА) відбувається згідно схеми: + НkА > k(А)n + Н2, тобто ме витісняє Н і при цьому утворюється відповідна сіль металу та виділяється водень. В реакції цього типу вступають тільки метали, що розташовані в електрохімічному ряді напруг до H. Наприклад:
Mg+2HCl MgCl2 + H2(Mg0 + 2H+ Mg2++ H20)
6Na+2H3PO4 2Na3PO4+3H2(6Na0 + 6H+ 6Na+ + 3H20)
Cu+HCl (Cuв ряду активності стоїть справа від Н.
Взаємодія з водою відбувається по-різному в залежності від активності металу
Активні (лужні і лужноземельні метали, магній і алюміній після зняття оксидної плівки) витісняють водень і утворюють розчинні основи згідно схеми +НОН>(ОН)n+Н2. Наприклад:
2Na+2H2O 2NaOH+H2(2Na0 + 2HOH 2Na1+ + 2OH1- + H20)
Ca+2H2O Ca(OH)2+H2(Ca0 + 2HOH Ca2+ + 2OH1- + H20)
2Al+6H2O 2Al(OH)3+3H2(2Al0 + 6HOH 2Al3+ + 6OH1- + 3H20)
Метали середньої активності при високій температурі утворюють оксид (оскільки утворена нерозчинна основа при цій температурі розкладається на оксид і водяну пару) і водень. Наприклад:
Zn+H2O ZnO+H2
Неактивні (золото, срібло, платина) з водою чи водяною парою не реагують.
Взаємодія з сполуками металів. Більш активний метал (Ме1) витісняє (відновлює) менш активний метал (Ме2) а) з його солі в розчині (при звичайній температурі) та б) з оксиду при нагріванні (металотермія) по схемі: Ме1+Ме2(An) Ме1(An) +Ме2. Приклади
а)Cu+HgCl2 Hg+CuCl2(Cu0 + Hg2+ Cu2+ + Hg0)
Fe+CuSO4 Cu+FeSO4(Fe0 + Cu2+ Cu0 + Fe2+)
10. Корозією називають мимовільне руйнування металів і сплавів під впливом навколишнього середовища.
Яскравий приклад корозії ― іржа на поверхні сталевих і чавунних виробів. Щорічно через корозію втрачають біля чверті всього виробленого у світі заліза.
Найбільш активними компонентами навколишнього середовища, які діють на метали, є кисень О2, водяна пара Н2О, карбон(IV) оксид СО2, сульфур(IV) оксид SО2, нітроген(IV) оксид NО2. Наприклад, корозії заліза можна схематично описати таким рівнянням:
4Fe + 6H2O + 3O2 → 4Fe(OH)3.
Зупинити корозію неможливо, але її можна сповільнити. Існує багато способів захисту металів від корозії, але основним прийомом є запобігання контакту заліза з повітрям. Для цього металеві вироби фарбують, покривають лаком або вкривають шаром мастила.
11. ------
12-------
13. . У природі чистої води не буває: вона завжди містить домішки яких-небудь речовин. Зокрема, взаємодіючи із солями, що містяться в земній корі, вона набуває певної твердості.
Твердість води — сукупність властивостей, зумовлених вмістом у воді катіонів кальцію Са2+ і катіонів магнію Мg2+. Якщо концентрація цих катіонів велика, то воду називають твердою, якщо мала — м’якою. Саме вони надають специфічних властивостей природним водам. Під час прання білизни у твердій воді погіршується якість тканин і підви щуються витрати мила, необхідного на зв’язування катіонів Са2+ і Мg2+:
2С17Н35СОO- + Са2+ = (С17Н35СОО)2 Са↓;
2С17Н35СОО- + Мg2+ = (С17Н35СОО)2 Мg↓,
і піна утворюється лише після повного осадження цих катіонів. Щоправда, деякі синтетичні мийні засоби добре миють і у твердій воді, оскільки їх кальцієві і магнієві солі легко розчиняються. У твердій воді погано розварюються харчові продукти, а зварені у ній овочі несмачні. Дуже погано заварюється чай, і смак його втрачається. Водночас у санітарно-гігієнічному відношенні ці катіони не є небезпечними, хоча при високому вмісті катіонів Мg2+ (як у морі чи океані) вода гіркувата на смак і виявляє послаблюючу дію.
Тверда вода непридатна для використання у парових котлах: розчинені у ній солі під час кип’ятіння утворюють на стінках котлів шар накипу, який погано проводить теплоту. Це призводить до перевитрат палива, передчасного зносу котлів, а іноді, внаслідок перегрівання котлів, і до аварії. Твердість води шкідлива для металевих конструкцій, трубопроводів, кожухів охолоджуваних машин.
Катіони кальцію Са2+ зумовлюють кальцієву твердість, а катіони Мg2+ — магнієву твердість води. Загальна твердість складається з кальцієвої і магнієвої, тобто із сумарної концентрації у воді катіонів Са2+ і Мg2+.
Відносно процесів зм’якшення води розрізняють твердість карбонатну і некарбонатну. Карбонатною називається твеpдість, зумовлена наявністю тієї частини катіонів Са2+ і Mg2+, яка еквівалентна гідрокарбонатним іонам НСО-3, що містяться у воді. Іншими словами, карбонатна твердість спричинена наявністю гідрокарбонатів кальцію і магнію. Під час кип’ятіння гідрокарбонати руйнуються, а малорозчинні карбонати, що утворюються, випадають в осад, і загальна твердість води зменшується на значення карбонатної твердості. Тому карбонатну твердість називають також тимчасовою твердістю. Під час кип’ятіння катіони Са2+ осідають у вигляді карбонату кальцію:
Са2+ + 2НСO-3 = СаСО3 ↓ + Н2О + СO2,
а катіони магнію Mg — у вигляді основного карбонату або у вигляді гідроксиду магнію (при pH > 10,3):
2Мg2+ + 2НСО-3 + 2OН- = (МgОН)2 СО3 ↓ + Н2О + СО2
(гідроксид-іони ОН утворюються за рахунок взаємодії іонів НСО- з водою: НСО-3 + Н2О ⇆ Н2СО3 + ОН ).
Та частина твердості, що зберігається після кип’ятіння води, називається некарбонатною. Вона визначається вмістом у воді кальцієвих і магнієвих солей сильних кислот, переважно сульфатів і хлоридів. Під час кип’ятіння ці солі не видаляються, а тому некарбонатну твердість називають також постійною твердістю.
Розглянемо кількісну характеристику твердості води. Ступінь твердості води виражається по-різному. У нашій країні її виражають числом міліеквівалентів (мекв) катіонів Са2+ і Мg2+, які містяться в 1 л води. Оскільки 1 мекв твердості відповідає вмісту 20,04 мг/л катіонів С2+а або 12,16 мг/л катіонів Мg2+, то, згідно з визначенням, загальну твердість води Т (мекв/л) можна обчислити за формулою:
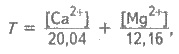
де [Са2+ ] і [Mg2+ ] — концентрації іонів Са2+ і Mg2+ , мг/л.
За значенням твердості природну воду розрізняють як дуже м’яку — з твердістю до 1,5; м’яку — від 1,5 до 4; середньої твердості — від 4 до 8; тверду — від 8 до 12 і дуже тверду — понад 12 мекв/л.
Твердість води господарсько-питних водопроводів не повинна перевищувати 7 мекв/л (ГОСТ 2874—82).
Дуже часто тверду воду перед використанням зм’якшують. Звичайно цього досягають обробкою води різними хімічними речовинами. Так, карбонатну твердість можна усунути додаванням гашеного вапна:
Са2+ + 2НСО-3 + Са2+ + 2OН- = 2СаСО3↓+ 2Н2О;
Мg2+ + 2НСО-3 + 2Са2+ + 4OН- = Мg(ОН)2↓ + 2СаСО3 і + 2Н2O.
При одночасному додаванні вапна і соди можна позбутися карбонатної і некарбонатної твердості (вапняно-содовий спосіб). Карбонатна твердість при цьому усувається вапном (див. вище), а некарбонатна — содою:
Са2+ + С02-3 = СаСО3↓; Мg2+ + СO2-3 = МgСО3
і далі
МgСО3 + Са2+ + 2OН- = Мg(ОН)2 ↓ + СаСО3 ↓.
Застосовують й інші способи усунення твердості води, серед яких один з найсучасніших ґрунтується на застосуванні катіонітів (катіонітний спосіб). Є такі тверді речовини, які містять у своєму складі рухливі іони, здатні обмінюватися на іони зовнішнього середовища. Вони дістали назву іонітів. Особливо поширені іонообмінні смоли, які добувають на основі синтетичних полімерів.
Іоніти (іонообмінні смоли) поділяють на дві групи. Одні з них обмінюють свої катіони на катіони середовища і називаються катіонітами, інші обмінюють свої аніони і називаються аніонітами. Іоніти не розчиняються у розчинах солей, кислот і лугів.
Катіоніти мають вигляд чорних або темно-бурих зерен діаметром від 0,5 до 2 мм (КУ-1, КУ-2, СБС та інші), аніоніти — зернисті речовини білого, рожевого або коричневого кольору (АВ-16, АВ-17, АН-2Ф та інші).
Для усунення твердості води застосовують катіоніти — синтетичні іонообмінні смоли і алюмосилікати, наприклад Na2 [Аl2Sі2О8 ∙ nН2O]. їх склад умовно можна виразити загальною формулою Na2R, де Na — досить рухливий катіон і R2 — частинка катіоніту, що несе від’ємний заряд. Так, у наведеному прикладіR2 = [Al2Si2O8 ∙ nН2O]2- .
Якщо пропускати воду крізь шари катіоніту, то іони натрію будуть обмінюватися на іони кальцію і магнію. Схематично ці процеси можна виразити рівняннями:
Са2++ Na2R =2Na+ + CaR;
Mg2++ Na2R = 2Na+ + MgR.
Отже, іони кальцію і магнію переходять з розчину в катіоніт, а іони натрію — з катіоніту в розчин; твердість при цьому усувається.
Після використання більшої частини іонів натрію катіоніти звичайно регенерують — витримують у розчині хлориду натрію, за участю якого відбувається зворотний процес: іони натрію заміщують у катіоніті іони кальцію і магнію, які переходять у розчин:
CaR + 2Na+ = Na2R + Са2+; MgR + 2Na+ = Na2R + Mg2+.
Регенерований катіоніт знову можна використовувати для зм’якшення нових порцій твердої води.
14. . Алюміній — метал III групи другого періоду в Періодичній системі системе хімічних елементів Д.І.Менделєєва. Алюміній у сполуках виявляє ступінь окиснення +3, так як має на зовнішньому енергетичному рівні 3 валентних електрони.
Фізичні властивості Алюмінію: Алюміній – сріблясто-білий метал, легкий і пластичний, густина його = 2,7 г/см3, температура плавлення = 660 0С. Легко витягується в дріт, прокочується у фольгу. За електропровідністю поступається лише сріблу й міді. Входить до складу легких сплавів.
Хімічні властивості лужних металів.
Одержують Алюміній електролізом Al2O3 у розплавленому кріоліті за температури близько 1000 0С.
Взаємодія з неметалами:
1) З киснем:
4Аl + 3О2 = 2Аl2О3
2) З галогенами: 2Аl + ЗВr2 = 2АlВr3
3) З іншими неметалами при підвищенні температури:
2Аl + 3S = Аl2S3 (сульфід алюмінію) 2Аl + N2 = 2АlN (нітрид алюмінію) 4Аl + 3С = А14С3 (карбід алюмінію)
15. -----
16. . Фізичні властивості
Залізо — блискучий сріблясто-білий важкий метал. Густина його 7,86 т/м³; температура плавлення 1538 °C, температура кипіння 2862 °C. Залізо досить пластичне. Воно легко кується, штампується, витягується в дріт і вальцюється в тонкі листи, легко намагнічується і розмагнічується. Вище температури Кюрі (770 °C) втрачаєферомагнітні властивості. До температури 912 °C існує в алотропній модифікації α-заліза з об'ємноцентрованою кубічною кристалічною ґраткою, за вищої температури — γ-заліза із гранецентрованою кубічною ґраткою, вище 1394 °C знову змінює тип ґратки на об'ємноцентровану кубічну (δ-залізо).
Хімічні властивості
Ферум належить до восьмої групи періодичної системи елементів Менделєєва. Його атоми на зовнішній електронній оболонці мають по два електрони, а на передостанній — 14 електронів. Атоми феруму можуть легко втрачати два електрони і перетворюватись у двовалентні катіони Fe2+. Вони можуть втрачати і три електрони (один з передостанньої оболонки) і перетворюватись у тривалентні катіони Fe3+. Таким чином, залізо утворює два ряди сполук. Сполуки тривалентного феруму стійкіші.
У сухому повітрі за звичайної температури залізо досить стійке, але у вологому швидко іржавіє, вкриваючись товстим шаром іржі. Іржа є сумішшю оксидів і гідроксидівферуму. Основну частину іржі складає сесквіоксид заліза Fe2O3 і тригідроксид заліза Fe(OH)3. Крім того, до її складу входить монооксид заліза FeO, дигідроксид залізаFe(OH)2 та інші сполуки. Процес ржавіння заліза можна зобразити такими приблизними рівняннями:
2Fe + O2 + 2Н2О = 2Fe(OH)2
4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
17. Металічні корисні копалини-– природні мінеральні утворення, з яких доцільно вилучати метали та їх сполуки.
Найпоширенішими є руди:
залізні,
алюмінієві,
манґанові,
олов’яні,
срібні,
ртутні,
титанові,
цинкові.
Одержання металів з руд
В більшості випадків руди містять різні домішки у вигляді піску, глини, вапняку тощо. Ці домішки називають пустою породою. Коли в руді багато пустої породи, тобто коли руда є бідною на корисну речовину, таку руду піддають збагаченню, тобто видаляють з неї частину пустої породи. Різні руди збагачують різними способами.
Для збагачення сульфідних руд звичайно застосовують спосіб флотації (спливання). При цьому способі руду розмелюють у тонкий порошок і заливають у великих чанах водою. До води додають певні органічні речовини (наприклад, соснове масло, вищі жирні кислоти тощо), молекули яких добре адсорбуються частинками сульфідів, і вкривають їх тонкою плівкою, внаслідок чого вони не змочуються водою. Крізь воду продувають повітря, пухирці якого з маслом утворюють піну, а також прилипають до частинок сульфідів, і вони спливають та збираються зверху разом з піною, а змочені водою частинки пустої породи осідають на дно (див. мал. Схема флотаційного апарату). Піну з сульфідами металів зливають з чану і віджимають сульфіди. Так одержують збагачену на корисну речовину руду.
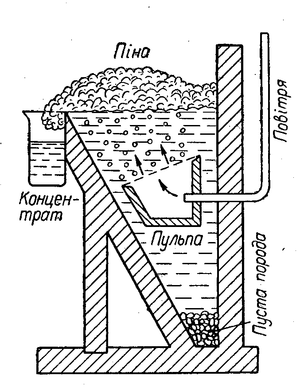
![]()
Схема флотаційного апарату
Вільні метали добувають з руд різними способами. З оксидних руд метали одержують відновленням їх за високих температур. При цьому як відновник частіше всього використовують вугілля (кокс) і монооксид вуглецю СО. Наприклад:
Fe2O3 + 3C = 2Fe + 3CO ↑
Fe2O3 + 3CO = 2Fe + 3CO2 ↑
SnO2 + C = Sn + CO2 ↑
2Cu2O + C = 4Cu + CO2 ↑
Інколи відновником служать активні метали. Наприклад, при добуванні хрому, берилію, мангану та інших як відновник застосовують алюміній (алюмінотермія):
Cr2O3 + 2Al = 2Cr + Al2O3
3MnO2 + 4Al = 3Mn + 2Al2O3
У деяких випадках як відновник використовують водень, зокрема, при добуванні молібдену, вольфраму, порошкоподібного заліза тощо:
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
Сульфідні руди спочатку обпалюють, переводячи їх в оксиди металів, які потім відновлюють. Наприклад:
2PbS + 3O2 = 2PbO + 2SO2 ↑
PbO + C = Pb + CO ↑
Найактивніші метали — калій, натрій, кальцій та інші — не можна одержати способом хімічного відновлення їх сполук. Ці метали одержують лише електролізом їх розплавлених солей. Наприклад:
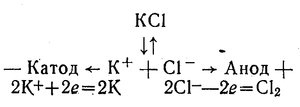
35
У техніці найбільшого застосування набули залізо, алюміній, мідь, свинець, цинк, олово, нікель. Вони ще мають назву «технічні метали».
Сплави металів
Металевими сплавами називають речовини, які складаються не менше, як з двох компонентів і одним з них обов’язково повинен бути метал. Сплави металів відіграють велику роль, так як вони мають вищі механічні і технологічні властивості, ніж їхні складові компоненти - чисті метали. Компонентами називають хімічні елементи або їх сполуки у складі сплаву. За кількістю компонентів сплави поділяють на подвійні, потрійні і т.д.
У техніці найчастіше застосовуються сплави на основі заліза (чавун, сталь) і сплави кольорових металів на основі міді (латунь, бронза), алюмінію (силумін,дюралюміній), свинцю, цинку, олова, нікелю. Деякі сплави створюють на основі вольфраму, титану, ванадію, молібдену й інших металів.
Залежно від природи компонентів, з яких складається сплав, розрізняють наступні різновидності сплавів:
механічна суміш компонентів — ці суміші неоднорідні, вони є найдрібнішою сумішшю кристалітів компонентів;
необмежений твердий розчин компонентів — однорідний, може утворюватися за різного співвідношення компонентів;
обмежений твердий розчин компонентів — однорідний, може утворюватися за різного, але обмеженого співвідношення компонентів;
хімічна сполука компонентів — однорідний, може утворюватися за чітко визначеного співвідношення компонентів.
У твердих розчинах атоми розчиненої речовини заміщують атоми розчинника у кристалічній ґратці або проникають у неї; хімічні сполуки утворюють нову відмінну кристалічну ґратку. Після кристалізації сплаву утворюється або одна фаза (твердий розчин, хімічна сполука), або сплав, який містить суміш фаз. Фазою називають однорідну частину системи, відділену від інших складових (фаз) поверхнею поділу.
В основі структури металів лежить кристалічна решітка з позитивних іонів, занурена в щільний газ рухомих електронів. Ці електрони компенсують сили електричного відштовхування між позитивними іонами і тим самим пов'язують їх у тверді тіла. Такий тип хімічного зв'язку називають металевої зв'язком. Вона зумовила найважливіші фізичні властивості металів: пластичність, електропровідність, теплопровідність, металевий блиск.
Пластичність - це здатність металів змінювати форму при ударі, прокочується в тонкі листи і витягатися в дріт. При цьому відбувається зміщення атомів і іонів кристалічної решітки, однак зв'язку між ними не розриваються, тому що відповідно переміщуються і електрони, що утворюють зв'язок. Пластичність металів зменшується в ряді Au, Ag, Cu, Sn, Pb, Zn. Fe. Золото, наприклад, можна прокатувати бляхи товщиною до 0,003 мм, які використовують для золочення.
З інших фізичних властивостей металів найбільший практичний інтерес представляють щільність, температура плавлення і твердість. Найлегший з металів - літій (щільність 0,53 г/см3), найважчий - осмій (22,6 г/см3). Метали з щільністю менше 5 г/см 3 називаються легенями, решта - важкі. Температури плавлення металів розрізняються дуже сильно: цезій і галій можна розплавити теплом долонь, а температура плавлення вольфраму 3410 ° С. При звичайних умовах єдиний рідкий метал - ртуть. У пароподібному стані всі метали одноатомних, їх кристалічна решітка руйнується. Метали розрізняються за твердістю. Самий твердий з них - хром - ріже скло, а найм'якші - калій, рубідій і цезій - легко ріжуться ножем. Міцність, температура плавлення і твердість залежать від міцності металевої зв'язку. Вона особливо велика в важких металів.
Хімічні властивості металів визначаються слабкою зв'язком валентних електронів з ядром атома. Атоми порівняно легко віддають їх, перетворюючись при цьому в позитивно заряджені іони. Тому метали є гарними відновлювачами. У цьому їхня головна і найбільш загальне хімічна властивість.
Очевидно, як відновлювачі метали повинні вступати в реакції з різними окислювачами, серед яких можуть бути прості речовини (неметали), кислоти, солі менш активних металів і деякі інші речовини. Сполуки металів з киснем називаються оксидами, з галогенами - галогенидами, з сірою - сульфідами, з азотом - нітриду, з фосфором - фосфіду, з вуглецем - борид, з воднем - гідриди тощо. Багато хто з цих сполук знайшли важливе застосування в техніці.
