
- •Глава 11 измерения концентрации
- •§ 11.1. Теоретические основы анализа состава бинарных и псевдобинарных смесей жидкостей и газов
- •§ 11.2. Термокондуктометрические газоанализаторы
- •§ 11.3. Диффузионные газоанализаторы
- •§ 11.4. Магнитные газоанализаторы
- •§ 11.5. Сорбционные газоанализаторы
- •§ 11.6. Испарительные и конденсационные анализаторы
- •§ 11.7. Диэлькометрические анализаторы
- •§ 11. 8. Оптические анализаторы, в работе которых используется излучение видимой части спектра
- •§ 11.9. Абсорбционные ультрафиолетовые и инфракрасные анализаторы
- •§ 11.10. Ионизационные газоанализаторы
- •§ 11.11. Термохимические анализаторы
- •§ 11.12. Электрокондуктометрические анализаторы
- •§ 11.13. Потенциометрические анализаторы
- •§ 11.14. Электролизные анализаторы
- •§ 11.15. Пламенные ионизационные и фотометрические газоанализаторы
- •§ 11.16. Хемилюминесцентные газоанализаторы
- •§ 11.17. Системы автоматического контроля загрязнений окружающей среды
§ 11.13. Потенциометрические анализаторы
Принцип действия потенциометрических анализаторов, относящихся к электрохимическим средствам измерений, основан на измерении потенциала электрода, размещенного в электролите, по которому определяется концентрация определяемого компонента анализируемого вещества.
В настоящее время Потенциометрические анализаторы используются для измерения концентраций различных ионов в жидкостях (ионометрия), для контроля окислительно-восстановительного (редокс) потенциала (редоксметрия), а также в газовом анализе.
В силу того что электродный потенциал непосредственно измерить нельзя, его измеряют косвенным путем по ЭДС гальванического элемента (рис. 11.18), составленного из измерительного (индикаторного) электрода 1 и сравнительного (вспомогательного или опорного) электрода 2. Оба электрода погружены в исследуемый электролит, например анализируемую жидкость, протекающую через ячейку 3. Потенциал измерительного электрода ЕИ изменяется при изменении концентрации ионов в анализируемой среде, а потенциал сравнительного электрода ЕСР остается постоянным, так как он не зависит от концентрации ионов в анализируемой среде. ЭДС такого гальванического элемента Е определяется разностью потенциалов измерительного и сравнительного электродов:
Е = ЕИ – ЕСР. (11.45)
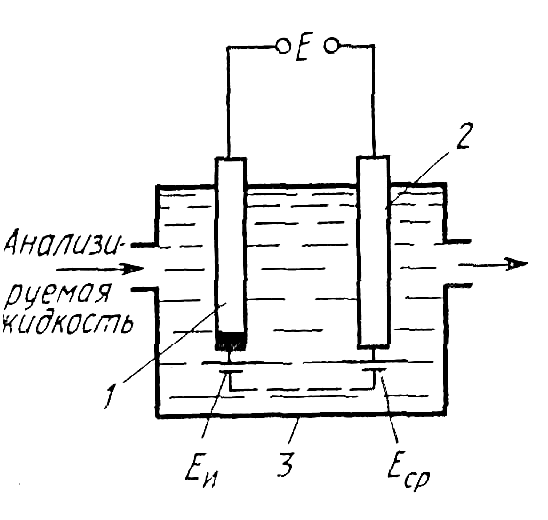
Рис. 11.18. Схема гальванического элемента (ячейки) потенциометрических анализаторов
Измерение этой ЭДС при постоянном потенциале ЕСР позволяет получить информацию о концентрации определяемых ионов в анализируемой жидкости или о ее окислительно-восстановительных свойствах.
Для получения однозначной связи между ЭДС гальванического элемента и концентрацией определяемого иона измерительный электрод должен обладать селективностью к этому иону и не реагировать на изменение концентраций других ионов, содержащихся в анализируемой жидкости. На практике это требование трудно реализуемо, а потенциометрические анализаторы успешно применяются в основном в автоматическом контроле бинарных и псевдобинарных жидкостей.
В потенциометрии при создании гальванических элементов и электродов используются следующие потенциалы: электродный, возникающий при погружении металлических электродов в раствор их ионов; мембранный, возникающий на мембранах, обладающих селективной проницаемостью для одного типа ионов (полупроницаемые мембраны) и разделяющих два одинаковых раствора, содержащих эти ионы в различных концентрациях; окислительно-восстановительный (редокс-потенциал), устанавливающийся на инертных металлических электродах, помещенных в раствор окислительно-восстановительных веществ; диффузионный, возникающий в месте контакта двух растворов одного и того же вещества, обладающих разной концентрацией, или между двумя растворами разных веществ.
Потенциал металлического электрода, погруженного в раствор, содержащий ионы того же металла, из которого изготовлен электрод, описывается уравнением Нернста, полученным для разбавленных растворов в предположении, что поведение ионов в них подчиняется законам для идеальных газов:
![]() ,
(11.46)
,
(11.46)
где Е0 — нормальный (стандартный) потенциал электрода, имеющий место при погружении его в раствор собственных ионов с концентрацией, равной 1 (1 грамм-ион віл); R — универсальная газовая постоянная; Т — абсолютная температура; n — валентность металла; F — постоянная Фарадея; сМе++ - концентрация ионов металла в растворе (в грамм-ионах в 1л).
В общем случае вместо понятия концентрации при определении электродного и других потенциалов используют понятие активной (эффективной) концентрации (активности) аМе++, которая отражает тот факт, что с увеличением концентрации ионов в растворе за счет их взаимного влияния в образовании электродного потенциала принимает участие лишь часть из них. Тогда уравнение (11.46) запишем так:
![]() (11.47)
(11.47)
Между активностью аМе++ и концентрацией сМе++ существует
зависимость:
аМе++ = ƒа сМе++, (11.48)
где ƒа — коэффициент активности.
Разность потенциалов, возникающая на полупроницаемой мембране, разделяющей два раствора, описывается выражением
![]() ,
(11.49)
,
(11.49)
где а1 и а2 — активная концентрация или концентрация (для разбавленных растворов) ионов, для которых мембрана обладает селективной проницаемостью, в первом и втором растворах.
Появление указанной разности потенциалов связано с тем, что при наличии разности активных концентраций растворов ионы, селективно проникающие через мембрану, перемещаются через последнюю в направлении раствора с меньшей активной концентрацией до тех пор, пока постепенно возрастающая при этом разность потенциалов на мембране не достигнет значения, достаточного для прекращения перемещения этих ионов.
Окислительно-восстановительный потенциал, являющийся мерой окислительной или восстановительной способности раствора, возникает на электродах, металл которых не принимает участия в электродных процессах, а лишь обменивается электронами с компонентами окислительно-восстановительной реакции, протекающей в растворе. При этом электрод принимает потенциал, соответствующий равновесию этой реакции, описываемый выражением
![]() ,
(11.50)
,
(11.50)
где Е'0 — стандартный окислительно-восстановительный потенциал; а0х и aRd — активная концентрация окислительных (Ох) и восстановительных (Rd) ионов в растворе.
Значение упомянутого диффузионного потенциала зависит от природы соприкасающихся растворов, их концентраций, скорости истечения и других факторов.
В настоящее время известно большое число конструкций электродов для потенциометрии. На рис. 11.19 приведены наиболее распространенные схемы измерительных (рис. 11.19, а — г) и сравнительного (рис. 11.19, д) электродов.
Наиболее широкое применение в практике аналитического контроля химико-технологических процессов имеют так называемые ионоселективные электроды (рис. 11.19, а—в) [25]. Характерной особенностью ионоселективных электродов является то, что в электродных реакциях не участвуют электроны, а основной является реакция обмена ионами между растворами, разделенными мембраной, обладающей селективной проницаемостью для одного типа ионов. Если в выражении (11.49), описывающем разность потенциалов на мембране, принять, что активная концентрация а1 является измеряемой величиной (первый раствор, омывающий мембрану, является анализируемой жидкостью) и для некоторого i-го иона, находящегося в анализируемой жидкости, a1 = ai, а активная концентрация а2 этого же иона во втором растворе постоянна и равна аiст, т. е. в качестве второго раствора используется некоторое стандартное вещество, то (11.49) можно преобразовать к виду
![]() =
=![]() , (11.51)
, (11.51)
г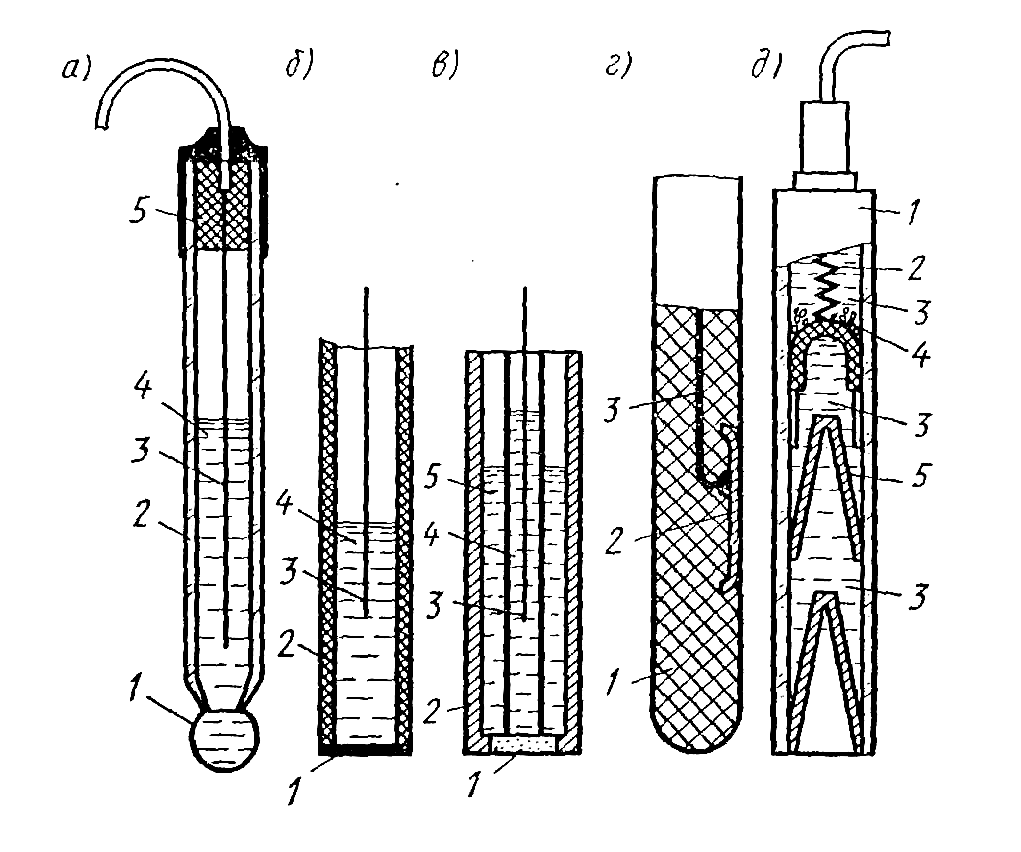 де
де
![]() -
постоянный потенциал.
-
постоянный потенциал.
Рис. 11.19. Конструкции измерительных и сравнительных электродов потенциометрических анализаторов жидкостей
Выражение (11.51) описывает потенциал ионоселективного электрода при наличии в анализируемой жидкости только одного типа ионов того же знака и заряда, что и i-й ион, или в идеальном случае при наличии других ионов в анализируемом растворе. В общем случае потенциал ионоселективного электрода при наличии в анализируемой жидкости j-го иона того же знака и заряда, что и i-й ион, описывается уравнением Никольского
![]() ,
(11.52)
,
(11.52)
где Kij — коэффициент селективности электрода, служащего для определения і-го иона, к j-му; аj — активная концентрация j-го иона в анализируемой жидкости.
Из выражения (11.52) следует, что для селективного измерения активной концентрации i-гo иона необходимо в общем случае иметь
Kij «1.
Одним из наиболее распространенных ионоселективных электродов является стеклянный электрод (рис. 11.19, а), который применяется для измерения активной концентрации ионов водорода Н+ и ионов натрия Na+. Корпус стеклянного электрода представляет собой стеклянную трубку 2, к нижнему концу которой припаяна мембрана 1 (сферическая, конусообразная или плоская) толщиной 0,06—0,1 мм, изготовленная из специальных сортов стекла. Верхний конец трубки закрыт пробкой 5. Внутренняя полость трубки заполнена жидкостью 4 (обычно раствором 0,1 н. НСl с кристаллами AgCl), называемой приэлектродной. Она выполняет функцию стандартного вещества и имеет постоянную активную концентрацию определяемого иона. В указанную" жидкость погружен вспомогательный электрод 3 (контактный полуэлемент), представляющий собой серебряную проволочку, покрытую AgCl или AgBr (хлорсеребряный или бромсеребряный электроды).
Стекло мембран обычно состоит из оксидов элементов III и V групп периодической системы (например, Al, Si) и оксидов элементов I и II групп (например, Na, Ca) и имеет трехмерную решетку, в которой наиболее подвижными переносчиками зарядов являются однозарядные катионы, что определяет селективную проницаемость стеклянных мембран для этих ионов. Способность стеклянных электродов избирательно реагировать на активную концентрацию ионов водорода и натрия достаточно хорошо изучена. Однако единой теории, объясняющей природу этих свойств, пока нет. Обычно это свойство объясняется либо проницаемостью стекла для ионов водорода Н+, либо адсорбцией ионов Н+ на поверхности. Электрическое сопротивление стеклянных электродов, определяемое сопротивлением их мембраны, велико и составляет 100—1000 МОм, что делает необходимым использование для измерения электродного потенциала измерительных устройств с высоким входным сопротивлением.
Кроме электродов со стеклянными мембранами в настоящее время в практику аналитического контроля широко внедряются ионоселективные электроды с твердыми и жидкими мембранами.
На рис. 11.19, б приведена схема ионоселективного электрода с твердой мембраной. Он содержит корпус 2 из электроизоляционного материала, вспомогательный электрод 3, погруженный в приэлектродную жидкость 4, и твердую мембрану 1. Различают электроды с твердыми гомогенными (от греч. homogenes — однородной) и гетерогенными (неоднородными) (от греч. heteros — другой и genos — род) мембранами. Твердые гетерогенные мембраны изготавливают из кристаллических соединений, обладающих ионной проводимостью. В процессе переноса заряда через такую мембрану участвует только один ион кристаллической решетки, имеющий наименьший радиус и наименьший заряд. Распространенным электродом такого типа является электрод с мембраной из фторида лантана LaF3, который обладает высокой селективностью к ионам фтора и поэтому широко применяется для контроля их активной концентрации в растворах. Электроды с твердыми гомогенными мембранами применяются также для измерения активных концентраций ионов Ag+, S+, Cu2+, Pb2+, Cd2+ и др.
Твердые гетерогенные мембраны изготавливают из связующего вещества — инертной матрицы (парафин, коллодий, поливинилхлорид, полистирол, полиэтилен, силиконовый каучук), в которой закреплено активное вещество.
В качестве активных веществ используются в основном труднорастворимые соли металлов: оксаллат и стеарат кальция, сульфат бария, тетрафенилборат калия, соли фтора, галогениды серебра и др. Для рассматриваемых мембран характерна пористая структура, чем объясняется эффект их избирательной проницаемости. На рис. 11.20 показаны схемы пор различного диаметра катионообменной мембраны. Фиксированные анионы в порах мембран, заполненных водой, электростатически взаимодействуют с имеющимися в ней ионами. У поверхности пор образуются диффузионные двойные электрические слои ДЭС (рис. 11.20, а) с анионами, фиксированными в порах мембран, и катионами у поверхности. При значительном диаметре пор основное их пространство заполнено анионами и катионами, содержащимися в растворах, разделенных мембраной.
В порах меньшего размера (рис. 11.20, б) число анионов меньше числа катионов, при некотором еще меньшем значении диаметра пор (рис. 11.20, в) в них полностью отсутствуют ионы, имеющие тот же знак, что и ионы, фиксированные в порах мембраны. Поэтому электрический контакт между жидкостями, разделяемыми мембранами, имеющими такие поры, осуществляется только посредством ионов, имеющих знак, противоположный знаку ионов, фиксированных в порах мембраны (в рассматриваемом случае посредством катионов).
В настоящее время разработано большое число ионоселективных электродов с гетерогенными твердыми мембранами, которые позволяют с достаточной во многих практически важных случаях избирательностью измерять концентрацию ионов К+, Na+, Ca2+, Ва2+ Ni2+, (Са2+ + Mg2+), Cd2+, F- Сl- Вг- NO3-, CN-, СlO4-, I-, S042- и др.
К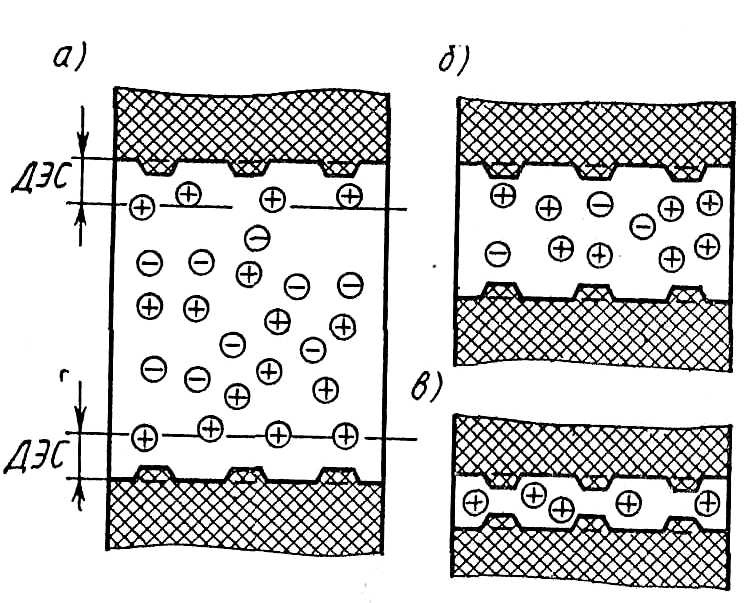 онструкция
ионоселективного электрода с жидкой
мембраной показана на рис. 11.19, в. Отличие
такого электрода от рассмотренных
состоит в том, что он содержит пористую
или целлюлозную мембрану 1, которая
пропитывается жидким органическим
ионитом 5, проникающим в ее поры. Все
остальные элементы на рис. 11.19, д имеют
такое же назначение, что и для рассмотренных
уже электродов. Органический ионит не
смешивается с разделяющими его
анализируемым водным раствором и
приэлектродной жидкостью 4. Селективность
жидких мембран определяется тем, что
ионы определяемого компонента,
содержащиеся в органическом ионите,
гидрофильны, т. е. способны взаимодействовать
с анализируемым водным раствором и
переходить в него, а противоионы
органического ионита гидрофобны и
поэтому не способны переходить из ионита
в анализируемую водную среду.
онструкция
ионоселективного электрода с жидкой
мембраной показана на рис. 11.19, в. Отличие
такого электрода от рассмотренных
состоит в том, что он содержит пористую
или целлюлозную мембрану 1, которая
пропитывается жидким органическим
ионитом 5, проникающим в ее поры. Все
остальные элементы на рис. 11.19, д имеют
такое же назначение, что и для рассмотренных
уже электродов. Органический ионит не
смешивается с разделяющими его
анализируемым водным раствором и
приэлектродной жидкостью 4. Селективность
жидких мембран определяется тем, что
ионы определяемого компонента,
содержащиеся в органическом ионите,
гидрофильны, т. е. способны взаимодействовать
с анализируемым водным раствором и
переходить в него, а противоионы
органического ионита гидрофобны и
поэтому не способны переходить из ионита
в анализируемую водную среду.
Рис. 11.20. Схемы мембранных пор с фиксированными зарядами на поверхности
Ионоселективные электроды обеспечивают измерение концентрации от 10-6 до нескольких моль/л и имеют электрическое сопротивление в пределах 0,02—40 МОм.
Конструкция металлического электрода, используемого в потенциометрических измерениях и, в частности, для контроля окислительно-восстановительного потенциала, показана на рис. 11.19, г. На пластмассовом корпусе 1 укреплена полоска 2 из благородного металла (золото, платина, серебро, иридий), к которой припаян проводник 3. Известны конструкции металлических электродов, в которых слой металла нанесен на поверхность корпуса 1 путем напыления.
В качестве сравнительных электродов в потенциометрических анализаторах используются металлические электроды. В силу того, что в потенциометрическом анализаторе сравнительный электрод служит для создания «опорного потенциала», он изолируется от анализируемой среды, а электрические связи его со средой осуществляются через раствор электролита постоянного состава (так называемый электролитический ключ).
Наиболее широкое применение в потенциометрических анализаторах имеют хлорсеребряный электрод (см. рис. 11.19, д). Он имеет стеклянный корпус 1, во внутренней полости которого расположен серебряный электрод 2, помещенный в 3,5 н. раствор 3 хлористого калия. Постоянный потенциал серебряного электрода обеспечивается наличием избытка хлористого серебра, которое в виде пасты 4 из кристаллов последнего располагается в верхнем отсеке электрода. Эластичные резиновые мембраны 5 предохраняют электрод от попадания внутрь его посторонних ионов из анализируемой жидкости при погружении в него электрода.
Электрический контакт между анализируемой жидкостью и раствором хлористого калия обеспечивается через кольцевые зазоры между внутренней поверхностью корпуса 1 и резиновыми мембранами 5 в местах прилегания последних к поверхности. Изменение объема жидкости, заполняющей электрод, при изменениях температуры компенсируется за счет деформации резиновых мембран.
Рассмотренные конструкции измерительных и сравнительных электродов позволяют сделать вывод о том, что в работе гальванической ячейки потенциометрического анализатора в общем случае используются все перечисленные потенциалы. Электрическая схема гальванической ячейки потенциометрических анализаторов концентрации ионов показана на рис. 11.21. Сигнал такой ячейки определяется алгебраической суммой всех потенциалов, возникающих в электрической цепи этой ячейки:
Е = ЕМ + ЕВН + ЕИ + ЕД + ЕСР, (11.53)
где ЕМ — потенциал внутреннего вспомогательного электрода; ЕВН — потенциал, возникающий между внутренней поверхностью мембраны измерительного электрода и приэлектродной жидкостью; ЕД — диффузионный потенциал на границе между анализируемой жидкостью и жидкостью, в которую погружен сравнительный электрод.
Потенциалы ЕМ и ЕСР описываются выражением (11.47), разности потенциалов ЕВН и ЕИ — выражением (11.51) или (11.52).
Все потенциалы, определяющие сигнал рассматриваемой гальванической ячейки, кроме ЕИ и ЕД, постоянны в процессе измерения и зависят только от температуры. Потенциалы ЕИ и ЕД изменяются при изменении концентрации определяемых ионов в анализируемой жидкости. Однако если изменение ЕИ несет измерительную информацию, то изменение ЕД является источником погрешности измерения. Поэтому обычно стремятся по возможности уменьшить значение (до 1—4 мВ) диффузионного потенциала и сделать его существенно меньшим (на 1—2 порядка) потенциала ЕИ. При таком условии изменения ЕД в процессе измерения будут оказывать меньшее влияние на его результаты. Таким образом, сигнал гальванической ячейки потенциометрического анализатора, предназначенного для измерения активной концентрации ионов с учетом (11.51) и (11.53), можно представить в виде
![]() (11.54)
(11.54)
где Е* = ЕМ + ЕВН + ЕД + ЕСР.
Р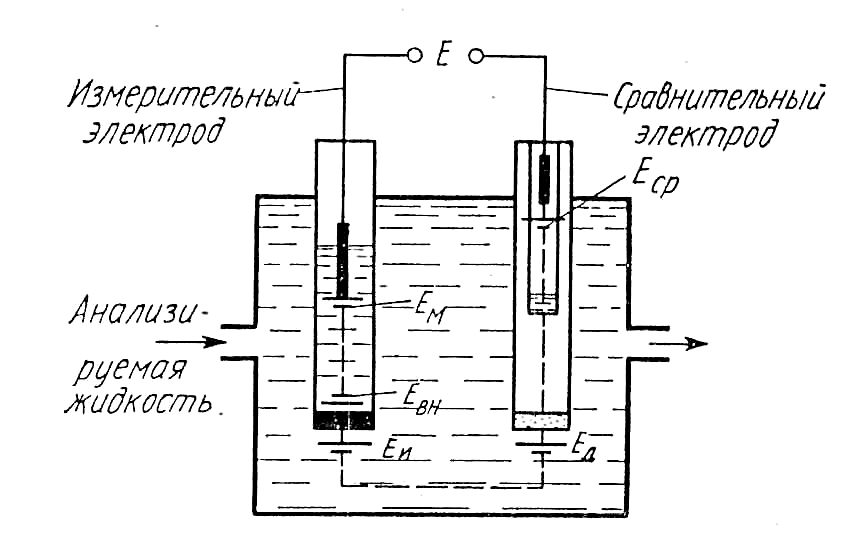 ис.
11.21. Электрическая схема гальванической
ячейки потенциометрических анализаторов
жидкостей
ис.
11.21. Электрическая схема гальванической
ячейки потенциометрических анализаторов
жидкостей
Выражение (11.54) в практике обычно записывают, используя десятичный логарифм:
![]() ,
(11.55)
,
(11.55)
Аналогично по структуре выражение, описывающее сигнал гальванической ячейки при измерении окислительно-восстановительного потенциала. Причем в качестве термина «окислительно-восстановительный» потенциал часто используют термин «окислительный» потенциал, предусматривая для этого потенциала положительный по отношению к нулю знак электрода. Как видно из выражения (11.55), зависимость сигнала гальванической ячейки от активной концентрации является нелинейной. При этом значения концентраций, измеряемых потенциометрическими анализаторами, составляют 10-2—10-7 г-ион/л. В связи с этим в 1907 г. датский химик Серенсен для выражения концентрации ионов водорода в растворах ввел понятие рН (р — первая буква слова Potenz — степень, Н — химический символ водорода), которое определяется как отрицательный десятичный логарифм активной концентрации водородных ионов:
pH= - lgai. (11.56)
С учетом (11.56) выражение (11.55) можно представить в виде
![]() .
(11.57)
.
(11.57)
Таким образом, сигнал гальванической ячейки связан с величиной рН линейно, а сама эта величина является мерой активной концентрации (грамм-ионов, содержащихся в 1 л анализируемой жидкости) .
Концентрация водородных ионов в дистиллированной воде равна 10-7 г-ион/л, и таким же является число ионов ОН- (вода диссоциирует на ионы H+ и ОН-). Поэтому для дистиллированной воды рН=7. Растворы с рН < 7 являются кислыми, а растворы рН > 7 — щелочными.
Удобство водородного показателя рН определило тот факт, что в настоящее время аналогичное понятие, а именно показатель рХ, используется для выражения активной концентрации самых различных ионов при потенциометрических измерениях с использованием ионсселейтивных электродов. При потенциометрическом определении окислительно-восстановительных свойств жидких веществ используют понятие еН.
Основной влияющей величиной при потенциометрических измерениях является температура. С изменением температуры анализируемой жидкости изменяются потенциалы измерительного и сравнительного электродов. Сигнал гальванической ячейки потенциометрического анализатора с увеличением температуры по абсолютной величине увеличивается в первом приближении по линейному закону.
Для измерения сигнала гальванического элемента потенциометрического анализатора используют измерительные приборы и нормирующие измерительные преобразователи.
Основное требование к этим измерительным устройствам — наличие высокого входного сопротивления. Так, при измерении рН и рХ оно должно составлять 500—1000 МОм. При измерении еН достаточным является входное сопротивление 1—10 МОм.
На рис. 11.22 приведены наиболее типичные схемы промышленных потенциометрических анализаторов жидкостей.
В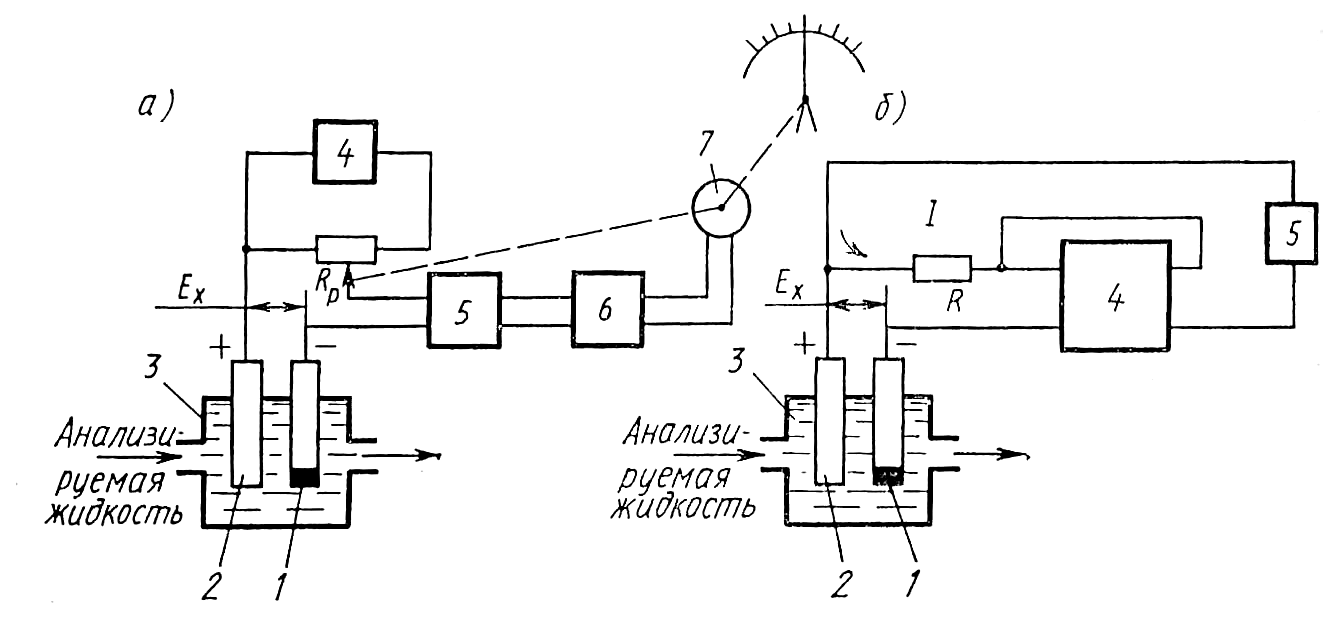 потенциометрическом анализаторе (рис.
11.22, а), который содержит гальваническую
ячейку 3 с измерительным 1 и сравнительным
2 электродами, измерение сигнала последней
осуществляется с помощью специального
автоматического потенциометра с
реохордом RP,
питающимся от стабилизированного
источника постоянного тока 4. При
измерении сигнал гальванической ячейки
сравнивается с падением напряжения по
реохорде. Отличие этого потенциометра
от описанного в § 6.6 состоит в том, что
кроме усилителя переменного тока 6,
реверсивного двигателя 7 и других узлов
он содержит электрометрический усилитель
5, имеющий входное сопротивление 600 МОм.
потенциометрическом анализаторе (рис.
11.22, а), который содержит гальваническую
ячейку 3 с измерительным 1 и сравнительным
2 электродами, измерение сигнала последней
осуществляется с помощью специального
автоматического потенциометра с
реохордом RP,
питающимся от стабилизированного
источника постоянного тока 4. При
измерении сигнал гальванической ячейки
сравнивается с падением напряжения по
реохорде. Отличие этого потенциометра
от описанного в § 6.6 состоит в том, что
кроме усилителя переменного тока 6,
реверсивного двигателя 7 и других узлов
он содержит электрометрический усилитель
5, имеющий входное сопротивление 600 МОм.
Рис. 11.22. Схемы потенциометрических анализаторов жидкостей
Потенциометрический анализатор (рис. 11.22, б) содержит гальваническую ячейку 3 с измерительным 1 и сравнительным 2 электродами, сигнал которой в процессе измерения сравнивается с падением напряжения на сопротивлении R, создаваемом током I. Последний унифицирован по значению и возникает в выходной цепи усилителя 4, имеющего высокое входное сопротивление. Таким образом, сигнал гальванической ячейки преобразуется в унифицированный сигнал промежуточным (нормирующим) преобразователем, принцип действия которого аналогичен рассмотренному в § 6.6. Унифицированный токовый сигнал измеряется вторичным прибором 5.
Известны схемы потенциометрических анализаторов, в которых предусмотрена коррекция показаний в зависимости от температуры анализируемой жидкости [1].
Потенциометрические автоматические анализаторы рН имеют диапазон измерений от 0—1 до 0—14 рН и время реакции 15—30 с, а анализаторы рХ — диапазоны измерений от 0—1 до 0—5 рХ и время реакции 5—10 мин. Классы точности потенциометрических анализаторов 0,5—10.
